二至丸合桂枝汤对乳腺癌异种移植瘤裸鼠对顺铂耐药性的影响
2022-07-07杨慧芬毛娟娟
杨慧芬,毛娟娟
(1杭州市中医院·浙江 杭州 310007;2宁波市中医院·浙江 宁波 315500)
三阴性乳腺癌(Triple Negative Breast Cancer, TNBC)是指雌激素受体(ER)、孕激素受体(PR)和人表皮生长因子受体2(Her2)均呈阴性的乳腺癌,占所有乳腺癌种类的10%~20%[1]。相比于其他类型乳腺癌,TNBC具有恶性程度高、生存率低、易复发转移等特点[2]。顺铂是一种高效的广谱抗癌药,能够有效诱导肿瘤细胞凋亡,也是目前临床治疗乳腺癌的一线药物[3-4]。长期重复使用同一种药物容易使肿瘤细胞耐药,顺铂也不例外[5],解决顺铂的耐药问题一度成为研究热点。本课题组前期研究成果证实二至丸合桂枝汤(EGD)对绝经前Luminal型乳腺癌治疗后潮热具有明显的疗效[6],本研究将通过建立顺铂耐药的三阴性乳腺癌异种移植瘤裸鼠模型,探讨EGD对成瘤小鼠对顺铂耐受的影响,并初步阐明相关的作用机制。
1 材料
1.1 细胞与动物 三阴性乳腺癌细胞株MDA-MB-231:购自中国科学院上海细胞库。BALB/c裸鼠,4 周龄,雄性,体质量(20±3)g,购买于上海斯莱克实验动物有限责任公司,动物生产许可证号:SCXK(沪)2017-0005。
1.3 主要仪器 CMaxPlus型酶标仪:美国Molecular Devices公司;Micro17R型低温高速离心机:美国Thermo公司;RM2016型病理切片机:上海徕卡仪器有限公司;KD-P 型组织摊片机:浙江金华科迪仪器设备有限公司;NIKON ECLIPSE E100型正置光学显微镜:日本尼康公司;LightCycler® 96型实时荧光定量PCR仪:德国罗氏诊断;EPS300型电泳仪:上海天能科技有限公司;610020-9Q型化学发光仪:上海勤翔科学仪器有限公司。
2 方法
2.1 顺铂耐药三阴性乳腺癌细胞株建立 采用药物连续诱导法,通过逐步增加顺铂浓度的方法诱导筛选耐药细胞株。取对数生长期的MDA-MB-231细胞接种至含顺铂的DMEM 培养液中,按照顺铂浓度0.01、0.1、0.5、1、5、10 μmol/L逐渐诱导耐药细胞株。诱导作用48 h 后弃去原浓度培养液,换入新浓度培养液。平均每2~3 d传代1 次,以确保细胞活力。逐步提升药物浓度至起始诱导浓度的10 倍,总共诱导历时6 个月。获得对顺铂具有耐药性的MDA-MB-231细胞株(MDA-MB-231/CDDP)。
2.2 裸鼠成瘤及分组 取健康BALB/c裸鼠30只,将裸鼠适应性饲养1周,正常饮食。将MDA-MB-231/CDDP细胞复苏后培养传代,收集对数生长期细胞,以生理盐水调整细胞浓度至1×107/mL,以每只0.2 mL 接种于裸鼠背部皮下。观察移植后裸鼠的成瘤情况,尽量使每只裸鼠的体质量及瘤体大小相当。每日观察,待移植瘤长至0.5 cm3大小时,将裸鼠随机分组,分为模型组、EGD[50 mg/(kg·d)]组、EGD[100 mg/(kg·d)]组、EGD[200 mg/(kg·d)]组以及EGD[200 mg/(kg·d)]+顺铂(20 mg/kg)组,每组6只。模型组正常饮食,给药组每天灌胃给药,连续给药28 d,停药后第2天处死裸鼠。给药期间密切观察裸鼠的一般状况,包括精神状态、活动、饮食及大小便情况。每周用游标卡尺测量肿瘤大小,每天观察注射点有无破溃红肿。给药结束后,将裸鼠处死。
2.3 观察指标
2.3.1 移植瘤体积及重量检测 出现移植瘤后每隔3~4 d测量1次肿瘤大小,最长径(a)与最短径(b),根据公式来计算肿瘤体积:体积V(mm3)=(a×b2)×0.5236,肿瘤抑制率计算公式:抑瘤率=[(V对照组-V实验组)/V对照组]×100%。出于人道的原因,当肿瘤体积达到4 000 mm3时,对动物进行安乐死。取出肿瘤后对肿瘤进行称重。对每组瘤体进行拍照,每组至少3 个平行瘤体。
2.3.2 血清HIF-1ɑ和VEGF ELISA检测 裸鼠处死后取血,3 500 r/min 离心15 min,取上清,将所得的血清放入-80 ℃冰箱备用,使用ELISA检测试剂盒检测血清HIF-1α和VEGF的含量,具体操作步骤按照ELISA试剂盒操作说明进行。
2.3.3 HE染色观察肿瘤组织病理变化 裸鼠处死后,剥离肿瘤组织,常规方法进行石蜡包埋,随后切片。将切片先后放入二甲苯、乙醇,自来水冲洗后放入苏木素染液染3~5 min,自来水洗,返蓝液返蓝,流水冲洗;再将切片依次入85%、95%的梯度酒精脱水各5 min,入伊红染液中染色5 min,脱水、透明后采用中性树胶封片,在显微镜下(×400)进行图像采集分析。
2.3.4 TUNEL染色观察肿瘤细胞凋亡 根据TUNEL试剂盒说明书操作步骤进行染色处理,然后在显微镜(×400)下观察采集图像,在每组切片的缺血边缘随机选择5个视野,DAPI染出来的细胞核在紫外的激发下为蓝色,试剂盒为FITC荧光素标记,阳性凋亡细胞核为绿色,利用Image-Pro plus图像分析软件统计阳性细胞个数,取平均值,计算凋亡细胞百分率。
步骤3:并行运行降阶和全阶自适应交互双模算法。当采用降阶估计值保障系统实时性时,在计算耗时较长的全阶算法运行完成一次后修正一次降阶估计值,以提高测速精度。若返回步骤2;若重复步骤3。
2.3.5 qRT-PCR检测肿瘤组织HIF-1α和VEGF表达 取200 mg肿瘤组织加入匀浆管中,加入1 mL的Trizol试剂提取总RNA,按照逆转录试剂盒以及SYBR Premix Ex TaqII试剂盒中操作说明进行逆转录和qRT-PCR。qRT-PCR所用引物序列信息如表1所示。

表1 引物序列
2.3.6 Western Blot检测肿瘤组织HIF-1和VEGF蛋白表达 取100 mg肿瘤组织样品置于培养皿中,用干净的剪刀将组织块尽量剪碎,加入1 mL冷 Lysis Buffer,组织匀浆机中进行匀浆(3×20 s),使组织尽量碾碎,冰上静置裂解15 min。将匀浆液放入离心管中,12 000 g,4 ℃离心 5 min,取上清转移至新的预冷离心管中,用 BCA试剂盒测定蛋白浓度,蛋白加热变性后上样,用SDS-PAGE分离总蛋白,随后用湿转法转移至PVDF膜上,加一抗在4 ℃下过夜,第2天加二抗室温孵育2 h后用ECL显影。

3 结果
3.1 各组裸鼠肿瘤重量及体积测量结果 见表2。

表2 各组裸鼠肿瘤重量及体积的比较
3.2 各组裸鼠血清HIF-1α和VEGF 的ELISA检测结果 见表3。

表3 各组裸鼠血清HIF-1α和VEGF含量比较
3.3 各组裸鼠肿瘤组织病理变化观察结果 模型组裸鼠肿瘤组织中炎症细胞浸润明显,细胞排列稠密;与模型组相比,EGD[50 mg/(kg·d)]组肿瘤组织病理形态无明显改变,EGD[100 mg/(kg·d)]组与EGD[200 mg/(kg·d)]组肿瘤细胞呈现不规则的团块状或条索状分布,肿瘤细胞出现明显的异型性,EGD[200 mg/(kg·d)]+顺铂(20 mg/kg)组移植瘤细胞相对稀疏,排列紊乱,并且可见部分细胞的凋亡与坏死。见图1。

图1 各组裸鼠肿瘤组织病理学变化(HE,×400)
3.4 各组裸鼠肿瘤细胞凋亡情况 模型组中无明显绿色荧光出现,EGD[50 mg/(kg·d)]、EGD[100 mg/(kg·d)]组、EGD[200 mg/(kg·d)]组以及EGD[200 mg/(kg·d)]+顺铂(20 mg/kg)组中绿色荧光数量逐渐增多,见图2。各组凋亡率比较见表4。

图2 各组裸鼠肿瘤细胞凋亡的TUNEL染色结果(×400)
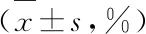
表4 各组裸鼠肿瘤细胞凋亡率比较
3.5 各组裸鼠肿瘤组织HIF-1ɑ、VEGF mRNA表达的qRT-PCR检测结果 与模型组相比,EGD[50 mg/(kg·d)]组和EGD[100 mg/(kg·d)]组裸鼠肿瘤组织中HIF-1ɑ、VEGF mRNA表达水平无显著性差异,而EGD[200 mg/(kg·d)]组和EGD[200 mg/(kg·d)]+顺铂(20 mg/kg)组中HIF-1ɑ、VEGF mRNA表达量较模型组显著降低(P<0.01)。见图3。

注:A.模型组;B. EGD[50 mg/(kg·d)];C.EGD[100 mg/(kg·d)];D.EGD[200 mg/(kg·d)];E.EGD[200 mg/(kg·d)]+顺铂(20 mg/kg);与模型组比较,*P<0.05,**P<0.01
3.6 各组裸鼠肿瘤组织HIF-1ɑ、VEGF蛋白表达的Western Blot检测结果 见图4。

注:A.模型组;B.EGD[50 mg/(kg·d)];C.EGD[100 mg/(kg·d)];D.EGD[200 mg/(kg·d)];E.EGD[200 mg/(kg·d)]+顺铂(20 mg/kg);与模型组比较,*P<0.05,**P<0.01
与模型组相比,EGD[50 mg/(kg·d)]组裸鼠肿瘤组织HIF-1ɑ、VEGF 蛋白表达水平无显著性差异,而EGD[100 mg/(kg·d)]组、EGD[200 mg/(kg·d)]组和EGD[200 mg/(kg·d)]+顺铂(20 mg/kg)组中HIF-1ɑ、VEGF 蛋白的表达量较模型组显著降低(P<0.05或P<0.01)。
4 讨论
顺铂作为临床治疗乳腺癌的一线用药,其抗肿瘤作用主要是通过抑制肿瘤细胞增殖以及诱导肿瘤细胞凋亡实现[7]。随着顺铂在临床上长期重复的使用,无可避免地造成了乳腺癌细胞对顺铂的耐药,这种耐药情况的出现将进一步导致治疗的失败甚至是病情的恶化[8-9]。中医学理论认为,乳腺癌患者内分泌失调症状的根本在于肝郁脾虚、肝肾阴亏、阴虚火旺,先天肾气衰退则后天营卫不和,临床表现为肝肾阴亏、营卫不和[10]。二至丸由旱莲草和女贞子组成,具有益肝补肾、入肾补精之功效;桂枝汤由桂枝、生姜、芍药、大枣以及炙甘草组成,具有补脾胃以生气血、调阴阳平衡之功效[11-13]。本研究主要研究二至丸、桂枝汤两方合用对乳腺癌异种移植瘤对顺铂耐药性的影响。
本研究首先采用药物连续诱导法构建乳腺癌顺铂耐药细胞株MDA-MB-231/CDDP,然后在裸鼠皮下注射MDA-MB-231/CDDP细胞株,制备乳腺癌异种移植瘤裸鼠模型,以此为模型来探究EGD在移植瘤裸鼠对顺铂耐药的作用及相关的机制。对裸鼠移植瘤的大小和肿瘤重量的检测结果显示,相对于模型组,不同浓度的EGD干预后,肿瘤的体积和重量均明显减小,表明EGD对乳腺癌耐药细胞的异种移植瘤的生长具有显著的抑制作用。HE染色结果证实,相对于模型组,EGD组裸鼠的肿瘤细胞呈现不规则的团块状或条索状分布,肿瘤细胞出现明显的异型性,细胞变得相对稀疏,排列紊乱,并且EGD浓度越高,上述变化程度越重。此结果更进一步表明EGD具有有效的体内抑瘤作用。细胞凋亡是指机体细胞在发育过程中,通过细胞内基因或者其产物的调控进而发生的一种细胞程序性死亡方式,细胞凋亡水平的研究对阐明肿瘤的发病机制具有重要的指导意义[14-15]。本研究采用TUNEL法从形态学角度探究EGD干预对移植瘤裸鼠肿瘤组织细胞凋亡的影响,结果显示,与模型组相比,EGD低、中、高剂量组裸鼠的细胞凋亡水平均显著升高,表现出剂量依赖性,并且高浓度EGD和顺铂联用组的肿瘤细胞凋亡水平最高,表明EGD能够通过诱导肿瘤细胞凋亡逆转乳腺癌异种移植瘤裸鼠对顺铂的耐药性。
研究发现VEGF和HIF-1α在肿瘤新生血管生成过程中发挥着重要的作用[16],HIF-1α是介导细胞适应缺氧微环境的核心转录因子,VEGF是HIF-1α的重要靶基因之一,VEGF通过作用于血管内皮细胞表面的VEGF-R1和VEGF-R2,促进血管的形成,进而使肿瘤细胞适应缺氧的微环境,阻断HIF-α/VEGF通路的表达已经成为目前抗肿瘤研究的热点之一[17-18]。为了探究EGD的体内逆转耐药作用是否涉及HIF-α/VEGF通路,本研究采用ELISA检测试剂盒检测裸鼠血清HIF-1α和VEGF因子的含量变化,结果表明相对于模型组,EGD组以及EGD和顺铂联用组裸鼠血清HIF-1α和VEGF含量均显著降低。采用qRT-PCR法以及Western Blot法检测基因和蛋白表达进一步证实,EGD干预后HIF-1α和VEGF在mRNA和蛋白水平上均显著降低。综上所述,本研究初步证明了EGD能够通过HIF-α/VEGF通路逆转乳腺癌异种移植瘤裸鼠对顺铂的耐药性。
