蓖麻油脱水热力学分析
2022-07-06靳福全
靳福全
(太原工业学院化学与化工系,山西太原 030008)
关于蓖麻油脱水的研究报道较多,区别主要集中在催化剂的选择上。研究最多的催化剂是硫酸氢钠[1-5],其次是硫酸[6-9]、铜钨酸[10-11]、磷酸[12]、五氧化二磷[13]等。也有学者对蓖麻油脱水动力学[14-15]进行过研究。但未见有蓖麻油脱水热力学方面的研究报道,由于蓖麻油及其脱水产物为非常见化合物,其热力学数据无处可查,故采用估算法对其进行估算。根据估算值计算了蓖麻油脱水各步反应及总反应的热力学数据和温度的关系,并对这些关系式进行了讨论。
蓖麻油脱水各步反应及总反应为:

脱水前蓖麻油中的双键均为顺式结构,脱水后新形成的双键假设均形成反式结构且跟原来的双键构成共轭双键结构。按此结构进行热力学数据的估算及脱水反应的热力学分析。
1 反应系统物质热力学数据的估算[16-18]
1.1 有机物Δf (1,298.15 K)的估算
(1)用Benson 基团加和法估算有机物的Δf(g,298K)
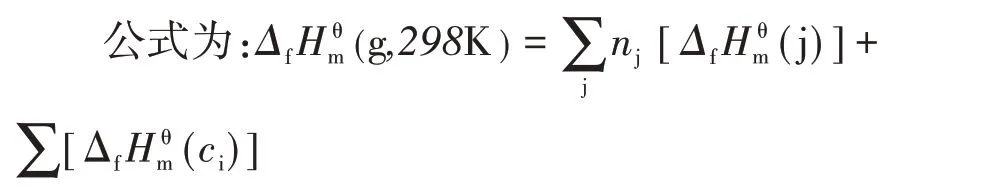
nj—j型基团的数目;Δf(j)—j型基团生成焓参数;Δf(ci)—i型修正参数。
(2)用Fedors 基团参数法估算液态有机物的Δv(298.15 K)
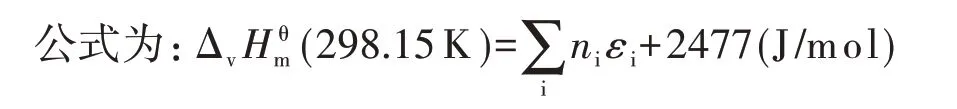
ni—i基团数目;εi—i基团对气化能的贡献。
(3)有机物Δf(1,298.15 K)的计算

1.2 有机物(1,298.15 K)的估算
(1)用Benson 基团加和法估算有机物的(g,298.15 K)

(i)—i基团的贡献;νi—i基团数目。σ—分子的对称数;η—分子的对映异构体数。对于环状化合物、顺式异构体等还需引入修正值。
(2)用Joback 法估算液态有机物的正常沸点公式为:Tb=198+∑ΔTb
Tb—正常沸点,K;∑ΔTb—各种基团贡献值之和,K。
(3)液态有机物Δv(298.15 K)的计算

(4)有机物(1,298.15 K)的计算
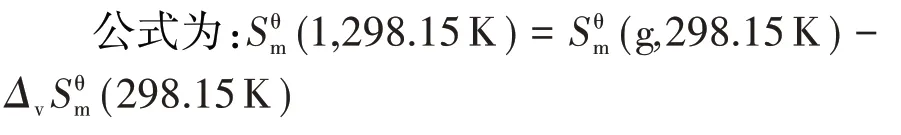
1.3 有机物Cp,m(l)与T的关系式的估算
(1)用Rihani基团加和法估算有机物Cp,m(g)与T的关系式
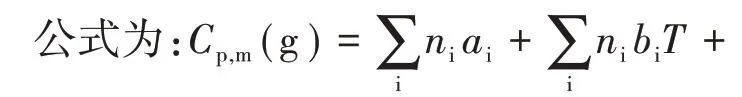
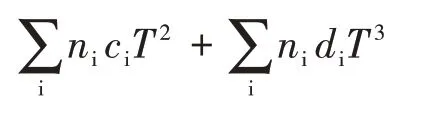
ni—i基团的数目,ai,bi,ci和di分别表示i基团对Cp,m(g)与T关系式中的经验常数a、b、c和d的贡献。
(2)有机物Cp,m(l)与T的关系式
公式为:Cp,m(l)-Cp,m(g)=k(J/K·mol),其中k取48.86。
采用前述方法估算的反应系统物质的热力学数据及查得的水的热力学数据一并列于表1及表2。
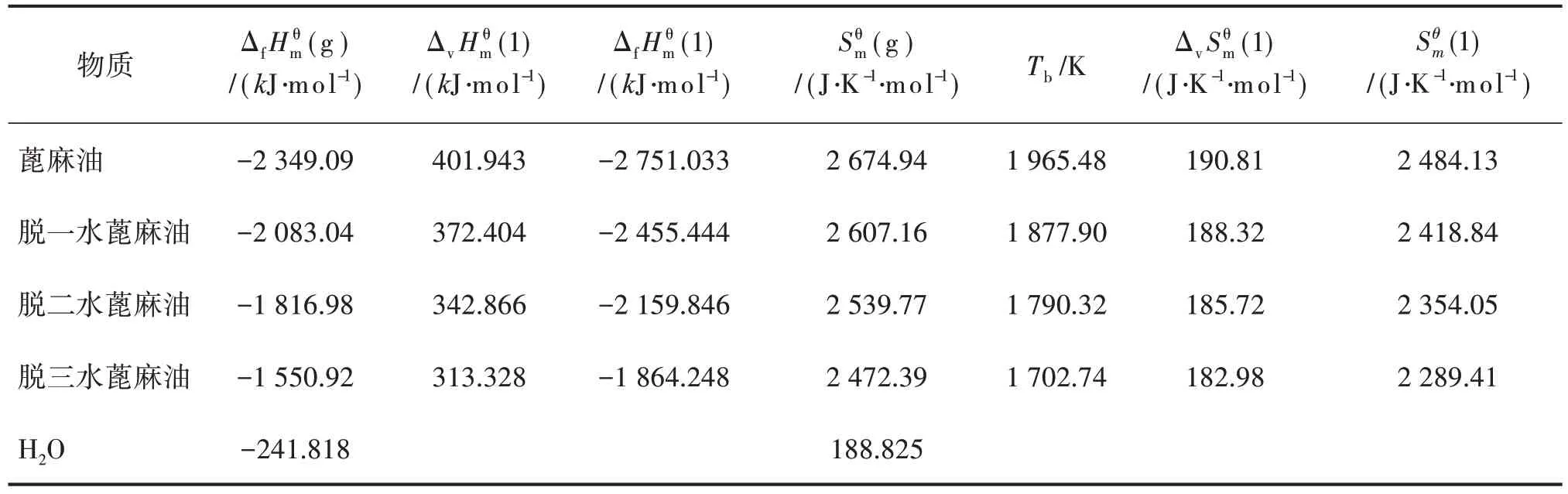
表1 反应系统物质的热力学数据(298.15 K)

表2 反应系统物质的Cp,m(1)与T的关系
2 蓖麻油脱水反应热力学数据和温度的关系
2.1 第一步脱水反应
ΔrCp,m=Cp,m(脱一水蓖麻油,l)+Cp,m(H2O,g)-Cp,m(蓖麻油,l)=(18.9242-8.7056×10-2T+0.75378×10-4T2-0.02121×10-6T3)(J/K·mol)

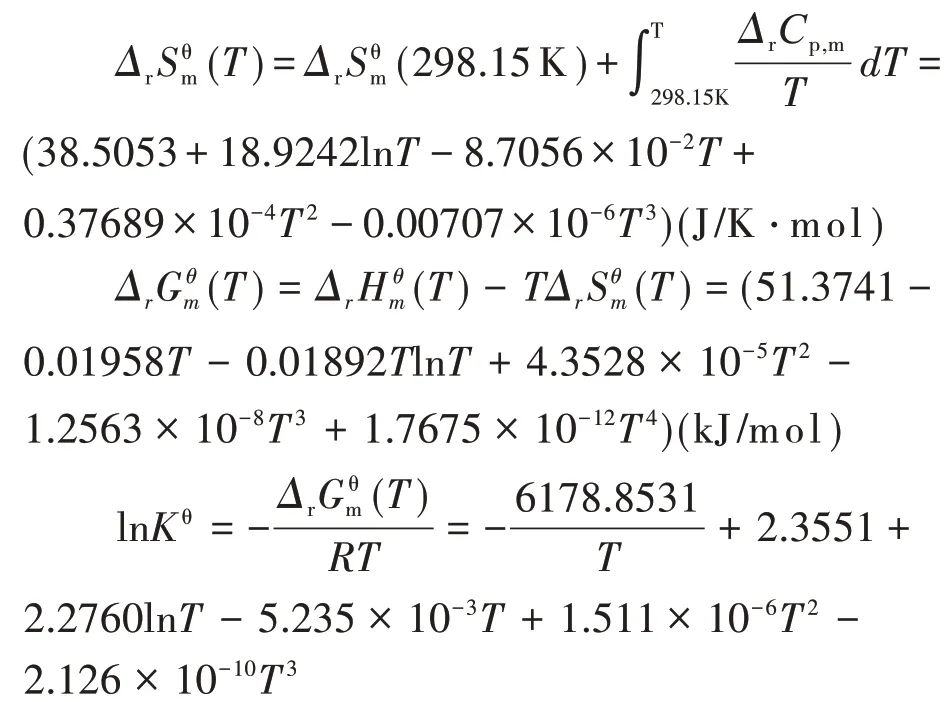
将不同温度带入上述各式,计算结果见表3。

表3 第一步脱水反应热力学数据和温度的关系
2.2 第二步脱水反应
ΔrCp,m=Cp,m(脱二水蓖麻油,l)+Cp,m(H2O,g)-Cp,m(脱一水蓖麻油,l)=(18.9242-8.7056×10-2T+0.75378×10-4T2-0.02121×10-6T3)(J/K·mol)


将不同温度带入上述各式,计算结果见表4。
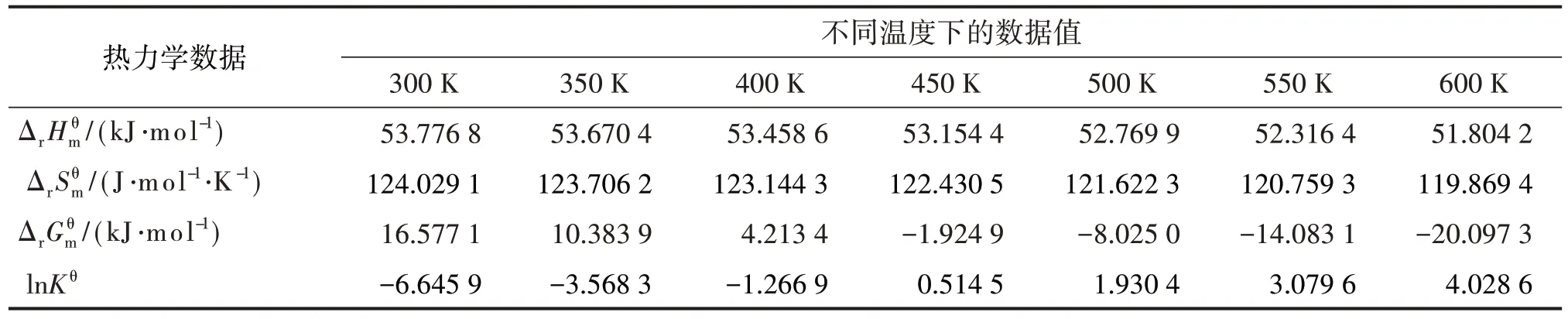
表4 第二步脱水反应热力学数据和温度的关系
2.3 第三步脱水反应
将不同温度带入上述各式,计算结果见表5。
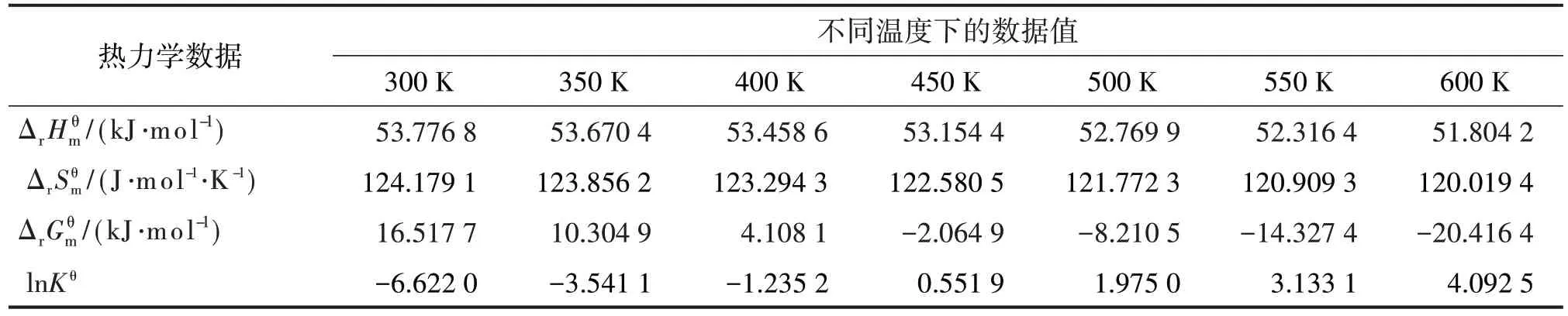
表5 第三步脱水反应热力学数据和温度的关系
ΔrCp,m=Cp,m(脱三水蓖麻油,l)+Cp,m(H2O,g)-Cp,m(脱二水蓖麻油,l)=(18.9242-8.7056×10-2T+0.75378×10-4T2-0.02121×10-6T3)(J/K·mol)


将不同温度带入上述各式,计算结果见表5。
2.4 总脱水反应
ΔrCp,m=Cp,m(脱三水蓖麻油,l)+3Cp,m(H2O,g)-Cp,m(蓖麻油,l)=(56.7726-26.1168×10-2T+2.2613×10-4T2-0.06363×10-6T3)(J/K·mol)


将不同温度带入上述各式,计算结果见表6。

表6 总脱水反应热力学数据和温度的关系
3 讨论
将各步反应及总反应的热力学数据与温度的关系分别作于图1~4。

图1 标准摩尔反应焓与温度的关系
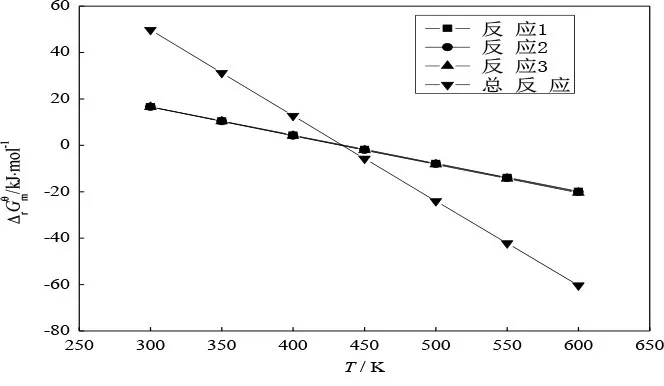
图3 标准摩尔反应吉布斯函数与温度的关系
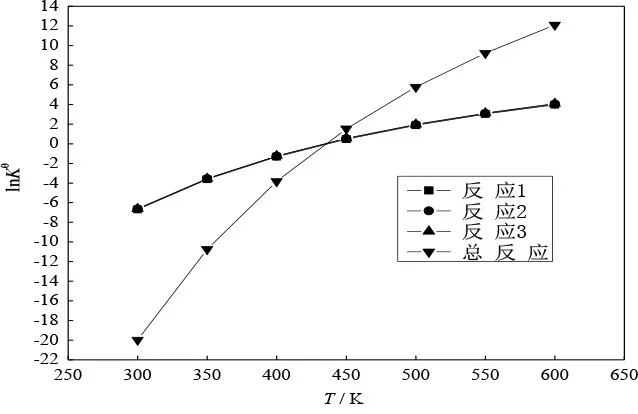
图4 标准平衡常数与温度的关系
从4个图可看出,每个图中均为两条线。其实显示的是三步反应(三条线几乎重合在一起)的一条线和总反应的一条线。说明三步反应的同一热力学函数与温度的关系几乎是一样的。从图1、图2可看出,标准态下三步反应及总反应均为吸热反应和熵增反应;三步反应及总反应的、几乎不随温度变化。从图3、图4 可看出,三步反应及总反应的 随温度升高而下降,随温度升高而上升。400~450 K 是由正变负、由负变正、由小于1 变为大于1 的过渡温区,也就是在标准态时反应由非自发变为自发的过渡温区。这也正是蓖麻油脱水需控制在较高温度的热力学原因。蓖麻油脱水实际是在减压条件下进行,反应温度一般控制在473~523 K范围。
