超表达miR528 增强盐胁迫下水稻幼苗K+稳态
2022-07-06雷振山王童童张天海王付娟董丽平赵亚帆
雷振山,王童童,季 新,张天海,王付娟,董丽平,赵亚帆,刘 娟
(1. 信阳农林学院,河南 信阳 464000;2. 新乡市农业科学院,河南 新乡 453000;3. 河南农业大学农学院/河南省水稻生物学重点实验室,河南 郑州 450046)
盐胁迫是主要的环境胁迫之一,严重影响农作物的生长发育和产量。我国内陆盐碱地约为1亿hm2,沿海滩涂为234 万hm2,是我国极为重要的后备耕地资源,综合利用潜力巨大[1]。水稻(Oryza sativa)是我国重要的粮食作物,同时也是改良沿海滩涂和盐碱地的先锋粮食作物。因此,挖掘水稻耐盐基因,培育耐盐水稻新品种,提高水稻耐盐性,对扩大耕地面积、提高水稻生产效率进而保障我国粮食安全具有重要意义。
盐胁迫对植物造成的伤害主要包括渗透胁迫、氧化胁迫和离子毒害,进而导致植物营养失衡,尤其是K+的缺乏[2]。K 作为第二大矿质营养元素,对植物细胞的生理代谢具有重要的作用。大量研究表明,许多植物的根K+保留能力与其盐胁迫耐受性呈正相关[3]。盐胁迫诱导植物根K+外排主要通过2条途径:去极化激活外向整流型K+选择性通道(Guard cell outward rectifying K+channel,GORK)和可渗透的非选择性阳离子通道(Non‐selective cation channel,NSCC)[4‐5]。此外,盐胁迫还会导致植物体内活性氧(ROS)的过度积累[6],而ROS 能够激活NSCC,进而刺激K+外排[7‐8]。LIU 等[9]研究发现,在盐胁迫条件下,耐盐水稻品种根中OsGORK的表达水平明显低于盐敏感水稻品种,且根K+的保留对水稻耐盐性具有重要调控意义。因此,培育具有良好K+保留能力的水稻品种是提升水稻耐盐性的重要途径。
MicroRNA(miRNA)是一类广泛存在于生物体内的非编码小分子RNA,其长度为21~24 nt[10]。在植物中,miRNA 负调控其靶基因,参与调节植物的生长发育、形态建成和生物及非生物胁迫响应过程[11‐12]。近年来,研究者揭示了高盐胁迫条件下水稻[13]、玉米[14]和番茄[15]等作物miRNA 的表达模式,并探究了相关miRNA 在响应盐胁迫过程中的调控机制。孟淑君等[13]通过高通量测序,在水稻根中检测到12种盐胁迫响应的miRNA,其中,miR159、miR168和miR164 的表达受盐胁迫诱导,而miR397、miR396、miR156、miR167 和miR1432 的表达受盐胁迫抑制。ZEESHAN 等[16]研究发现,盐胁迫可分别诱导耐盐品种、盐敏感品种中43、75 个miRNA 表达,且预测miR156、miR160、miR171、miR319、miR159和miR9657 可提高水稻耐盐性。miR528 为单子叶植物特有且保守的一类miRNA,在植物生长发育和胁迫响应中发挥多种作用[17]。miR528 在水稻中具有较高的表达丰度。通过降解组测序分析发现,miR528 在水稻中具有生物学功能完全不同的多个潜在靶miRNA 位点[18]。ZHANG 等[19]研究发现,miR528 可通过直接靶向调控OsUCL23(Uclacyanin 23)来调节水稻花粉粒的形成。WU 等[20]研究发现,miR528抑制靶基因L-抗坏血酸氧化酶基因(AO)的表达,调节植物体内ROS 的积累水平,进而调控水稻抗病反应。YUAN 等[21]研究发现,超表达水稻miR528 能够提高匍匐翦股颖的耐盐性。WANG等[22]研究发现,超表达miR528可增强盐胁迫条件下水稻的ROS 清除能力,进而增强水稻的耐盐性。然而,miR528 是否调控盐胁迫下水稻植株K+平衡,以及相关的调控机制研究还鲜有报道。为此,以miR528超表达水稻及T-DNA 插入突变体mir528为试验材料,研究盐胁迫对其生长、K+含量、K+流速及K+通道基因表达量的影响,以期解析miR528 对盐胁迫条件下水稻幼苗K+稳态的调控作用。
1 材料和方法
1.1 试验材料
供试材料为野生型水稻中花11(ZH11)及其2个超表达miR528 株系(miR528-OE1、miR528-OE2)、野生型水稻Dongjin(DJ)及其T-DNA 插入突变体mir528(PFG_3A-1186.R),超表达miR528株系由上海交通大学薛红卫课题组提供,mir528突变体由中国科学院遗传与发育生物学研究所曹晓凤课题组提供[20]。
水培营养液配方参照国际水稻所营养液(Yoshida)配方:1.5 mmol/L NH4NO3、0.3 mmol/L NaH2PO4、0.5 mmol/L K2SO4、1.0 mmol/L CaCl2、1.6 mmol/L MgSO4、0.5mmol/L NaSiO3、20µmol/L Fe-EDTA、0.075 µmol/L(NH4)6Mo7O24、18.9 µmol/L H3BO3、9.5 µmol/L MnCl2、0.1 µmol/L CuSO4、0.2µmol/L ZnSO4、70.8µmol/L 柠檬酸,pH值5.5。
1.2 试验处理
挑选饱满的水稻种子,用10% H2O2消毒10 min,蒸馏水冲洗5~6 次,置于培养箱28 ℃催芽2 d。将露白的种子播于PCR板孔(底部有小孔)中,固定在泡沫板上,将泡沫板漂于水培盒子中,先用清水培养5 d,再用1/4全营养液培养2 d,之后用1/2全营养液培养2 d,最后采用全营养液培养。培养至苗龄15 d,在营养液中加入100 mmol/L NaCl 模拟盐胁迫处理(简称NaCl),以不添加NaCl 的营养液为对照(简称CK),其他培养条件均同盐胁迫处理。各处理均设3次生物学重复。
1.3 测定项目及方法
1.3.1 株高、生物量及相对含水量 于盐胁迫处理7 d 取样,采用直尺测量株高(从根基部到叶尖)。然后,用去离子水冲洗,吸水纸吸去组织表面的水分,称量植株根和地上部鲜质量,之后置于烘箱中烘干至恒质量,测定根和地上部的干质量,并计算相对含水量。
1.3.2 K+含量 将盐胁迫处理7 d 取样烘干的根和地上部样品研磨成粉末,用98%H2SO4-30%H2O2消解至溶液澄清。冷却后,用去离子水定容,利用火焰光度计(FP6410,上海精密科学仪器有限公司)测定植株地上部和根的K+含量。
1.3.3 K+流速 选取饱满一致的种子,消毒灭菌后置于缓冲液(0.5 mmol/L KCl、0.1 mmol/L CaCl2)中萌发生长5 d,将水稻幼苗根进行100 mmol/L NaCl 瞬时处理,采用非损伤微电极离子流速测定技术(MIFE 系统,塔斯马尼亚大学)测定水稻根成熟区K+的流速,在瞬时加100 mmol/L NaCl 处理前,先在无NaCl 的缓冲液中测定5 min,具体测定方法参考LIU等[9]的方法。
1.3.4 基因表达量 苗龄15 d 的水稻幼苗经100 mmol/L NaCl 处理0、1、48 h 后,取根样品,液氮速冻保存于-80 ℃冰箱备用。 采用TRIzol 试剂(Invitrogen)提取根总RNA,采用MMLV 逆转录酶试剂盒(TransGen Biotech)进行RNA、miRNA 的反转录。以β-actin基因为内参,分析miR528 和K+通道基因OsAKT1(ArabidopsisK+transporter 1)、OsGORK的表达量,其引物序列见表1。采用GoTaqqPCR反应混合体系(Promega)进行实时荧光定量PCR(qRT-PCR),其中,miRNA 的定量采用Stem-loop 方法。采用2−ΔΔCT法计算基因的相对表达量,具体反转录及定量反应体系参考赵亚帆[23]的方法。

表1 qRT-PCR所用引物序列Tab.1 Sequences of primers used for real-time fluorescence quantitative PCR
2 结果与分析
2.1 盐胁迫对不同水稻材料miR528表达量的影响
由图1 可知,盐胁迫处理0 h 时,与野生型水稻ZH11 相比,超表达miR528 水稻株系miR528-OE1、miR528-OE2 中miR528 表达量极显著提高,分别提高了16.43、33.67 倍;与野生型水稻DJ 相比,突变体mir528中miR528 表达量显著下降。盐胁迫诱导miR528 表达,且超表达株系miR528-OE1、miR528-OE2 中miR528 表达量远高于野生型水稻。在盐胁迫处理1 h 时,与野生型水稻ZH11 相比,miR528-OE1、miR528-OE2 株系中miR528 表达量分别提高35.21、31.87倍。而盐胁迫条件下,突变体mir528中miR528表达量低于野生型水稻DJ。

图1 盐胁迫对不同水稻材料miR528表达量的影响Fig.1 Effect of salt stress on the expression level of miR528 in different rice materials
2.2 盐胁迫对不同水稻材料幼苗生长的影响
由表2 可知,在CK 条件下,超表达株系miR528-OE1、miR528-OE2 及突变体mir528株高、地上部鲜质量、地上部干质量、根鲜质量、根干质量和相对含水量均低于其相应的野生型水稻。盐胁迫条件下,超表达株系miR528-OE1、miR528-OE2株高、地上部鲜质量、地上部干质量、根鲜质量和相对含水量总体上均高于野生型水稻ZH11,而突变体mir528上述指标和根干质量均低于野生型水稻DJ。与CK 相比,盐胁迫明显抑制不同转基因材料的株高、地上部鲜质量、地上部干质量、根鲜质量、根干质量和相对含水量。与CK 相比,盐胁迫处理野生型水稻ZH11 的地上部鲜、干质量分别减少68.07%、53.76%,超表达株系 miR528-OE1、miR528-OE2 的地上部鲜质量和干质量下降幅度低于ZH11,仅分别减少56.39%、61.79%和40.34%、43.73%;而突变体mir528的地上部鲜、干质量降低幅度与野生型水稻DJ 相近。与CK 相比,盐胁迫处理野生型水稻DJ 根鲜、干质量分别降低49.54%、50.52%,突变体mir528降低幅度高于野生型水稻DJ;野生型水稻ZH11 根鲜、干质量分别下降51.28%、48.20%,超表达株系miR528-OE1 和miR528-OE2 根鲜、干质量降低幅度相同,均分别为27.20%、27.31%,明显低于野生型水稻ZH11。综上,超表达miR528 可以缓解盐胁迫对水稻植株生长的抑制,提高植株的耐盐性。

表2 盐胁迫对不同水稻材料幼苗生长的影响Tab.2 Effect of salt stress on the growth of seedlings of different rice materials
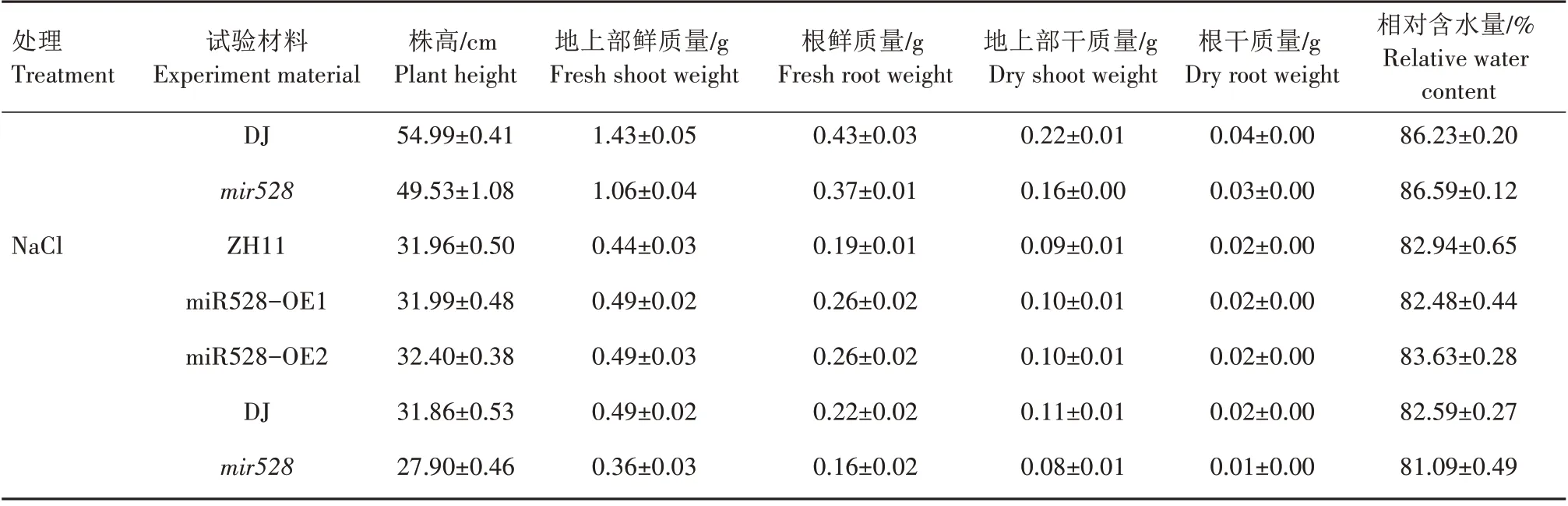
续表2 盐胁迫对不同水稻材料幼苗生长的影响Tab.2(Continued) Effect of salt stress on the growth of seedlings of different rice materials
2.3 盐胁迫对不同水稻材料幼苗K+含量的影响
由图2可知,CK 条件下,与野生型水稻ZH11相比,超表达株系miR528-OE1、miR528-OE2地上部、根K+含量无显著差异。盐胁迫条件下,超表达株系miR528-OE1、miR528-OE2 地上部和根K+含量均显著高于野生型水稻ZH11。与CK 相比,盐胁迫处理所有水稻材料地上部、根K+含量均明显降低,超表达株系miR528-OE1 和miR528-OE2 地上部、根K+含量下降幅度较野生型水稻ZH11 小,分别降低34.32%、42.16%和58.17%、59.12%。
由图2 可知,CK 条件下,突变体mir528地上部K+含量显著低于野生型水稻DJ,根K+含量与野生型水稻DJ 差异不显著;盐胁迫条件下,突变体mir528地上部K+含量与野生型水稻DJ 差异不显著,但根K+含量显著低于野生型水稻DJ。
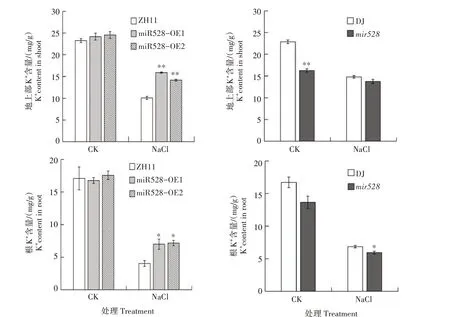
图2 盐胁迫对不同水稻材料地上部、根K+含量的影响Fig.2 Effect of salt stress on the K+content in shoots and roots of different rice materials
综上,超表达miR528 可提高盐胁迫下水稻K+含量,进而增强水稻耐盐性。
2.4 盐胁迫对不同水稻材料幼苗根K+流速的影响
由图3 可知,在未添加NaCl 的缓冲液中,不同水稻材料根成熟区K+外排较少,差距较小,且随时间推进无较大波动。5 min 后加入100 mmol/L NaCl,盐处理迅速导致所有水稻材料根成熟区K+外排。在盐胁迫处理后3~4 min 根成熟区K+外排达到峰值。随着盐处理时间延长,K+外排逐渐减弱并趋于平稳。但在盐胁迫处理后15 min,K+外排又呈现增加趋势。其中,超表达株系miR528-OE根K+外排最少。盐胁迫处理后,野生型水稻ZH11 根K+外排流速峰值为358.19 nmol/(m2·s),而超表达株系miR528-OE 根K+外排流速峰值仅为222.88 nmol/(m2·s),突变体mir528根K+外排流速峰值明显高于野生型水稻DJ。盐胁迫处理后26 min,超表达株系miR528-OE 根K+外排流速仅为169.17 nmol/(m2·s),而突变体mir528根K+外排流速高达300.12 nmol/(m2·s)。以上结果表明,超表达miR528可降低盐胁迫导致的水稻根K+流失,进而提高水稻耐盐性。
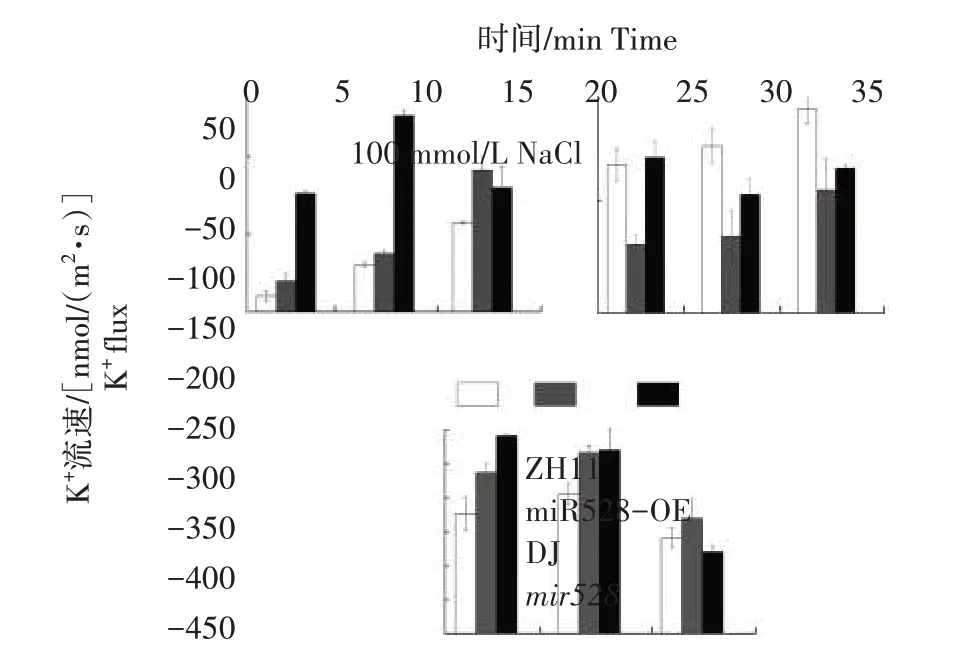
图3 100 mmol/L NaCl瞬时处理后不同水稻材料幼苗根成熟区K+流速Fig.3 K+flux in mature root zones of different rice materials after transient treatment with 100 mmol/L NaCl
2.5 盐胁迫对不同水稻材料幼苗根K+通道基因表达量的影响
为了进一步分析盐胁迫对不同水稻材料幼苗根K+通道基因表达量的影响,本研究测定了不同盐胁迫处理时间水稻幼苗根中OsAKT1、OsGORK基因的表达量。其中,OsAKT1在植物根中负责K+的吸收,OsGORK介导K+的外排。如图4 所示,盐胁迫处理0 h时,超表达株系miR528-OE1、miR528-OE2幼苗根OsAKT1基因表达量显著高于野生型水稻ZH11,突变体mir528幼苗根OsAKT1基因表达量与野生型水稻DJ差异不显著;盐胁迫处理1 h和48 h,miR528-OE1、miR528-OE2 幼苗根OsAKT1基因表达量显著低于野生型水稻ZH11,突变体mir528幼苗根OsAKT1基因表达量分别极显著和显著高于野生型水稻DJ。
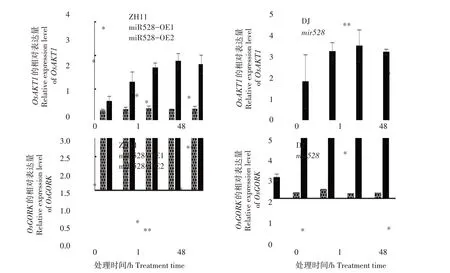
图4 盐胁迫对不同水稻材料幼苗根中OsAKT1和OsGORK表达量的影响Fig.4 Effect of salt stress on the expression levels of OsAKT1 and OsGORK in seedling roots of different rice materials
如图4 所示,盐胁迫处理0 h 时,超表达株系miR528-OE1、miR528-OE2 幼苗根OsGORK表达量显著高于野生型水稻ZH11,突变体mir528幼苗根OsGORK基因表达量显著低于野生型水稻DJ;盐胁迫处理1 h,超表达株系miR528-OE1、miR528-OE2幼苗根OsGORK基因表达量分别显著、极显著低于野生型水稻ZH11,突变体mir528幼苗根OsGORK基因表达量显著高于野生型水稻DJ;盐胁迫处理48 h,超表达株系miR528-OE1、miR528-OE2 幼苗根OsGORK基因表达量分别显著、极显著高于野生型水稻ZH11,而突变体mir528幼苗根OsGORK基因表达量显著低于野生型水稻DJ。
综上,超表达miR528 水稻植株可能通过抑制根OsGORK基因的表达来增强盐胁迫下K+的稳态。
3 结论与讨论
miRNA 在植物响应和适应盐胁迫过程中具有重要作用[24]。将与逆境相关的miRNA 通过基因工程技术转入植物可以提高植物的耐盐性[25]。ZHAO等[26]研究表明,超表达miR393a增强K+的吸收,提高匍匐翦股颖的耐盐性。段中鑫等[27]研究表明,超表达胡杨的miR156j可以改善盐胁迫下拟南芥种子萌发及生长状况,提高其耐盐性。AI 等[28]研究发现,超表达miR1861h 可促进盐胁迫下水稻幼苗生长,增强水稻的耐盐性。YUAN 等[21]研究发现,超表达水稻的miR528 通过改善含水量、质膜完整性、叶绿素含量及K+的保留能力,增强了匍匐翦股颖的耐盐性。本研究结果表明,超表达miR528 可以减轻盐胁迫对水稻生长的抑制,增加地上部和根鲜、干质量,提高水稻的耐盐性,这主要得益于超表达株系miR528-OE1、miR528-OE2 地上部和根K+含量较野生型水稻ZH11极显著或显著增加,与YUAN 等[21]研究结果相似。
为了进一步探究超表达miR528 提高盐胁迫条件下水稻K+含量的机制,本研究测定分析了K+流速及K+通道基因的表达量,发现盐胁迫处理后超表达株系miR528-OE 根K+的外排流速明显低于野生型水稻和突变体mir528,且与野生型水稻ZH11 相比,在盐胁迫处理1 h 时,miR528-OE1、miR528-OE2 幼苗根OsGORK基因表达量分别显著、极显著下降;而与野生型水稻DJ 相比,突变体mir528幼苗根OsGORK基因表达量在盐胁迫处理1 h 时显著增加。表明超表达miR528 增强盐胁迫条件下K+保留能力可能是通过下调盐胁迫条件下OsGORK基因表达来实现的。但是,在盐胁迫处理48 h 时,与野生型水稻ZH11 相比,超表达株系miR528-OE1、miR528-OE2 幼苗根OsGORK基因表达量分别显著、极显著提高;而与野生型水稻DJ 相比,突变体mir528幼苗根OsGORK基因表达量显著降低。GORK 通道由膜去极化激活,而它们的门控程度强烈依赖于细胞外的K+浓度[29]。前人研究表明,盐胁迫诱导GORK表达水平增加的生理机制可能是K+外排作为“代谢开关”的信号分子,抑制能量消耗,释放的能量可满足防御和修复的需求[30‐32]。这说明,随着盐胁迫时间延长,超表达株系miR528-OE 幼苗根中OsGORK基因表达量增加,可能是为了抑制能量的消耗,促进植株生长。此外,盐胁迫条件下K+的稳态还与K+的吸收能力有关。K+的低亲和性吸收主要通过K+通道,如内向型整合K+通道AKT1。MANUEL 等[33]研究发现,AKT1基因在植物根中表达,对K+的吸收起到重要调控作用。本研究发现,正常条件下,超表达株系miR528-OE1、miR528-OE2 幼苗根OsAKT1基因表达量显著高于野生型水稻ZH11;而在盐胁迫处理1 h 和48 h 时,miR528-OE1、miR528-OE2 幼苗根OsAKT1基因表达量均较野生型水稻ZH11 显著下降。WU等[3]指出,由于盐胁迫条件下植物的质膜电位明显去极化,AKT 家族介导K+的吸收在热力学上是不可能的。 HAK/KUP(High‐affinity K+transporter/K+uptake permease)是一个高亲和性K+转运蛋白家族,通过调节K+的转运来提高植物的耐盐性[34]。因此,AKT1 介导K+的吸收可能不是盐胁迫条件下miR528-OE1、miR528-OE2幼苗根保持较高K+含量的原因,而miR528 是否参与介导盐胁迫条件下HAK/KUP 的表达还有待进一步研究。有研究指出,盐胁迫条件下植物K+外排的另一条途径是ROS 激活的NSCC 通道[7‐8]。WANG 等[22]研究发现,超表达miR528 下调靶基因AO,增加抗坏血酸(AsA)和脱落酸(ABA)的含量,降低ROS的积累,进而增强水稻的耐盐性。可见,超表达miR528 增强盐胁迫条件下水稻K+的保留能力,还有可能与降低盐胁迫条件下ROS 的积累进而抑制ROS 激活的NSCC通道有关,这需要进一步的研究。
综上所述,miR528 正调控水稻的耐盐性,超表达miR528 可减弱盐胁迫对水稻生长的抑制,提高盐胁迫条件下水稻对K+的保留能力,这可能是通过下调OsGORK基因的表达量来实现的。
