畜肉中匹莫林的测定
2022-07-06勇艳华
勇艳华

摘 要:本文建立了检测畜肉中匹莫林的液相色谱-串联质谱法。采用乙腈提取,正己烷脱脂,液相色谱-串联质谱法测定,外标法定量。考察了方法的定量限、标准曲线线性、方法精密度等。结果表明,匹莫林浓度在1~200 μg/L线性良好,相关系数r=0.999 6,定量限为2.0 μg/kg,3个加标水平2.0 μg/kg、4.0 μg/kg、10.0 μg/kg,平均回收率为70.8%~85.3%,相对标准偏差为3.0%~5.4%。本方法具有前处理简单、精密度高、定量限低等优点,能够满足畜肉中匹莫林的测定。
关键词:畜肉;匹莫林;液相色谱-串联质谱
Determination of Pimorin in Animal Meat
YONG Yanhua
(Dalian Center for Certification and Food and Drug Control, Dalian 116630, China)
Abstract: A high performance liquid chromatography-tandem mass spectrometry method for determination of pimorin in meat was established. It is extracted by acetonitrile, degreased by n-hexane, determinated by liquid chromatography-tandem mass spectrometry, external standard method. The quantitative limit, linearity of standard curve and precision of the method were investigated. The results showed that the concentration of pimolin ranged from 1 to 200 μg/L has good linearity, the correlation coefficient is r=0.999 6, and the limit of quantitation is 2.0 μg/kg, 3 spiked levels were 2.0 μg/kg, 4.0 μg/kg, 10.0 μg/kg, the average recovery was 70.8%~85.3%, and the relative standard deviation was 3.0%~5.4%. The method has the advantages of simple pretreatment, high precision and low limit of quantitation, and can be used for the determination of pimolin in animal meat.
Keywords: animal meat; pimorelin; liquid chromatography-tandem mass spectrometry
匹莫林化学名称为2-亚氨基-5-苯基-4-恶唑烷酮,是一种中枢神经兴奋药物。通过提高中枢去甲肾上腺素的含量达到中枢兴奋的作用,其兴奋作用为咖啡因的5倍。虽然农业部176号公告《禁止在饲料和动物饮用水中使用的药物品种目录》中禁止匹莫林在饲料和动物饮用水中使用,但仍有饲养者在牲畜饲养过程中违法使用匹莫林,导致匹莫林在畜肉中殘留,对人体健康产生危害。匹莫林的不良反应主要包括对肝功能有损害,从肝酶无症状可逆性升高至肝炎、黄疸、肝功能衰竭;可引发再生障碍性贫血;对中枢神经系统有损伤;刺激胃肠道,导致恶心、胃痛;长时间使用可抑制人体生长[1]。因此,建立一种准确快速检测畜肉中匹莫林残留的分析方法迫在眉睫,不仅可以打击违法使用匹莫林的行为,还可为保护消费者健康提供技术支撑。
目前,报道的兴奋剂相关检测方法有胶体金试纸条法[2]、酶联免疫法[3-5]、化学发光免疫分析[6]、表面增强拉曼光谱法[7]、毛细管电泳法[8]、高效液相色谱法[9-11]、液相色谱串联质谱法[12-14]、气相色谱法[15]、气质法[16-17]和高分辨质谱法[18-19],液相色谱串联质谱法是最常用的方法。文献中检测匹莫林的基质为尿液和饲料,但畜肉中匹莫林的检测暂无报道。本文采用乙腈提取,液相色谱串联质谱仪进行检测,建立了畜肉中匹莫林的测定方法。该方法前处理简单,精密度高,定量限低,能满足畜肉中匹莫林的测定。
1 材料与方法
1.1 材料与试剂
标准物质匹莫林(Pemoline),CAS登录号2152-34-3,中国食品药品检定研究院生产的对照品;甲醇、乙腈、正己烷和甲酸,均为色谱纯;氯化钠,分析纯;实验用水为超纯水。
1.2 仪器与设备
高效液相色谱-串联质谱仪(1290/Agilent 6495,美国Agilent公司);均质机(IKA);涡旋混合器(IKA);超声波清洗器(科导);CR21N立式大容量高速离心机(日本Hiachi公司);氮吹仪(安谱)赛多利斯全自动超纯水机(德国Sartorius公司);Agilent poroshell 120 EC-C18色谱柱(50 mm×4.6 mm,2.7 μm,美国Agilent公司)。
1.3 实验方法
1.3.1 样品前处理
称取2.5 g(精确到0.01 g)混合均匀的样品于50 mL离心管中,加入2 mL水,均质1 min,加入5 mL乙腈,涡旋混匀1 min,超声提取20 min,加入2 mL正己烷,加入1 g NaCl,涡旋混匀1 min,12 000 r/min离心5 min,移取2 mL上层提取液氮吹至近干,准确加入1 mL体积分数为10%乙腈溶解,涡旋混匀1 min,过0.22 μm滤膜,待液相色谱串联质谱仪检测。
1.3.2 标准溶液的配制
称取匹莫林对照品约10 mg(精确至0.1 mg)于小烧杯中,用甲醇溶解并转移至100 mL容量瓶中,定容至刻度,得到浓度为0.1 mg/mL的标准储备液,于-18 ℃冷冻保存。准确移取标准储备液1.0 mL于100 mL容量瓶中,甲醇定容至刻度,得到浓度为1.0 μg/mL的标准工作溶液,于4 ℃冷藏保存。准确移取10 μL、100 μL、500 μL、1 000 μL和2 000 μL标准工作溶液,分别置于10 mL容量瓶中,10%乙腈定容至刻度,得到浓度为1 μg/L、10 μg/L、50 μg/L、100 μg/L和200 μg/L匹莫林系列标准上机溶液。
1.3.3 添加回收实验
以不含匹莫林的空白畜肉为基质,添加适量浓度为1.0 μg/mL的标准工作溶液,涡旋混匀1 min,静置1 h,按1.3.1样品前处理方法进行实验。
1.3.4 仪器条件
(1)色谱条件。色谱柱:Agilent poroshell 120 EC-C18(50 mm×4.6 mm,2.7 μm);柱温:35 ℃;流动相:A为0.1%甲酸水(体积分数),B为0.1%甲酸乙腈(体积分数);梯度洗脱程序:0~1.0 min,90%A,1.0~4.0 min,90%~0%A;4.0~5.0 min,0%A;5.1~7.0 min,90%A。流速:0.3 mL/min;进样体积:2 μL。
(2)质谱条件。电喷雾离子源(ESI);扫描方式:正离子扫描;毛细管电压:4 000 V;监测方式:多反应监测(Multiple Reaction Monitoring,MRM);离子源温度:200 ℃;去溶剂气温度:250 ℃;去溶剂气:氮气12 L/min;锥孔气:氮气11 L/min。其他参数详见表1。
2 结果与分析
2.1 提取试剂的选择
匹莫林难溶于水、乙醚、氯仿、丙酮、苯和稀盐酸,溶于无水乙醇、丙二醇、甲醇和丙酮,易溶于碱性溶液。本实验考察甲醇和乙腈提取效果,由于畜肉中含有大量蛋白质和脂肪,用甲醇提取还需进一步用固相萃取小柱净化,前处理相对烦琐;但乙腈对蛋白有沉淀作用,用乙腈作为提取试剂,正己烷除脂肪,前处理步骤简单,除蛋白和脂肪效果较好,因此选择乙腈作为提取试剂。
2.2 仪器条件的建立
匹莫林的结构决定了可以在反相色谱上获得分离,故采用C18色谱柱进行分离,流动相乙腈-水-甲酸混合梯度洗脱。优化了质谱检测中碰撞能量、脱溶剂气流速和温度、锥孔气流速等参数,确定灵敏度最高、稳定性和重现性最好的选择性提取离子作为定量离子,次之的作为定性离子。
2.3 线性范围及检出限
匹莫林标准工作溶液在1~200 μg/L浓度与峰面积呈线性相关。匹莫林线性方程为Y=5 594.264 692X-
5 371.773 294,相关系数r=0.999 6。以猪肉、牛肉、羊肉为基质,定量向其中添加匹莫林标准溶液,按1.3.1样品前处理方法提取测定后,质谱峰信噪比≥10
时的添加量确定为本方法的定量限,定量限为2.0 μg/kg。
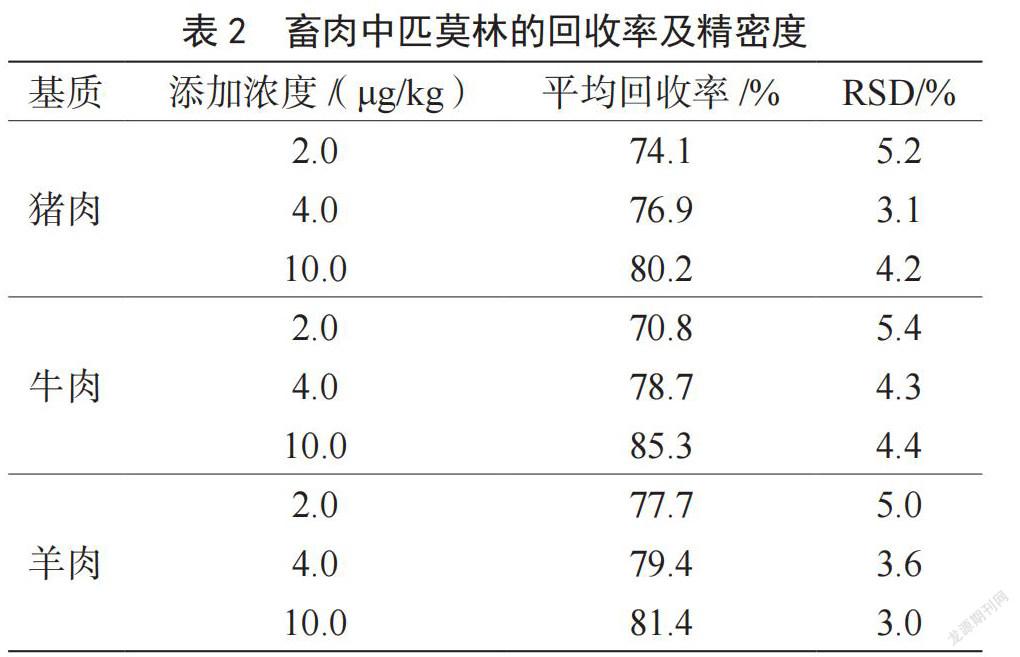
2.4 回收率和精密度
以不含匹莫林的猪肉、牛肉、羊肉为空白基质,将标准工作溶液按2.0 μg/kg、4.0 μg /kg和10.0 μg /kg
3个添加浓度加入空白基质中,考察平均回收率
及6次平行实验相对标准偏差(RSD),结果如表2所示。平均回收率为70.8%~85.3%,RSD≤5.4%。对猪、牛、羊肉按照本方法进行测试,未发现有本底干扰。
3 结论
本文建立了检测畜肉中匹莫林残留的高效液相色谱-串联质谱方法,匹莫林浓度在1~200 μg/L线性良好,相关系数r=0.999 6,定量限为2.0 μg/kg,3个加标水平2.0 μg/kg、4.0 μg/kg、10.0 μg/kg,平均回收率为70.8%~85.3%,相对标准偏差为3.0%~5.4%,此方法快速、高效、准确且便于操作,可用于畜肉中匹莫林残留的日常检测。
参考文献:
[1]王丹,杨悦,宋秋洁.匹莫林致肝损害情况分析及上市后监管[J].中国药物警戒,2006,3(1):36-39.
[2]李莎,白瑞樱,曾道平,等.胶体金免疫层析试纸条在猪尿β-兴奋剂多残留检测中的应用[J].食品工业科技,2016,37(20):53-58.
[3]万宇平,刘宇,陶光灿,等.动物组织中β-兴奋剂类药物多残留酶联免疫检测方法的建立[J].河南农业科学,2013,42(2):132-135.
[4]孙作刚,赵晓凤.用酶联免疫吸附法测定畜产品、饲料中β-兴奋剂类药物[J].草食家畜,2017(6):31-37.
[5]王向阳,同学政,王文珺.酶联免疫分析法在奥运食品安全检测中的应用[J].科技导报,2008,26(15):47-49.
[6]朱宝,奚惠芳.Access全自动微粒子化学发光免疫分析系统检测运动员兴奋剂122例报道[J].临床研究,2008,24(9):941.
[7]翟福丽,黄轶群,王锡昌,等.应用表面增强拉曼光谱技术快速检测尿样中的β-兴奋剂[J].分析化学,2012,40(5):718-723.
[8]方怀防,曾昭睿.高效毛细管电泳在兴奋剂检测中的应用进展[J].分析化学,2005,33(6):881-886.
[9]中华人民共和国农业部.农业部2086号公告-3-2014饲料中匹莫林的测定 高效液相色谱法[S].北京:中国农业出版社,2014.
[10]金晓,周志华,何秀峰,等.尿液中利尿剂、丙磺舒、咖啡应、匹莫林的固相提取和HPLC初筛分析[J].药学学报,1992,27(11):857-880.
[11]安洪泽,张素霞,沈建忠,等.高效液相色谱-紫外串联荧光检测法测定猪饲料中五种β-兴奋剂[J].饲料工业,2008,29(6):54-56.
[12]申利.高效液相色谱-串联质谱法同时筛查人尿中40种世界反兴奋剂机构禁用药物[J].体育科学,2015,35(5):66-70.
[13]班付国,方忠意,刘素梅,等.超高效液相色谱-电喷雾串联质谱法对饲料中匹莫林的测定[J].分析测试学报,2009,28(6):705-708.
[14]刘学芝,赵英莲,马跃,等.超高效液相色谱-串联质谱法测定猪肉、鸡蛋、牛奶中9种食源性兴奋剂类药物残留[J].色谱,2022,37(2):148-155.
[15]邱丽君,郑小严,游飞明,等.气相色谱-氮磷检测方法同时检测尿样中的刺激剂、麻醉剂和抗雌激素类五种兴奋剂[J].色谱,2009,27(3):364-367.
[16]刘五一,张旭,方建军,等.气质法快速测定畜禽肉中4种β-兴奋剂的前处理新技术研究[J].检测分析,2016,37(6):154-157.
[17]景晶,王杉,刘欣,等.气相串接质谱联用法确证人尿中44种外源性蛋白同化类激素[J].中国运动医学杂志,2020,39(6):476-481.
[18]刘赟玺,董天宇,张玉峰,等.通过超高效液相色谱 -四极杆-靜电场轨道阱高分辨质谱联用仪对人尿中42种小肽类禁用物质进行兴奋剂检测[J].中国运动医学杂志,2021,40(8):638-647.
[19]刘欣,徐友宣,张亦农,等.GC/HRMS在兴奋剂检测中的应用研究[J].质谱学报,2001,22(3):66-70.
