肠炎沙门氏菌FliC单克隆抗体阻断ELISA检测方法的建立及初步应用
2022-07-05刘跃生赵海云崔国林禹海杰
王 俊,李 军,刘跃生,刘 锐,赵海云,费 枫,崔国林,贾 艳*,禹海杰*
(1.嘉兴职业技术学院,浙江 嘉兴 314036;2.河北工程大学,河北 邯郸 056038)
肠炎沙门氏菌(SalmonellaEnteritidis,SE)是一种重要的食源性病原菌,感染宿主范围广泛。禽类是SE重要的储存宿主[1]。近来,SE的流行病学调查研究结果表明,SE是引起鸡、鸭等禽类沙门氏菌病的主要血清型之一[2-3]。SE 感染成年禽类后主要定植于肠道,多呈隐性感染,持续向外排毒,污染禽肉及蛋产品[4]。国内因SE污染禽类食品导致的食物中毒事件也被多次报道[5-6]。因此禽SE的血清学诊断具有重要意义。
目前,SE 的血清学检测方法主要有ELISA 方法、试管凝集试验、玻片凝集试验等,其中ELISA 方法的敏感性高和特异性强。用于SE抗体检测的ELISA方法大多基于菌体表面多糖和蛋白等抗原,例如Xia 等利用沙门氏菌O9 抗原建立竞争ELISA 方法用于检测肠炎、鸡白痢等血清D 群沙门氏菌[7]。FliC 蛋白是SE 鞭毛的主要组分,其氨基酸序列划分为D0、D1、D2 和D3区域,D0和D1区域在沙门氏菌属内高度保守,D2和D3 区域为高变区,同时也是刺激机体产生体液免疫应答的主要区域[8]。Mirhosseini 等利用原核表达了FliC 蛋白,并以此建立的间接ELISA 方法能够检测BALB/c 小鼠血清抗体[9]。阻断ELISA 方法通过制备的特异性抗体与血清抗体竞争结合抗原位点,具有特异性强的优点。因此,本研究利用SE FliC蛋白高变区制备单克隆抗体(MAb),以此为基础建立抗体阻断ELISA方法(bELISA),为SE血清学调查提供技术手段。
1 材料与方法
1.1 主要实验材料和实验动物SE CICC10467 株购自中国工业微生物菌种保藏中心,其他菌株均保存于本实验室;大肠杆菌DH5α 感受态细胞购自北京全式金生物技术有限公司。6 周龄~8 周龄雌性BALB/c 小鼠购自维通利华实验动物技术有限公司(中国北京);1 日龄雏鸭和14 周龄北京鸭购自北京市某北京鸭养殖场。SE 阳性鸡血清由本实验室制备。
1.2 主要试剂PEG1500、HT/HAT 培养基、SBA Clonotyping System-HRP、弗氏完全佐剂(FCA)、弗氏不完全佐剂(FIA)购自美国Sigma 公司;Ni 和GST琼脂糖凝胶,HRP 标记山羊抗鸡IgG 购自北京康为世纪生物科技有限公司;rProtein A/G 琼脂糖凝胶购自北京索莱宝科技有限公司;其他化学试剂均购自国药集团;LB 和BPW 培养基购自北京陆桥技术股份有限公司;HRP 标记山羊抗小鼠IgG 购自北京中衫金桥生物科技有限公司;禽SE 抗体检测试剂盒(REF 99-08701)购自美国IDEXX 公司。
1.3 MAb 的制备
1.3.1 SE FliC蛋白原核表达、纯化和鉴定 参照Gen-Bank 中SE P125109 株(AM933172.1)、鼠伤寒沙门氏菌ATCC14028 株(MF948286.1)、鸭沙门氏菌M-3471株(NZ_CP045458.1)、阿培依姆沙门氏菌1897 株(MK905544.1)的FliC蛋白氨基酸序列,利用Megalign软件比对序列相似性。根据SE P125109 株fliC基因的高变区、pET-21b 和pGEX-2T 质粒设计两对引物(pET-21b:F1:GGGAATTCGAACGGGACTAACTCTG ATTCCG/R1: GGGCTCGAGCAGAATCTGCGCTTTAGAC A;pGEX-2T:F2:GCGGATCCAACGGGACTAACTC TGATTCCG/R2:GGGAATTCCCAGAATCTGCGCTTTAG ACA),分别扩增目的基因片段。PCR 产物经DNA 回收试剂盒回收纯化,双酶切后将其分别克隆于pET-21b 和pGEX-2T 载体,构建重组质粒pET21b-fliC和pGEX-2T-fliC,转化大肠杆菌DH5α 感受态细胞,构建重组菌pET21b-fliC/DH5α 和pGEX-2T-fliC/DH5α,PCR 筛选阳性菌株,经测序鉴定序列无误后,将重组大肠杆菌pET21b-fliC/DH5α 和pGEX-2T-fliC/DH5α分别37 ℃培养至OD600nm约为0.6 时,加入终浓度0.5 mmol/L IPTG 诱导4 h。收集菌体,超声破碎,4 ℃离心,取沉淀后分别以His 抗体和GST 抗体(1∶5 000)为一抗,HRP标记山羊抗小鼠IgG(1∶5 000)为二抗,进行western blot 分析。将重组His-FliC 蛋白和GST-FliC 经Ni 琼脂糖凝胶和GST 琼脂糖凝胶纯化, SDS-PAGE 分析纯化效果后进一步以SE 阳性鸡血清(1∶200)为一抗,HRP 标记山羊抗鸡IgG 为二抗(1∶5 000),通过western blot 鉴定重组蛋白的抗原性,并利用BCA 法测定蛋白浓度。
1.3.2 杂交瘤细胞株的制备 将经GST 琼脂糖凝胶纯化的GST-FliC 重组蛋白与等剂量FCA 乳化后免疫6~8 周龄雌性BALB/c 小鼠,三周后用纯化的GSTFliC 与等剂量FIA 乳化,进行第二次免疫,间隔三周后进行第三次免疫,方法和免疫剂量同第二次。第三次免疫后第7 d 经眼静脉丛采血,分离血清,以His-FliC 为包被抗原,待筛选杂交瘤细胞株上清原液为一抗,HRP 标记山羊抗小鼠IgG(1∶5 000)为二抗,通过间接ELISA 方法检测血清抗体效价。取三次免疫后血清抗体效价为1∶64 000 的小鼠脾脏,分离脾细胞并与SP2/0 细胞融合。采用上述间接ELISA方法筛选阳性杂交瘤细胞。
1.3.3 小鼠腹水MAb 的制备、纯化和鉴定 10 周龄雌性BALB/c小鼠腹腔注射0.5 mL灭菌液体石蜡,致敏14 d 后,每只腹腔注射约5×105个杂交瘤细胞,7 d~15 d 采集腹水,短暂离心去除脂肪等杂质,采用rProtein A/G 琼脂糖凝胶亲和层析法纯化腹水,利用SDS-PAGE 分析MAb 纯化效果。
利用SBA Clonotyping System-HRP 试剂盒对MAb的亚类鉴定。同时,分别将SE(H:g,m)、都柏林沙门氏菌(S.Dublin)(H:g,m)、鸡白痢沙门氏菌(S. Pullorum)(H:-)、鸡 伤 寒 沙 门 氏 菌(S. Gallinarium)(H:-)、鼠伤寒沙门氏菌(S. Typhimurium)(H:1,4,[5],12)、S. Rissen(H:f,g)、S. Senfternberg(H:g,[s],t)、S. Montevideo(H:g,m,s)菌株和大肠杆菌(E. coli)、铜绿假单胞杆菌(P. aeruginosa)、普通变形杆菌(P. vulgaris)、无乳链球菌(S. alactolyticus)、单核细胞增生李斯特氏菌(L. monocytogenes)、鸭疫里默氏杆菌(R. anatipestifer)的过夜培养物稀释至OD600nm约为1.0,取1 mL 菌液8 000 r/min 离心3 min 后,用100 μL 无菌去离子水重悬菌体,分别以筛选制备的MAb 为一抗(1∶5 000),HRP 标记山羊抗小鼠IgG(1∶5 000)为二抗,通过western blot 分析鉴定MAb。
1.4 MAb 阻 断ELISA 方 法 的 建立
1.4.1 MAb 阻断ELⅠSA 方法最佳反应条件的确定 以MAb 1D3 为阻断抗体建立bELISA 方法,操作过程:每孔加入100 μL 包被液稀释的His-FliC 重组蛋白,4 ℃过夜孵育后弃去抗原液,1×PBST 洗涤3次;每孔加入250 μL 封闭液,37 ℃封闭2 h 后弃去封闭液,洗涤同上;每孔加入100 μL 5%脱脂乳稀释的待检血清,2个阳性对照孔加入稀释的阳性血清,2个阴性孔加入封闭液,37 ℃孵育1 h 后弃去液体,洗涤同上;每孔加入100 μL 5%脱脂乳稀释的MAb,37 ℃孵育1 h后弃去液体,洗涤同上;每孔加入100 μL 5%脱脂乳稀释的HRP 标记山羊抗小鼠IgG(1∶5 000),37 ℃孵育1 h 后弃去液体,洗涤同上;每孔加入100 μL 混合均匀的TMB 底物溶液,室温避光反应15 min 后每孔加入50 μL 终止液;读取OD450nm值。阻断率(%)计算公式:(OD450nm空白对照-OD450nm待检血清)/(OD450nm空白对照)×100%。采用棋盘滴定法,分别对His-FliC 重组蛋白包被浓度(2 倍倍比稀释:1∶8 μg/mL~1∶0.5 μg/mL)、MAb 稀释度(2 倍倍比稀释:1∶1 000~1∶64 000)、包被条件(37 ℃2 h、37 ℃2 h+4 ℃12 h、4 ℃12 h)、封闭液类型(5%脱脂乳、5% BSA),待检血清(5 份SE 阳性鸭血清、5 份阳性鸡血清、5 份阴性鸭血清、5 份阴性鸡血清,分别作1∶5、1∶10、1∶20、1∶40、1∶80、1∶160、1∶320 稀释),以确定最佳反应条件。
1.4.2 阴阳性临界值的确定 采用建立的bELISA 方法检测239 份经凝集试验检测SE 抗体阴性的鸭血清样品。计算239 份阴性血清阻断率的平均值()和标准差(s),利用SPSS 25.0 对样品数据进行正态分布检验,生成Q-Q 正态分布图,以+3s作为阴阳性临界值。当样品的阻断率≥+3s时,判为阳性,当样品的阻断率<+2s时,则判为阴性,样品阻断率介于+3s和+2s之间判 为 可 疑。
1.5 特异性试验利用建立的bELISA 方法分别检测SE、鸡白痢沙门氏菌、鸡伤寒沙门氏菌、鼠伤寒沙门氏菌、阿培依姆沙门氏菌、大肠杆菌O78、阿尼蒂斯葡萄球菌、Ⅱ型鸭疫里默氏杆菌阳性血清,每份血清重复5 次,评估该方法的特异性。
1.6 敏感性试验使用5%脱脂乳将经western blot 确定为SE 阳性的鸭血清分别作1∶10、1∶20、1∶40、1∶80、1∶160、1∶320、1∶640 稀释,采用本研究建立的bELISA 方法与IDEEX 公司ELISA 试剂盒同时检测,评估本实验建立的bELISA 方法的敏感性。
1.7 重复性试验批内重复试验:选取同批次包被酶标板,利用建立的bELISA 方法检测5 份SE 阳性鸭血清,每份样品重复8 次,根据每份血清样品阻断率计算变异系数(CV)。批间重复试验:选择分8 批次包被的酶标板,检测5 份SE 阳性鸭血清,根据每份血清样品阻断率计算变异系数(CV)。
1.8 符合率检验将采集的北京地区5 个肉鸡场的105 份鸡血清和3 个鸭场的48 份鸭血清分别利用本实验建立的bELISA 方法和IDEXX 公司试剂盒检测。以试剂盒检测结果作为标准,分别计算该方法的敏感性(真阳性/(真阳性+假阳性))、特异性(真阴性/(真阴性+假阴性))及二者的符合率((真阳性+真阳性)/(真阳性+假阳性+真阴性+假阴性))。
1.9 bELISA 方法的初步应用北京鸭雏鸭感染实验:将25只SE抗体阴性的7日龄北京鸭雏鸭随机分成3 组,A 组:10 只雏鸭每只皮下注射0.5 mL(107cfu)SE;B 组:10 只雏鸭每只皮下注射0.5 mL(106cfu)SE;C 组:5 只皮下注射0.5 mL 无菌PBS,从感染后第2 d 开始,每2 d 采血,分离血清。感染死亡的雏鸭剖检观察并分离SE,同时采用OIE 推荐的微量试管凝集试验(MAT)[10]检测各组鸭血清抗体水平。
北京鸭成年鸭感染实验:将20 只14 周龄SE 抗体阴性的北京鸭随机分为2 组,A 组:15 只成年鸭每只皮下注射0.5 mL(109cfu)SE;B 组:5 只成年鸭每只皮下注射0.5 mL 无菌PBS。于感染后5 d、11 d、18 d 各组分别剖杀5 只观察组织病变,分离病原,并采血分离血清,分别采用bELISA 和MAT[10]检测抗体。
2 结 果
2.1 FliC 蛋白原核表达、纯化和鉴定结果根据4个沙门氏菌血清型FliC 蛋白氨基酸序列比对结果,截取肠炎沙门氏菌FliC 蛋白高变区(aa101~aa482)。PCR 扩增高变区基因片段,分别克隆至pET21b 和pGEX2T 载体,转化至大肠杆菌DH5α,经测序鉴定序列正确后进行IPTG 诱导,利用western blot 检测。结果显示分别在52 ku(His-FliC)和70 ku(GST-FliC)处出现特异性条带(图1A)。BCA 法测得蛋白浓度分别为0.6 mg/mL(His-FliC)和3.4 mg/mL(GST-FliC)。SDS-PAGE 分析纯化效果显示两个重组蛋白均在目的蛋白大小处出现条带,His-FliC的纯化效果较好,呈单一目的条带(图1B)。Western blot结果显示,两个重组蛋白均能够与SE阳性鸡血清发生特异性反应(图1C),具有良好的反应原性。根据以上结果,本研究将His-FliC 作为bELISA 方法中的包被抗原,GST-FliC作为免疫原免疫小鼠,制备MAb。

图1 重组蛋白原核表达(A)、纯化(B)和鉴定(C)Fig.1 Prokaryotic expression(A),purification(B)and identification(C)of the fusion proteins
2.2 MAb 的制备及鉴定结果选取血清抗体效价为1∶64 000 小鼠制备脾细胞,利用PEG1500 进行细胞融合,间接ELISA 方法筛选阳性杂交瘤细胞。经过3次克隆纯化筛选获得1 株杂交瘤细胞命名为1D3,MAb 亚类为IgG1,轻链为κ 链。rProtein A/G 亲和层析纯化小鼠腹水,轻链和重链条带较单一,表明纯化效果较好(图2A)。Western blot 结果显示MAb 1D3可特异性识别g,m型沙门氏菌鞭毛,但不与鼠伤寒、鸡白痢、鸡伤寒、阿培依姆等沙门氏菌血清型和大肠杆菌、巴氏杆菌、鸭疫里默氏杆菌、肠球菌、单增李斯特氏菌等发生反应(图2B),表明MAb 1D3特异性强。

图2 MAb纯化的SDS-PAGE(A)和western blot鉴定(B)Fig.2 SDS-PAGE purification(A)and western blot identification(B)of MAb
2.3 bELISA 方法的建立
2.3.1 bELⅠSA 方法最佳反应条件的优化结果 通过棋盘法优化结果见表1。待检血清稀释度优化结果显示,血清稀释度为1∶10时阻断率在60%以上,稀释度为1∶20时阻断率在40%以上(图3),因此选取1∶10作为待检血清的稀释度[11]。

表1 阻断ELISA反应条件优化结果Table 1 Optimization of working condition of blocking ELISA
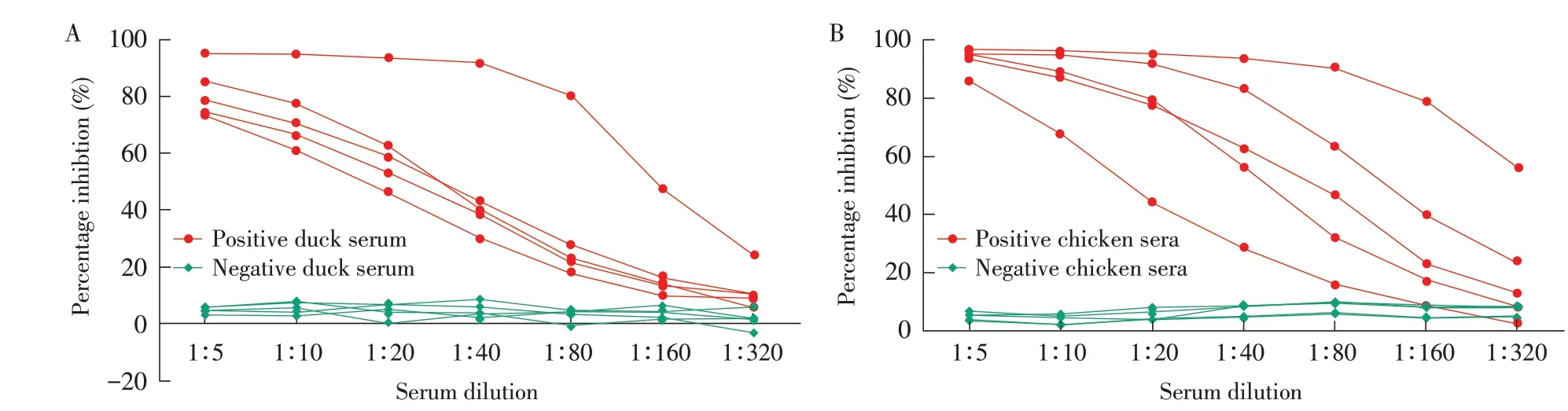
图3 待检鸭(A)和鸡(B)血清稀释度的优化Fig.3 Optimization of test duck(A)and chicken(B)sera dilution
2.3.2 阴阳性临界值的确定 将239 份SE FliC 蛋白抗体阴性鸭血清样品10 倍倍比稀释后,采用建立的bELISA 方法检测,统计计算该方法的阻断率。通过单样本Kolmogorov-Smirnov 检验,得P=0.2>0.05,表明样品数据服从正态分布(图4),因此用该数据代表阴性血清样品具有统计学意义。计算得到239 份样品阻断率的平均值为7.70%,标准差为0.0788,因此建立的bELISA 方法的阴阳性临界值为7.70%+3×0.07587=30.46%,即样品阻断率大于等于30.46%判为阳性,阻断率小于等于7.70%+2×0.07587=22.87%的样品判为阴性,阻断率介于30.46%和22.87%之间的血清样品判为可疑进行再次检测,若仍小于30.46%则判为阴性。
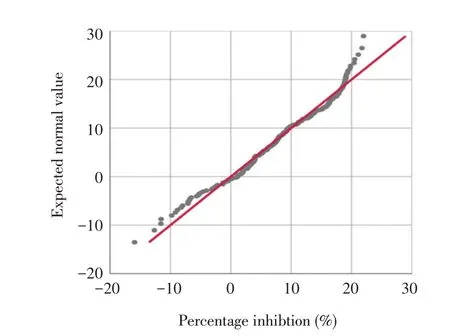
图4 阴性血清样本正态分布分析Fig.4 The normal distribution analysis of negative serum samples
2.4 特异性试验结果采用该bELISA 方法检测大肠杆菌、鸭疫里默氏杆菌等非沙门氏菌阳性血清和鼠伤寒、鸡白痢等沙门氏菌血清型阳性血清,结果显示除SE阳性血清外,其他病原阳性血清检测均为阴性,无交叉反应(图5)。表明本研究建立的bELISA特异性较强。
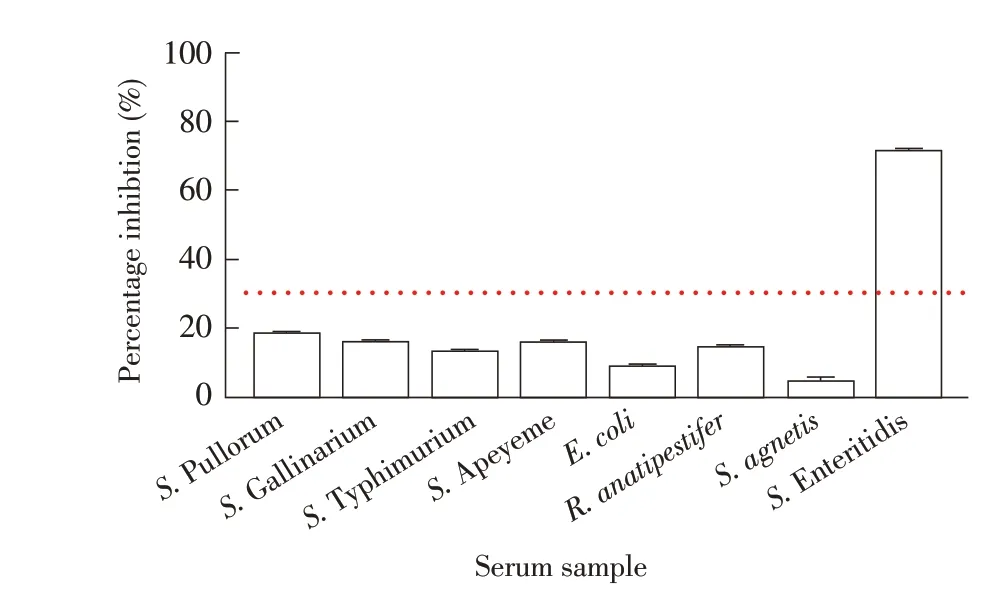
图5 特异性试验结果Fig.5 Specificity test of the bELISA method
2.5 敏感性试验结果将阳性血清倍比稀释后采用建立的bELISA 方法和IDEXX 试剂盒方法同时检测,结果显示二者检测阳性血清最大稀释倍数均为1∶320(图6)。表明本研究建立的bELISA 方法敏感性较高。

图6 敏感性试验结果Fig.6 Sensitivity analysis of the bELISA method
2.6 重复性试验结果批内重复性检测结果经统计学分析得出变异系数为0.66%~1.81%,批间重复性检测结果经统计学分析得出变异系数为1.06%~6.25%,均小于10%(表2),表明该bELISA 方法重复性良好。
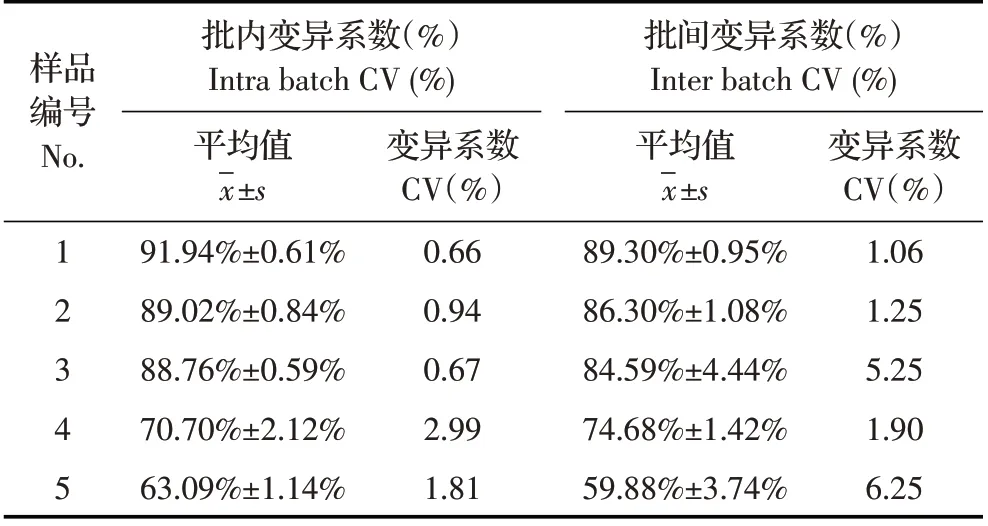
表2 bELISA重复性试验(n=8)Table 2 The repeatability test of the bELISA(n=8)
2.7 符合率检验结果利用建立的bELISA 方法检测105 份鸡血清,结果显示35 份血清阳性,70 份阴性;检测48 份鸭血清,结果显示17 份血清阳性,31份阴性。IDEXX 试剂盒检测105 份鸡血清,结果显示38 份血清阳性,67 份血清阴性,48 份鸭血清包括18 份阳性和30 份阴性。根据以上结果计算bELISA方法的特异性为98.97%、敏感性91.07%,两种方法符合率为96.30%(表3)。表明该bELISA 方法具有较高的特异性和敏感性,可用于临床检测。
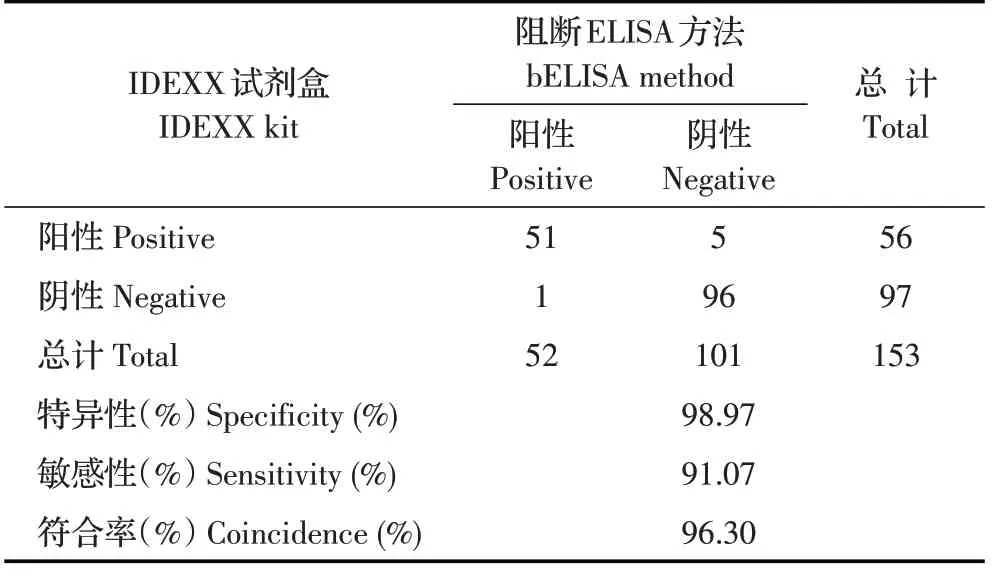
表3 bELISA和IDEXX试剂盒方法比较Table 3 Comparative result of the bELISA and IDEXX kit
2.8 人工感染北京鸭血清抗体检测7日龄北京鸭分别皮下注射感染SE 107cfu/只和106cfu/只,观察临床症状并检测血清抗体,结果显示,107cfu/只感染SE后7 d内死亡7只,4 d时1只出现抗体反应,8 d时3只均产生抗体,2周左右平均抗体滴度达到峰值(图7A);106cfu/只感染SE 北京雏鸭5 d 死亡1 只,6 d 时3 只出现抗体反应,2周左右平均抗体滴度达到峰值(图7B),共4 只鸭子产生抗体反应。107cfu/只感染鸭子产生的抗体水平(1∶160)高于106cfu/只(1∶20)。MAT 检测各组鸭血清抗体动态变化,呈现与bELISA相同的变化趋势。死亡鸭子剖检观察肝脏和脾脏肿大,肝脏细菌培养均分离获得SE。

图7 107 cfu/只(A)和106 cfu/只(B)SE感染后北京雏鸭血清抗体动态变化Fig.7 Antibody dynamic changes of Peking ducklings after 107 cfu(A)and 106 cfu(B)Salmonella Enteritidis infection
成年鸭感染实验结果显示,109cfu/只皮下注射5 d后能够检测到抗体反应,平均抗体滴度约为1∶20;感染后11 d bELISA 和MAT 测定平均抗体滴度均达到峰值,约为1∶120;感染后18 d平均抗体滴度下降至1∶60(图8A)。感染后5 d 剖检可见肝脏出现坏死点(2/5)(图8B),肝脏组织病原分离结果显示5只均携带SE。

图8 SE感染后北京鸭血清抗体动态变化(A)和病理变化(B)Fig.8 Antibody dynamic changes(A)and liver pathology(B)of Peking ducks after 109 cfu Salmonella Enteritidis infection
上述结果表明本研究建立的bELISA 方法可用于临床SE 检测及抗体分析。
3 讨 论
SE和鸡白痢沙门氏菌携带相同的菌体抗原,传统的玻片凝集试验无法区分两种血清型的阳性血清。本研究基于SE FliC蛋白制备MAb,建立SE bELISA方法用于检测禽类血清抗体,该检测方法适用于鸡和鸭等禽类血清样品检测,且具有较强的特异性。
为避免检测方法出现交叉反应,本研究截取SE FliC 蛋白的高变区。进一步分析SE 血清型菌株之间的序列相似性,根据GenBank 中1949 年至2020 年共25株SEfliC基因序列比对结果显示FliC蛋白氨基酸序列完全一致,表明SEfliC基因高度保守。因此本研究分别原核表达带有不同标签的融合蛋白His-FliC 和GST-FliC,用于小鼠免疫和筛选,以排除亚克隆筛选时出现针对标签蛋白的假阳性杂交瘤细胞株。
SE 能够感染多种禽类,同时也是感染鸭子的优势血清型之一[12]。目前除用于鸡SE 血清抗体的间接ELISA 外,市场上还没有针对鸭血清抗体检测的方法,基于MAb 的bELISA 方法相对于间接ELISA 方法稳定性好、特异性更强、检测范围更广。本研究建立的bELISA 方法能够同时用于鸡和鸭血清的SE 抗体检测,扩大了血清学调查范围,为临床SE 感染的防控提供技术手段。目前尚无用于沙门氏菌血清抗体检测的标准方法,为了评估本研究建立的bELISA方法,选取IDEXX 公司检测试剂盒作为参照,分别检测来自养殖场的105 份鸡血清和48 份鸭血清,结果显示其具有较高的特异性和敏感性,证明该方法可用于鸡和鸭血清SE 抗体检测。检测鸡血清得出总的SE 血清抗体阳性率约为33.33%,每个鸡场的平均阳性率约为27%,由于检测血清均为玻片凝集初筛阳性血清,因此阳性率较高,但是可以反映这5 个鸡场存在SE 感染,此结果也符合这些鸡场SE 的病原分离结果[3]。
为了进一步分析bELISA 方法的可行性,本研究采用107cfu/只和106cfu/只两个剂量的SE 感染北京鸭雏鸭,感染后两个剂量均能够引起雏鸭部分死亡,并且感染鸭肝脏可再次分离到SE。利用本实验建立的bELISA方法进行血清抗体检测,结果显示106cfu/只感染剂量仅引起部分(4/9)雏鸭产生抗体反应。研究表明SE 感染能够导致脾脏B 细胞数量下降,从而抑制抗体产生[13]。Zhang 等通过SE 口服感染12 周龄绍兴鸭,当感染剂量达到1011cfu/只才能产生抗体应答反应,且感染剂量达到1011cfu/只时仍有71.8%的鸭子器官无病变,且组织分离不到SE,表明绍兴鸭对SE具有一定抗性[14]。结合本研究检测结果推测北京鸭个体差异导致了抗体反应的参差不齐。
综上,本研究首次建立的SE bELISA 方法具有特异性强、重复性好、敏感性高的特点,能够用于禽SE 感染的血清学调查及抗体检测,为SE 感染监测提供快速有效的手段。
