低温好氧反硝化菌的选育以及脱氮性能
2022-07-05姚甜甜董红红周小峰
姚甜甜, 董红红, 周小峰
(深圳市长隆科技有限公司 迈葳生物事业部,广州 深圳 518116)
总氮是污水排放的一个重要指标,如何去除污水中的总氮使出水总氮达标是目前亟待解决的主要问题.传统的生物脱氮技术去除水体中氨氮的原理是在好氧条件下把氨氮转化成硝酸盐氮即硝化作用,在厌氧或缺氧条件下把硝酸盐氮最终转化成氮气即反硝化作用.由于传统的硝化菌和反硝化菌的生长条件不同,使得硝化和反硝化作用不能在同一个反应器中进行[1-3].这不仅增加了基建投资费用,还增加了运行成本.好氧反硝化菌的发现使硝化和反硝化作用同时进行成为了可能,解决了传统生物脱氮好氧和厌氧严格分离的问题,进一步简化了工艺和操作[4].1984年Robertson等[5]从除硫系统的出水中第一次分离出好氧反硝化菌,好氧反硝化现象由此被揭开.随着对好氧反硝化菌的进一步研究,目前已经有20多个属的好氧反硝化菌株被分离出来[6].
在中国北方,冬季水温通常低于10 ℃.低温会抑制酶的活性,减缓微生物的生长,导致反硝化作用明显减弱[7].因此,在冬季时温度会成为污水生化处理系统的脱氮效果的限制因素.近年来,由于在强碱、强酸、低温等极端条件下异养反硝化菌不具有良好的适应能力和脱氮效果而倍受关注[8-9].因此,筛选耐低温好氧反硝化菌株是提高低温条件下生物脱氮效率的根本途径.
本文中,笔者通过定向驯化从某污水处理厂的活性污泥,从中筛选出耐低温好氧反硝化菌IL-2,对菌株进行基本的生理生化和部分长度16S rDNA鉴定,考察了不同因素对IL-2菌反硝化效率的影响.
1 材料与方法
1.1 样品来源
所用污泥来自某污水处理厂CASS处理工艺反应池出口活性污泥.
1.2 培养基
牛肉膏蛋白胨培养基:牛肉膏3 g/L,蛋白胨10 g/L,氯化钠5 g/L,pH优选为7.2~7.6.
LB营养培养基:酵母粉5.0 g/L,氯化钠10.0 g/L,蛋白胨10.0 g/L,琼脂20.0 g/L,pH为7.2~7.6.
无机盐培养基:乙酸钠2 g/L,硝酸钾1.0 g/L,磷酸二氢钾1.0 g/L,七水合硫酸亚铁0.05 g/L,氯化钙1 g/L,七水合硫酸镁1.0 g/L,pH为7.2~7.6.
1.3 菌株富集驯化
将10 g的活性污泥接种至150 mg/L硝态氮和装有100 mL无机盐培养基的锥形瓶中,在溶解氧约为3.0 mg/L、温度20 ℃的恒温摇床上培养3 d,得到第1菌液;吸取10 mL第1菌液转接至150 mg/L硝态氮、装有100 mL无机盐培养基的锥形瓶中,在溶解氧约为3.0 mg/L,16 ℃的恒温摇床上培养3 d,得到第2菌液;以此类推,3 d一轮,每一轮温度降低4 ℃直至温度降低到4 ℃,该过程是对菌的低温驯化.驯化过程中通过调节曝气泵控制溶解氧的浓度,通过设置恒温摇床的温度控制温度.
1.4 菌株的纯化分离
吸取2 mL驯化后的最终菌液,采用涂布平板法用LB固体培养基进行分离,在4 ℃的恒温培养箱中培养,获得单菌落;挑选单菌落用平板划线法把不同形态的菌接种至不同的LB固体平板培养基上,对单菌落进行3次划线培养,对其进行纯化.
1.5 菌株的鉴定
根据《伯杰氏细菌手册》对筛选出的IL-2菌的表观形貌进行观察,并对其进行革兰氏染色,染色之后用油镜对该菌株进行微观形态的观察.取多次纯化后菌液,用试剂盒提取其基因组DNA,之后进行PCR扩增、凝胶电泳,将PCR产物纯化后对其直接测序,之后通过美国国家生物技术信息中心NCBI数据库将该菌株的16S rDNA序列与其他菌株进行对比,选择其他菌株的同源基因构建系统发育树.
1.6 不同因素对菌株脱氮效果的影响
为考察不同C/N质量浓度比对该菌株脱氮效果的影响,将该菌株接种到不同C/N质量浓度比的某市政污水中,在4 ℃下培养10 h,测定初始和结束时污水中的硝态氮、亚硝态氮及COD浓度.为考察不同温度对该菌株脱氮效果的影响,将该菌株接种到污水中,不同温度下培养10 h,测定初始和结束时污水中的硝态氮、亚硝态氮及COD浓度.为考察溶解氧大小对该菌株脱氮效果的影响,把该菌株接种到污水中,不同浓度的溶解氧条件下培养10 h,测定初始和结束时污水中的硝态氮、亚硝态氮及COD浓度;为考察不同接种量对该菌株脱氮效果的影响,把不同量的该菌株接种到污水中,在4 ℃下培养10 h,测定初始和结束时污水中的硝态氮、亚硝态氮及COD浓度;为考察不同处理时间对该菌株脱氮效果的影响,把该菌株接种到污水中,在4 ℃下培养不同的时间,测定初始和结束时污水中的硝态氮、亚硝态氮及COD浓度.
1.7 测定方法
硝酸盐氮测定方法采用盐酸紫外分光光度法.
2 结果与讨论
2.1 菌株的筛选与鉴定
从某污水处理厂CASS处理工艺反应池出口活性污泥中筛选出3株菌,其中在4 ℃下对硝态氮的去除率在90 %以上的只有1株IL-2菌,在固体培养基上进行多次划线分离,挑选生长形态特征较好的单菌落进行观察和革兰氏染色,菌落形态如图1所示.该菌菌落偏大、呈黄色,近圆形且边缘较整齐.通过革兰氏染色,该菌为革兰氏阴性菌.通过油镜观察,该菌是长杆菌.对该株菌进行16S rDNA测序并在NCBI上把该菌株的测序结果与其他菌株同源基因序列进行比较,构建菌株IL-2系统发育树,见图2,菌株IL-2与假单胞菌属(Pseudomonassp.)聚为一支,初步断定该菌株为假单胞菌属的菌株.
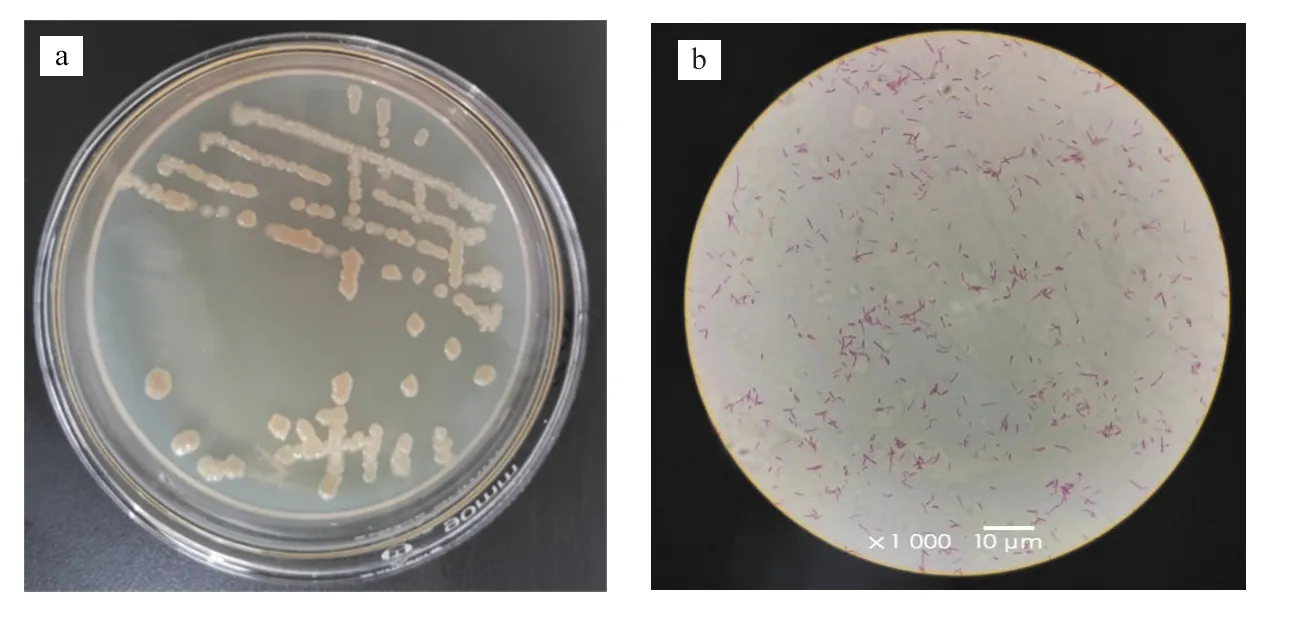
a.在平板培养基上的菌落形态; b.革兰氏染色后在油镜下的菌落形态.图1 菌株IL-2的形态特征Fig.1 The Morphological Characteristics of Strain IL-2
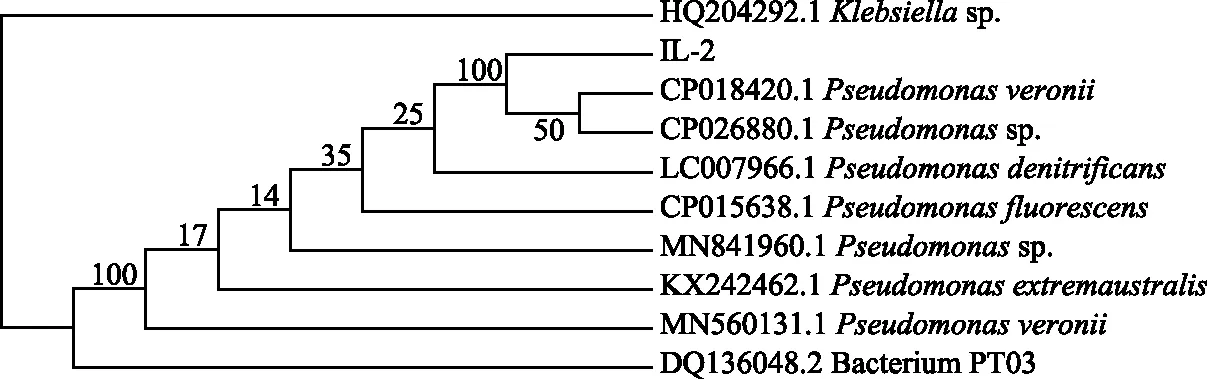
图2 菌株IL-2及部分假单胞菌属菌株NJ系统发育树Fig.2 Phylogenetic NJ Tree of Strain IL-2 and Some Pseudomonas Strains
2.2 C/N质量浓度比的影响
碳源是影响硝化过程的重要因素,反硝化菌多为异养型细菌,异养反硝化细菌可以以有机物为碳源,硝态氮为能源进行反硝化作用,其生化过程为
5CH3COOH+8NO3-—→6H2O+10CO2↑+4N2↑+8OH-+能量.
碳源浓度影响反硝化作用进程.适宜的C/N质量浓度比对细菌的生长可以起到促进作用,并在细菌的硝化和反硝化过程中提供能量.在该实验中,以乙酸钠作为碳源,向污水中加入不同量的乙酸钠以考察不同C/N质量浓度比对菌株IL-2硝态氮去除效果的影响.由图3可以看出,C/N质量浓度比越高,硝态氮质量浓度越低,硝态氮去除率越高.C/N质量浓度比为2,4,6,8时,碳源相对不足,硝态氮浓度相对较高,硝态氮无法完全脱除.C/N质量浓度比为10时,碳源质量浓度适宜,此时硝态氮脱除效率达到97.94 %,碳氮质量浓度比为12,14时,碳源较过量,成本较高.
2.3 温度的影响
温度的变化对大多数微生物来说影响比较大,温度过高会使微生物体内的蛋白质和酶变形甚至失活,温度过低,微生物体内的酶会受到抑制进而影响酶的活性[10].一般情况下,在一定温度内,随着温度的升高微生物的生长速率加快.实验结果见图4.可以看出,随着温度的升高,硝态氮的去除率先升高后降低,8 ℃时硝态氮去除率最高,为97.59 %.温度升高到8 ℃以上时硝态氮去除效率降低,原因可能是反应体系中酶的活性随着温度的升高受到了抑制,因此影响了反硝化速率.说明该菌株属于耐冷菌,在较低温度下显示出良好的硝态氮去除效果.
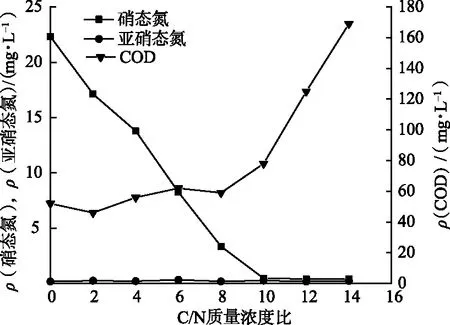
图3 低温下C/N质量浓度比对菌株IL-2去除硝态氮的影响Fig.3 The Effect of Mass Concentration Ratio of C/N on the Removal of Nitrate Nitrogen by Strain IL-2 at Low Temperature
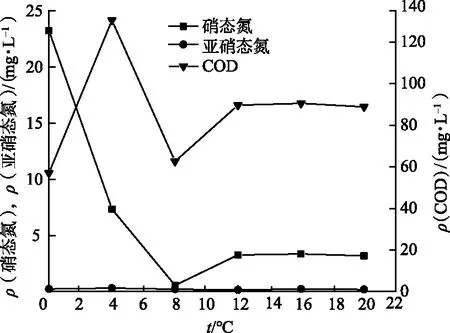
图4 温度对菌株IL-2去除硝态氮的影响Fig.4 The Effect of Temperature on the Removal of Nitrate Nitrogen by Strain IL-2
2.4 溶解氧的影响
在菌种的培养过程中,通过曝气泵调节溶解氧质量浓度.20世纪80年代之前,一直认为反硝化只发生在严格的缺氧环境中,在有氧的条件下参与反硝化的酶会受到抑制.Robertson等[5]发现好氧反硝化菌之后,这一传统的观点被打破,在好氧条件下也能进行反硝化,氧气作为微生物的终端电子受体.本研究筛选的IL-2菌是好氧反硝化菌,在好氧反硝化过程中,溶解氧(DO)是好氧脱氮的关键参数.从图5可以看出,当ρ(DO)=1,2,3 mg/L,时,随着ρ(DO)的增加,硝态氮脱除效率升高;当ρ(DO)=3 mg/L时,IL-2菌脱氮效率最高,为98.18 %,此时ρ(硝态氮)=0.40 mg/L;继续增加转速,硝态氮去除率略微下降,为97.13 %.
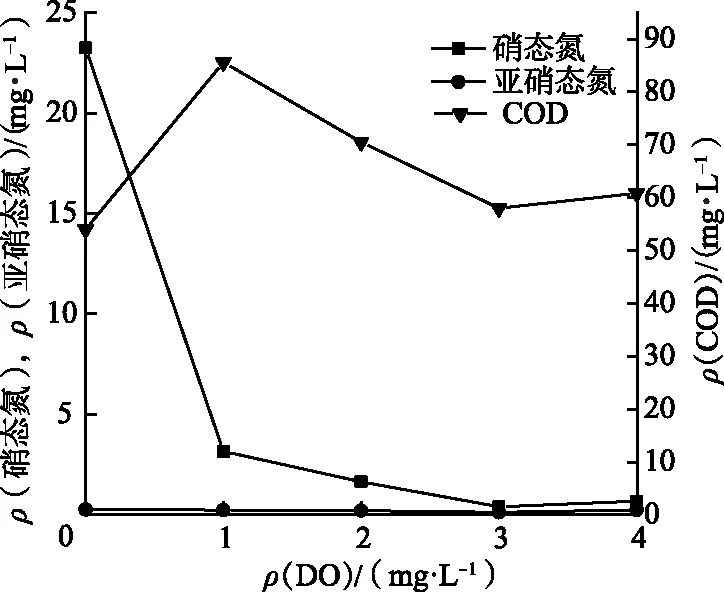
图5 溶解氧对菌株IL-2去除硝态氮的影响Fig.5 The Effect of DO on the Removal of Nitrate Nitrogen by Strain IL-2

图6 接种量对菌株IL-2去除硝态氮的影响Fig.6 The Effect of Inoculum on the Removal of Nitrate Nitrogen by Strain IL-2
2.5 接种量的影响
在低温条件下微生物生长繁殖的速率较慢,因此,菌种的初始投加量对污水的反硝化效率影响较大.分别取5,10,20,30,40 mL的IL-2菌液,于3 000 r/min离心10 min,弃上清,把菌体分别接种到污水中,之后放入4 ℃,180 r/min的恒温摇床中培养10 h.实验结果见图6,可以看出,当菌株添加5 %~30 %体积分数时,菌株投加量越大,硝态氮脱除效率越高;当菌株添加为30 %时,IL-2菌株脱氮效率最高为96.26 %,此时ρ(硝态氮)=0.85 mg/L;继续增加菌株为40 %,硝态氮去除率不再升高反而降低,为91.34 %.在低温条件下,向污水体系中投加的菌种量不能太低,否则污水中的微生物数量不足反硝化效率不高;通过增加菌种的投加量可以提高反硝化速率,但菌种的投加量也不能太高,因为污水中的营养物质有限.菌种投加量过高水中营养物质不足会造成部分微生物死亡,死亡的微生物会向水中释放氮素从而造成水中氮含量升高.
2.6 处理时间的影响
时间也是影响反硝化能力的一个因素,时间过短,反硝化进行得不充分;时间过长,反硝化完全进行.从图7可以看出,随着处理时间的增加,硝态氮去除率有增加的趋势.其中,处理14 h时,IL-2菌脱氮效率最高,为97.84 %.
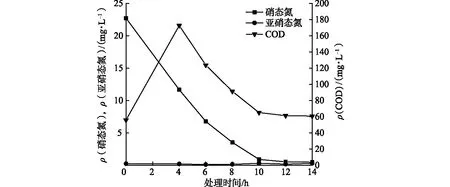
图7 接种量对菌株IL-2去除硝态氮的影响Fig.7 The Effect of Inoculum Amount on the Removal of Nitrate Nitrogen by Strain IL-2
3 结果与讨论
1) 从某污水处理厂CASS处理工艺反应池出口活性污泥中筛选出一株低温异氧反硝化菌IL-2,经16S rDNA基因序列同源性分析,其与罗氏假单胞菌匹配指数最高.经革兰氏染色,该菌株是革兰氏阴性菌.
2) 反硝化菌是异样菌,需要外加碳源,碳源的数量影响反硝化效率.由实验结果可知,在一定的C/N质量浓度比范围内,随着C/N质量浓度比升高,硝态氮质量浓度越低,硝态氮去除率越大.C/N质量浓度比为10时,硝态氮脱除效率最高,为97.94 %.碳氮质量浓度比小于10时,碳源不足,影响反硝化速率;当C/N质量浓度比大于10时,碳源充足,反硝化速率不受碳源数量的影响.
3) 温度会影响微生物体内酶的活性,随着温度的升高,硝态氮的去除率先升高后降低,8 ℃时硝态氮去除率最高,为97.59 %.由此可知,该菌是嗜冷菌,温度高于8 ℃时酶活性会受到影响.
4) 反硝化反应一般是在缺氧条件下发生,本文中反硝化反应可以在好氧条件下进行,随着溶解氧的增加,硝态氮脱除效率先升高再趋于稳定;当DO质量浓度为3.0 mg/L时,IL-2菌脱氮效率最高,为98.18 %.
5) 菌种接种量影响反硝化速率,随着好氧反硝化细菌IL-2接种量的提高,反硝化速率先增强后减弱;当接种量为30 %时,反硝化效率最高,为96.26 %.当接种量小于30 %时,菌种的多少限制反硝化速率;当接种量大于30 %时,菌浓足够,反硝化速率不变.
6) 随着处理时间的增加硝态氮去除率先增加后稳定,处理14 h时脱氮效率最高,为97.84 %.
传统的观点认为只有在缺氧或者厌氧的条件下反硝化作用才会发生,好氧反硝化菌的发现打破了这一观点,并为同步硝化反硝化工艺的实现奠定了基础,好氧反硝化菌的富集是实现同步硝化反硝化工艺的关键.筛选出的低温好氧反硝化菌主要应用于冬季温度比较低的污水处理系统,主要作用是进行反硝化把硝态氮先转化为亚硝态氮,再转化成氮气,从而从水体中脱除,减少二次污染.
