基于二氨基马来腈快速识别ClO-的荧光探针及应用
2022-07-05唐宏伟汤立军边延江
王 超, 唐宏伟, 汤立军, 边延江
(渤海大学 化学与材料工程学院,功能有机分子实验室,辽宁 锦州 121013)
在日常生活中,次氯酸(HClO)常用于家用漂白剂、饮用水消毒剂等[1-3].作为重要的活性氧(ROS)物种之一,HClO在许多病理和生物过程中起着重要作用[4].在生理环境中,正常浓度的HClO或次氯酸根(ClO-)可作为免疫系统的抗菌剂[5],但是过量的HClO/ClO-会引起许多疾病,如关节炎、肾脏疾病、肺损伤、心血管疾病、哮喘甚至癌症等[6-8].因此,生物细胞内HClO/ClO-的识别和含量测定对于医疗诊断等具有重要意义.
目前,电化学分析法、化学发光法和荧光分析法已被成功应用于次氯酸的检测,其中基于荧光探针的荧光分析法因其具有操作简便、响应迅速、选择性和灵敏度高、原位分析和活细胞成像等特点而受到广泛关注[9-12].已经开发的用于检测ClO-的荧光探针响应机制多是利用特定的官能团与HClO发生反应[13-15],这些探针在选择性和灵敏度方面均表现出优异的特性,但存在合成过程复杂或pH适用范围受限的问题.本文中,笔者选择二氨基马来腈作为反应官能团对ClO-进行识别[16-17],该探针合成简单,且对ClO-表现出较灵敏的识别效果和较快的反应速度,水溶性较好,pH适用范围较宽(6~10),在水样中的ClO-检测方面有较好的应用效果.
1 实验部分
1.1 仪器与试剂
400 MHz核磁共振仪(美国Agilent 公司);F-4700荧光分光光度计(日本株式会社日立高新技术科学那珂事业所);PHS-25型pH计(上海仪电科学仪器有限公司).
对羟基苯甲醛、碘甲烷、4-甲基吡啶、六次甲基四胺(HMTA)、二氨基马来腈、三氟乙酸、无水乙醇、N,N-二甲基甲酰胺(DMF)、二甲基亚砜(DMSO)、各种阴离子化合物和活性物质,所用药品和试剂均为市售分析纯,无需进一步纯化.各种阴离子化合物和活性物质均用二次蒸馏水配置.
探针L标准溶液的配置:称取4.57 mg探针L用DMSO溶解后转移至10 mL容量瓶中,定容至刻度线并摇匀,得到1 mmol/L的探针L标准溶液;再用移液器吸取1 mL标准溶液至100 mL容量瓶中,用V(DMF)∶V(H2O)=3∶7的溶液定容至刻度线并摇匀,得到10 μmol/L的探针L标准溶液.
1.2 探针L的合成
探针L的合成路线如图1所示.首先,利用对羟基苯甲醛和1,4-二甲基吡啶碘化物反应得到化合物1,化合物1再经由Duff反应得到化合物2,最后,化合物2与二氨基马来腈反应得到目标探针L.
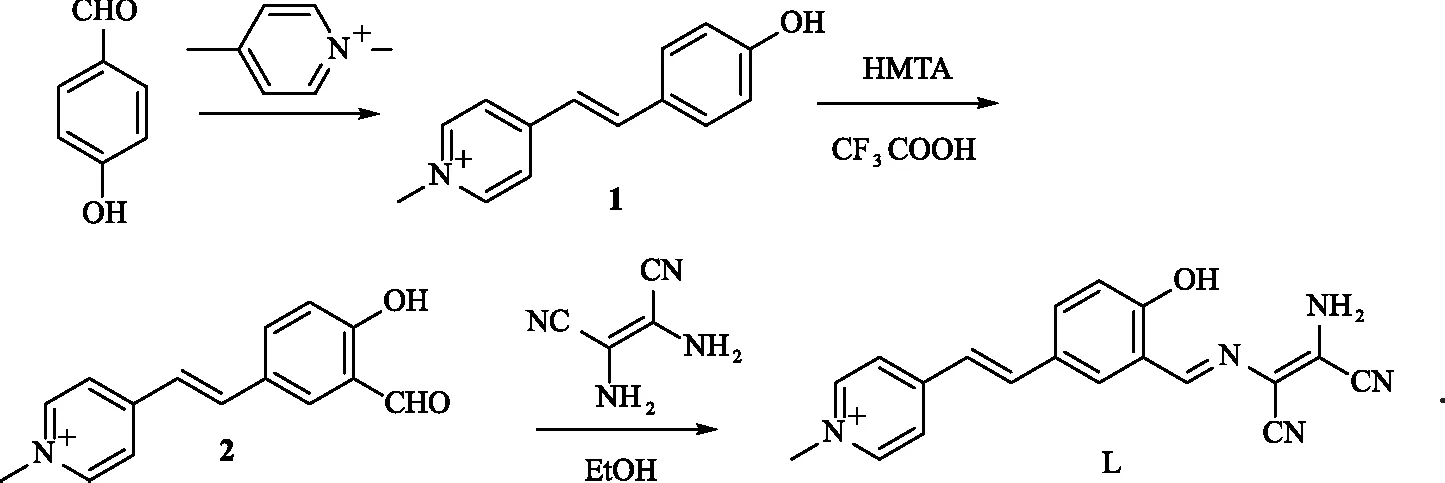
图1 探针L的合成路线Fig.1 Synthetic Route of Probe L
1.2.1 化合物1的合成及表征
将1.22 g对羟基苯甲醛(10 mmol)和2.35 g 1,4-二甲基吡啶碘化物(10 mmol)溶于40 mL无水乙醇中,加入2滴哌啶后回流16 h,反应结束后过滤粗产物,用冰乙醇洗涤3次,得到红色固体(化合物1)2.88 g(8.5 mmol),产率为85 %.1HNMR(400 MHz,DMSO-d6)δ:8.67(s,2H),8.03(s,2H),7.87(d,J=13.9 Hz,1H),7.53(d,J=5.5 Hz,2H),7.14(d,J=14.0 Hz,1H),6.74(d,J=5.3 Hz,2H),4.15(s,3H).13CNMR(101 MHz,DMSO-d6)δ:163.09,153.14,144.43,141.66,130.57,124.48,122.28,117.99,116.79,46.36.
1.2.2 化合物2的合成及表征
将680 mg化合物1(2 mmol)和450 mg六次甲基四胺(3.2 mmol)溶于15 mL三氟乙酸中,TLC薄层板跟踪反应,加热至反应完全,待反应物冷却至室温后,加入25 mL 1 mol/L的HCl溶液,搅拌至有沉淀物析出,过滤后得到405 mg黄色粉末状化合物2(1.1 mmol),产率为55 %[18].1HNMR(400 MHz,DMSO-d6)δ:11.43(s,1H),10.34(s,1H),8.83(d,J=6.4 Hz,2H),8.17(d,J=6.5 Hz,2H),8.03(d,J=16.4 Hz,1H),8.01(d,J=6 Hz,1H),7.92(d,J=8.7 Hz,1H),7.40(d,J=16.4 Hz,1H),7.15(d,J=8.6 Hz,1H),4.23(s,3H).13CNMR(101 MHz,DMSO-d6)δ:190.73,162.73,153.02,145.42,140.59,135.73,129.19,127.27,123.61,123.15,121.89,118.72,47.15.HRMS(ESI+):m/zCalcd.for C15H14NO2[M-I]+240.101 9,found:240.101 8.
1.2.3 探针L的合成及表征
向装有搅拌子的50 mL圆底烧瓶中加入367 mg化合物2(1 mmol)和108 mg二氨基马来腈(1 mmol),再加入7 mL无水乙醇回流4 h,待反应物冷却至室温后,过滤,用冰乙醇洗涤3次,干燥后得到320 mg黄色固体粉末(探针L)(0.7 mmol),产率为70 %.1HNMR(400 MHz,DMSO-d6)δ:11.15(s,1H),8.82(d,J=6.6 Hz,2H),8.58(s,1H),8.54(s,1H),8.14(d,J=6.6 Hz,2H),8.06(s,2H),7.91(d,J=16.3 Hz,1H),7.68(d,J=6.8 Hz,1H),7.48(d,J=16.3 Hz,1H),7.08(d,J=8.5 Hz,1H),4.24(s,3H).13CNMR(101 MHz,DMSO-d6)δ:160.00,152.73,151.09,145.09,140.26,133.70,128.04,126.84,126.54,123.01,122.02,121.17,117.18,114.48,113.91,103.23,46.83.HRMS(ESI+):m/zCalcd.for C19H16N5O[M-I]+330.134 9,found:330.135 4.
1.3 探针L对ClO-的光谱测试
荧光光谱的选择、滴定、竞争、pH、时间扫描和应用测试均吸取2 mL探针L标准溶液(10 μmol/L),向其中加入所需浓度的其他阴离子化合物或活性物质后进行荧光光谱测试.其中,pH响应实验是吸取2 mL用酸度计分别调配好的不同pH的探针L溶液.用于光谱测试的激发波长均为455 nm.
1.4 探针L检测实际水样品中的ClO-
用V(DMF)∶V(水样品)=3∶7的溶液配制10 μmol/L的测试液,并加入0~650 μmol/L的ClO-,通过监测探针L在585 nm处的荧光强度变化,得到荧光强度与加标浓度之间的关系.
2 结果与讨论
2.1 探针L对ClO-的选择性测试
在V(DMF)∶V(H2O)=3∶7,pH=6.71的混合溶液中测试探针L(10 μmol/L)对各种阴离子,ROS,活性氮(RNS)的响应情况,分别加入65倍的阴离子,ROS/RNS(ClO-,SCN-,S2O32-,N3-,AcO-,NO2-,I-,HSO3-,C2O42-,SO42-,CN-,Br-,Cl-,F-,H2O2,ONOO-,NO·,ROO·,·OH,1O2)后其荧光光谱如图2所示.可以看出,探针L在630 nm处几乎没有荧光发射,加入ClO-后荧光强度明显增强,且最大发射波长蓝移至585 nm,ONOO-和CN-的加入产生了较小的荧光强度变化,而其他物质的加入并未导致明显的荧光强度变化,表明探针L对ClO-的选择具有较好的专一性.

图2 加入各种阴离子或活性物质后 探针L的荧光光谱变化Fig.2 Fluorescence Spectral Changes of Probe L with Adding of Various Anions or Active Substances
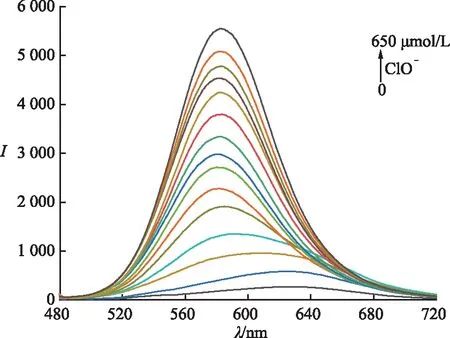
图3 加入不同浓度ClO-后探针L的荧光光谱变化Fig.3 Fluorescence Spectral Changes of Probe L with Adding Different Concentrations of ClO-
2.2 探针L对ClO-的荧光滴定实验
进行探针L识别ClO-的滴定实验,结果如图3所示.可以看出,随着ClO-浓度的不断增大,探针L的荧光强度逐渐增强,且在加入65倍的ClO-后达到平稳状态.因此,测试出探针L对ClO-的识别在ClO-浓度达到650 μmol/L时饱和,且荧光强度与ClO-浓度(0~650 μmol/L)之间呈现良好的线性关系(R2=0.993 28).如图4所示,根据检测限(LOD)计算公式:LOD=3σ/k[19-20],计算得到探针L对ClO-的检测限为1.03 μmol/L.表明探针L对ClO-的识别具有较高的灵敏度.
2.3 其他物质对探针L的干扰性测试
对探针L进行了抗干扰实验.首先,在探针L的混合溶液中分别加入65倍的阴离子,ROS/RNS(ClO-,SCN-,S2O32-,N3-,AcO-,NO2-,I-,HSO3-,C2O42-,SO42-,CN-,Br-,Cl-,F-,H2O2,ONOO-,NO·,
ROO·,·OH,1O2),再分别加入等量的ClO-进行荧光光谱测试,结果如图5所示.通过比较585 nm处的荧光强度变化可以看出,在其他物质存在的情况下,探针L对ClO-的响应不受影响.因此得出结论,探针L对ClO-的检测具有出色的抗干扰能力,可作为单一性识别ClO-的探针.

图4 探针L的荧光强度与ClO-浓度 之间的线性关系Fig.4 Linear Relationship of Fluorescence Intensity of Probe L with ClO- Concentrations
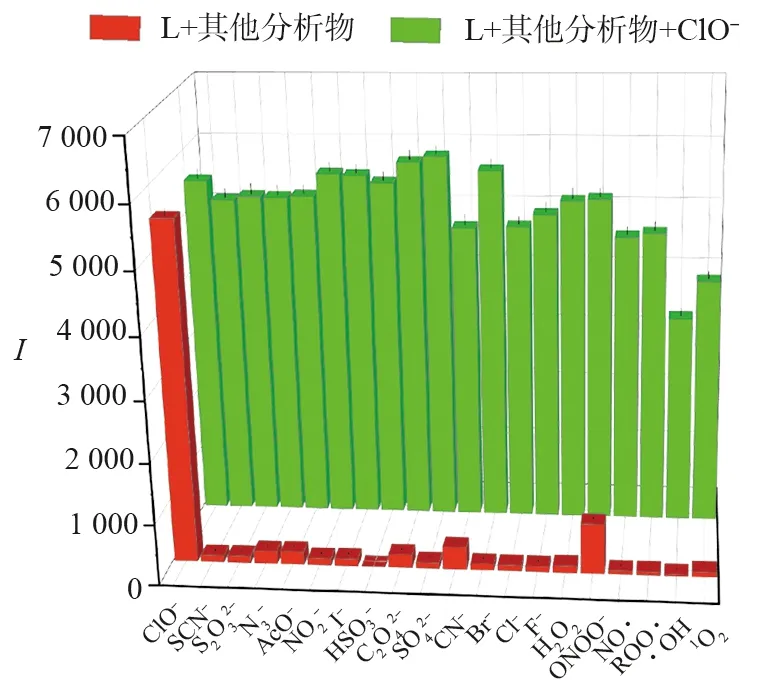
图5 加入干扰物及再分别加入ClO-后 探针L荧光强度的对比结果Fig.5 Comparison Results of Fluorescence Intensity of Probe L with Adding Interfering Substance and Followed by Adding ClO-
2.4 探针L识别ClO-的pH响应实验
测试了探针L在不同pH值下对ClO-的响应情况,结果如图6所示.可以看出,探针L在不同pH值下的混合溶液中均表现出弱荧光.探针L中加入ClO-后,当2≤pH<6或pH>10时,探针L的发光性能受到pH影响,而pH为6~10时,荧光强度保持平稳,说明酸性和强碱性条件会影响探针L对ClO-的响应,即探针L识别ClO-的适用条件为中性或弱碱性.表明探针L在检测生物环境中的ClO-方面有潜在应用.
图6 不同pH,探针L与ClO-结合后的荧光强度变化Fig.6 Fluorescence Intensity Changes of Probe L Combined with ClO- at Different pH
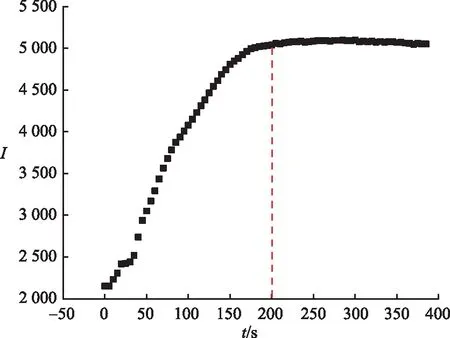
图7 探针L与ClO-作用后荧光强度随时间变化情况Fig.7 Changs of Fluorescence Intensity with Time After the Reaction of Probe L with ClO-
2.5 探针L对ClO-的响应时间测试
探针L对ClO-响应时间的测试结果如图7所示.可以看出,探针L中加入65倍的ClO-后,探针L的荧光强度随着时间的增加而逐渐增强,且在200 s时荧光强度基本平稳,说明探针L与ClO-在200 s时达到完全响应.
2.6 探针L识别ClO-的机理


图8 探针L对ClO-的响应机理Fig.8 The Response Mechanism of Probe L to ClO-
2.7 探针L检测水样中的ClO-
为了研究探针L在真实环境中的实用性,在DMF-水样的溶液中,采用加标的方法监测探针L在585 nm处的荧光强度,得到荧光强度与添加ClO-的浓度(440~490 μmol/L)之间的良好线性关系(R2>0.99)(图9).如表1所示,对自来水样品中ClO-的检测,其回收率为100.2 %~100.3 %,相对标准偏差(RSD)(n=3)为0.22 %~0.44 %;对饮用水样品中ClO-检测的回收率为99.8 %~100.4 %,RSD为0.12 %~0.37 %.因此,探针L可应用于实际水样品中ClO-的检测并具有较好的检测效果.
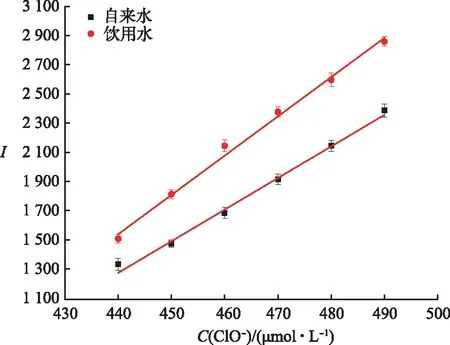
图9 荧光强度与ClO-加标浓度之间的线性关系Fig.9 Linear Relationship Between Fluorescence Intensity and Spiked Concentrations of ClO-
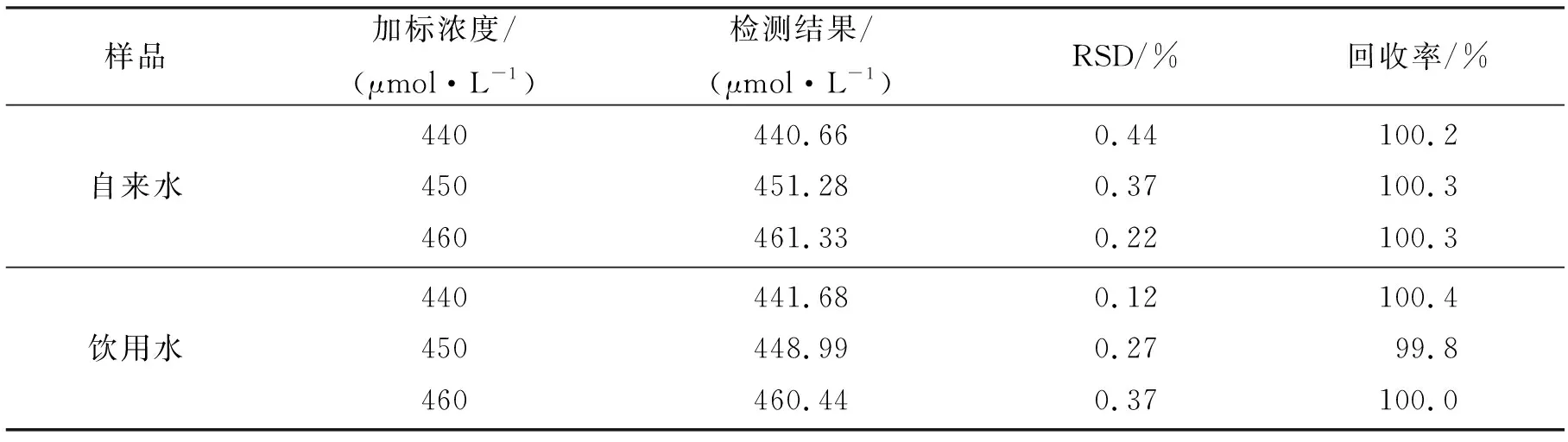
表1 探针L检测水样品中ClO-的加标回收率结果Tab.1 Results of Spiked Recovery of ClO-in Water Samples Detected by Probe L
3 结 论
基于二氨基马来腈合成了荧光探针L,其合成过程简单,对ClO-的识别具有较高的灵敏度,反应速度较快(200 s),检测限较低(1.03 μmol/L),pH适用范围较广(6~10),且不受其他物质(ClO-,SCN-,S2O32-,N3-,AcO-,NO2-,I-,HSO3-,C2O42-,SO42-,CN-,Br-,Cl-,F-,H2O2,ONOO-,NO·,ROO·,·OH,1O2)的干扰,具有高选择性.实验结果还证明了探针L能应用于真实水样中ClO-的检测.此外,探针L识别ClO-的机理为利用ClO-的氧化性使探针L在反应过程中释放出相应的醛,通过荧光增强而高选择性识别ClO-.研究表明该探针在监测生物环境中的ClO-浓度方面具有潜在应用价值.
