辐照联合表皮生长因子受体酪氨酸激酶抑制剂对中心体调节激酶(Aurora-A)高表达的非小细胞肺癌细胞系增殖的影响
2022-07-05张乐天李素君
张 英,张乐天,李素君,王 竞
1 北京科技大学医院 内科,北京 100083;2 解放军总医院第一医学中心 放疗科,北京 100853
Aurora-A作为中心体调节激酶,在肺癌中高表达并与预后不良相关,是放疗抗拒性基因[1-2]。靶向治疗对表皮生长因子受体(epidermal growth factor receptor,EGFR)等特定基因突变的非小细胞肺癌(non-small cell lung cancer,NSCLC)患者非常有效,这些突变基因可以预测分子靶向治疗疗效,又被称为敏感基因突变[3]。Meta分析表明,对于EGFR敏感基因突变驱动的NSCLC患者,应用小分子酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)如吉非替尼(Gefitinib)、厄洛替尼和阿法替尼相比化疗受益更大,主要表现为显著改善患者的无进展生存,降低41% ~ 69%患者的肿瘤进展风险[4]。临床随机对照研究也显示,与化疗相比,埃克替尼(Iconitib)一线治疗EGFR突变的NSCLC患者可降低39%的肿瘤进展风险,中位生存期为11.2个月(P=0.006)[5]。对于敏感基因突变的NSCLC采用针对性的分子靶向治疗,尽管可以明显改善患者的生存,但仍然有60%患者在1年左右出现靶向耐药和肿瘤进展[3,6]。对于无敏感基因突变驱动的NSCLC,放疗是一个有效的局部治疗手段。但对于靶向治疗耐药和放疗抗拒的NSCLC,尚缺乏有效的治疗手段。本研究探索辐照联合小分子EGFR-TKI对Aurora-A高表达的NSCLC细胞系的抑制作用,观察Aurora-A与EGFR下游信号通路的相关性,为克服靶向治疗耐药及逆转放射抗拒提供新的研究思路。
材料与方法
1 药物、细胞、试剂和仪器 Iconitib由浙江贝达药业有限公司提供, Gefitinib购自英国AstraZeneca公司;人类NSCLC细胞株(A549,GLC82)、人类支气管肺正常上皮细胞株(16HBE)由中国医学科学院分子肿瘤学国家重点实验室和天然药物活性物质与功能国家重点实验室提供;RPMI1640培养基购自美国Gibco公司,SuperScriptⅡ逆转录酶试剂盒购自美国Invitrogen公司,PCR扩增引物购自生工生物工程上海股份有限公司,Aurora-A Oligo siRNA购自上海吉玛制药技术有限公司,RIPA裂解液购自上海碧云天生物技术有限公司,Lipofectamine 2000试剂购自美国Invitrogen公司,HRP化学发光检测试剂盒购自美国GE公司;一抗除EGFR磷酸化兔单抗及β-actin鼠单抗外均为兔抗人多克隆抗体,其中抗Aurora-A(ab1287,1∶4 000)、抗p-Aurora-A(Thr288) (ab18318,1∶500)、抗EGFR(ab2430,1∶200)、抗Akt(ab106693,1:500)、抗Stat1(ab2415,1∶200)购自英国Abcam公司,抗p-EGFR(Thr669) (8 808,1∶1 000)、抗p-Akt(Ser473) (9 271,1∶1 000)、抗p-Stat1(Ser727) (9 177,1∶1 000)购自美国Cell Signaling公司,抗β-actin(8 432,1∶2000)购自美国Santa Cruz公司。二抗羊抗兔IgG及二步法显色试剂盒购自北京中杉金桥生物技术有限公司。酶标仪微孔板阅读器购自美国Bio-Rad公司,PCR扩增仪ABI PRISM7700实时PCR系统购自美国Applied Biosystems公司,M5型流式细胞仪购自美国BD Biosciences公司,细胞株辐照源Synergy 6MV-X线为瑞典Elekta公司生产(剂量率400 MU/min)。
2 实验细胞和药物筛选 A549和GLC82细胞株培养液为含10%胎牛血清的RPMI1640,16HBE细胞株培养液为含1.5 g/L碳酸氢钠、2.7 g/L葡萄糖、2.0 mmol/L L-谷氨酰胺、0.1 mmol/非必需氨基酸、5µg/L胰岛素、10 ng/mL表皮生长因子、1 µg/mL转铁蛋白、500 ng/mL氢化可的松和4%FBS的Ham’s F12培养液。细胞株置于37℃、5%CO2培养箱中培养,0.25%胰酶消化传代,细胞稳定呈对数生长期时用于实验。在A549、GLC82和16HBE细胞株中,通过实时聚合酶链反应(RT-PCR)和蛋白印迹法(Western blot)分别检测Aurora-A基因表达和蛋白表达,筛选出Aurora-A高表达的NSCLC细胞株用于试验。采用MTT法测定EGFR-TKI(Icotinib和Gefitinib)的细胞毒性,在490 nm处采用酶标仪微孔板阅读器测定吸光度并计算确定半数抑瘤浓度(IC50)。实验至少独立进行3次,每次3个样本。采用实验所得的IC50作用于Aurora-A高表达的NSCLC细胞24 h后,收集处理细胞检测EGFR、Aurora-A、Akt和Stat1相关基因的蛋白及其磷酸化蛋白表达,比较并筛选出明显抑制EGFR蛋白表达的靶向药物用于后续实验。
3 RT-PCR检测Aurora-A基因的mRNA表达水平 采用Trizol法分别提取A549、GLC82和16HBE细胞总RNA,采用SuperScriptⅡ逆转录酶试剂盒获取cDNA进行PCR扩增反应。PCR引物根据GenBank设计,Aurora-A正向(5'-3'):TGGAATAT GCACCACTTGGA,反向(5'-3'):ACTGACCACCC AAAATCTGC;GAPDH正向(5'-3') :CAGGAGGC ATTGCTGATGAT,反向(5'-3'):GAAGGCTGGGG CTCATTT。获取的PCR产物经凝胶电泳验证后在ABI PRISM7700实时PCR系统进行定量分析。每个样本设置3个平行管,以3个平行管所得Ct值的均值计算。ΔCt=Ct(Aurora-A)-Ct(GAPDH),采用法计算获得Aurora-A mRNA的表达水平。
4 Western blot法检测EGFR和Aurora-A相关基因的蛋白表达水平 采用RIPA裂解液处理上述辐照后的细胞提取总蛋白,将30 µg蛋白上样于聚丙烯酰胺凝胶,电泳后将蛋白湿转至硝酸纤维素膜。按步骤先后加入相关基因的一抗孵育4℃过夜,辣根过氧化物酶标记的二抗孵育2 h,采用化学发光检测试剂盒进行蛋白条带的显影。
5 药物及辐照干预 采用上述筛选的靶向药物(IC50)作用于Aurora-A高表达细胞株24 h后辐照,细胞株接受辐照单次剂量分别为0 Gy、2 Gy、4 Gy、6 Gy、8 Gy、10 Gy、15 Gy、20 Gy。分别于辐照后2 h收集处理细胞,Western blot检测EGFR和Aurora-A相关基因蛋白表达,并于辐照后24 h采用流式细胞仪检测细胞周期时相分布。
6 siRNA转染Aurora-A高表达NSCLC细胞株 根据siRNA的设计原则,设计合成针对人Aurora-A基因的Oligo siRNA。Aurora-A siRNA 序列正向(5'-3'):AUGCCCUGUCUUACUGUC,反向(5'-3'):UGACAGUAAGACAGGGCAUTT;阴性对照正向(5'-3'):UUCUCCGAACGUGUCACGUTT,反向(5'-3'):ACGUGACACGUUCGGAGAATT。按照Lipofectamine 2000试剂说明书转染细胞株,72 h后常规收集细胞进行检测。
7 流式细胞仪检测细胞凋亡 将Aurora-A高表达的NSCLC细胞、Aurora-A siRNA转染的NSCLC细胞分别加靶向药物(IC50)和不加靶向药物作用24 h,并于每组再设0 Gy、2 Gy、10 Gy辐照组。将辐照后的细胞放培养箱孵育48 h后,胰酶消化、离心并分别收集不同剂量组中贴壁生长和悬浮在培养液中的细胞,根据凋亡试剂盒说明书分别行Annexin V FITC/碘化丙啶(PI)冰上染色至少30 min,使用流式细胞仪检测细胞凋亡水平。
8 辐照细胞克隆形成分析 指数生长期细胞经胰酶消化后制成单细胞悬液并调整稀释浓度备用。按不同剂量点(0 Gy、2 Gy、4 Gy、6 Gy、8 Gy、10 Gy)对应不同数量(500、2 000、5 000、10 000、20 000、50 000)细胞分别接种至培养瓶中。每个剂量点设3个瓶,并分为辐照联合靶向药物组和单纯辐照组。靶向药物的给药浓度为该药的IC50。将培养瓶加靶向药孵育箱培养24 h后给予不同剂量X线辐照后继续培养14 d。用无水甲醇固定细胞,结晶紫染色30 min,计数细胞克隆。细胞数 ≥ 50定义为一个克隆。克隆形成率=(克隆数/接种细胞数) × 100%。以0 Gy组克隆形成率作为对照组,计算出各剂量组的细胞存活率。每一剂量点的细胞存活分数定义为某剂量组与对照组克隆形成率的比值。
9 放射生物学分析 根据细胞克隆形成按照放射生物学单击多靶模型拟合绘制细胞存活曲线,并计算终斜率平均致死剂量(D0)、准阈剂量(Dq)、外推数值(N)、2 Gy辐照细胞存活分数(SF2)以及放射增敏比(SER)。SER=D0(辐照组)/ D0(辐照联合靶向药物组)。
10 统计学处理 应用SPSS26.0统计软件对数据进行处理,实验数据以¯ ±s表示。两组数据比较用t检验,多组数据比较采用方差分析,两两比较采用LSD检验,P< 0.05为差异有统计学意义。
结 果
1 筛选Aurora-A高表达细胞系与靶向药物 Aurora-A mRNA在A549和GLC82肺癌细胞系中的表达水平分别是0.525 ± 0.053和2.545 ± 0.822(P< 0.05)(图1A),相应的蛋白及磷酸化水平显示Aurora-A在GLC82肺癌细胞系高表达(图1B),靶向药物Icotinib和Gefitinib在GLC82细胞系的IC50分别为2.92 µmol/L(图1C)和0.14 µmol/L(图1D)。肺癌细胞系GLC82分别接受Icotinib(2.92 µmol/L)和Gefitinib(0.14 µmol/L)干预后,与未加药的GLC82细胞对照相比,Icotinib组p-EGFR/EGFR水平明显下降,p-Akt/Akt和p-Stat1/Stat1发生显著变化(P<0.05),而p-Aurora-A/Aurora-A无明显影响(P>0.05)(图2A、图2B)。后续实验采用GLC82细胞株和Icotinib进行。
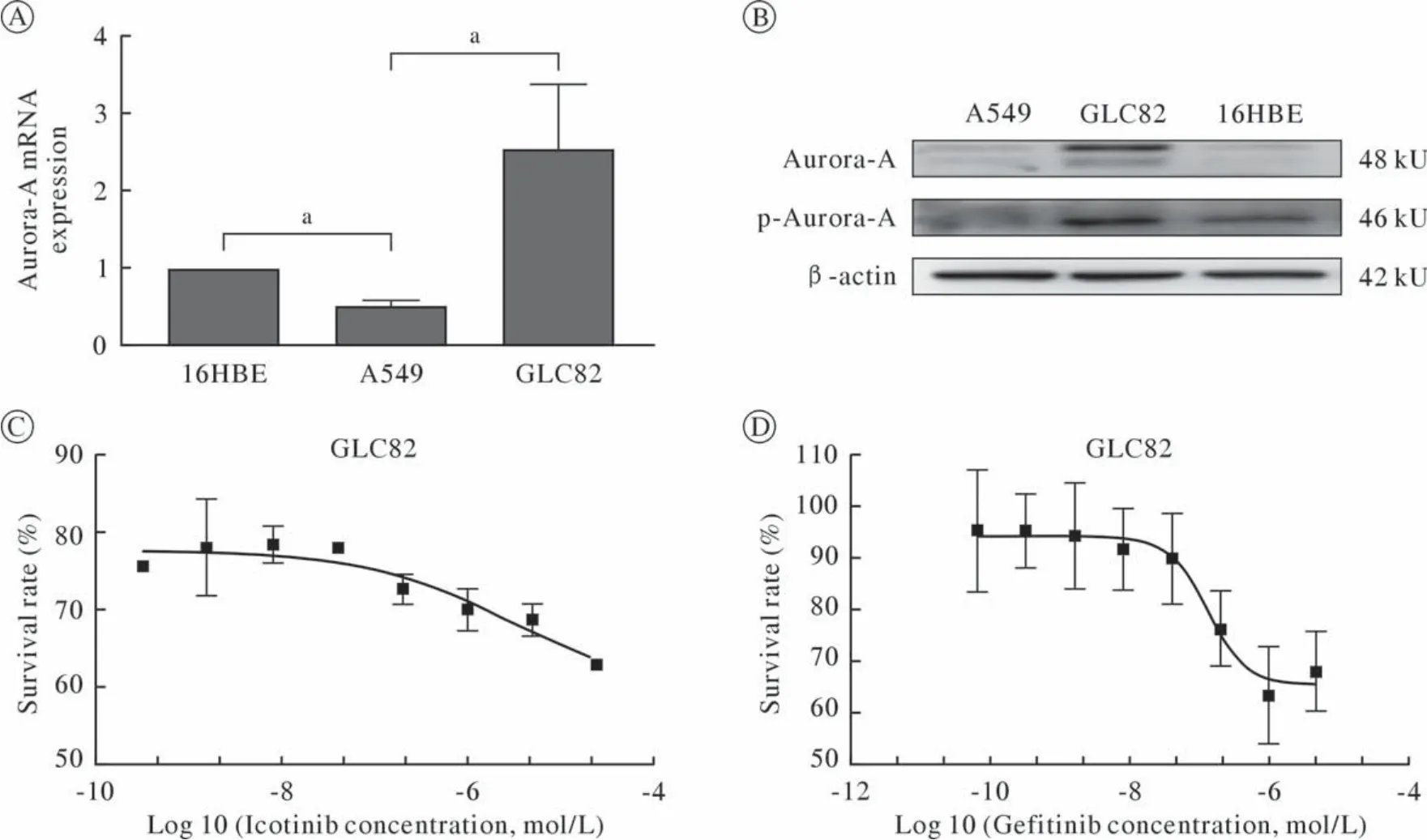
图1 Aurora-A在非小细胞肺癌细胞系(A549,GLC82)和人支气管肺正常上皮细胞株(16HBE)中的表达及EGFR-TKI在GLC82细胞系中抑瘤情况(aP<0.05) A:RT-PCR检测Aurora-A mRNA在16HBE、A549和CLC82细胞系中的相对表达量;B:Western blot检测Aurora-A及其磷酸化蛋白在非小细胞肺癌细胞系中的表达;C:MTT法检测GLC82细胞在不同浓度Icotinib中的生存比例;D:MTT法检测GLC82细胞在不同浓度Gefitinib中的生存比例Fig.1 Aurora-A mRNA and EGFR-TKIs in 16HBE, A549 and GLC82 cell lines (aP<0.05) A: Comparison of Aurora-A mRNA relative expression in 16HBE, A549 and GLC82 cell lines cells by RT- PCR; B: Western blot analysis of Aurora-A and p-Aurora-A in cell lines cells; C: Survival of GLC82 cells with different concentration of Icotinib by MTT; D: Survival of GLC82 cells with different concentration of Gefitinib by MTT
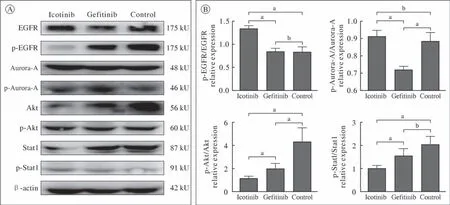
图2 Icotinib(2.92 µmol/L)或Gefitinib(0.14 µmol/L)处理后EGFR及下游信号通路激酶在GLC82细胞系中的表达A:Western blot检测EGFR、Aurora-A、Akt和Stat1蛋白在GLC82细胞系中的表达水平;B:采用Image J 1.35a软件分析Western blot蛋白电泳条带密度定量比较GLC82细胞系中EGFR、Aurora-A、Akt和Stat1蛋白及其磷酸化水平(aP < 0.05,bP > 0.05)Fig.2 EGFR and its downstream signaling kinases following Icotinib (2.92 µmol/L) or Gefitinib (0.14 µmol/L) in GLC82 cell linesA: Western blot analysis of EGFR, Aurora-A, Akt, Stat1 in GLC82 cell lines; B: Quantitative comparison of Western blot was performed using Image J 1.53a (aP < 0.05, bP > 0.05)
2 EGFR、Aurora-A、Akt和Stat1蛋白及其磷酸化蛋白表达 Icotinib联合辐照(2 Gy、10 Gy)与单纯Icotinib相比,p-EGFR/EGFR水平无明显变化(P>0.05);Icotinib联合辐照2 Gy与单纯Icotinib相比,p-Aurora-A/Aurora-A、p-Akt/Akt和p-Stat1/Stat1变化均不明显(P>0.05);Icotinib联合辐照10 Gy时p-Aurora-A/Aurora-A及p-Akt/Akt明显下降,p-Stat1/Stat1也呈显著改变(P< 0.05)。见图3A、图3B。
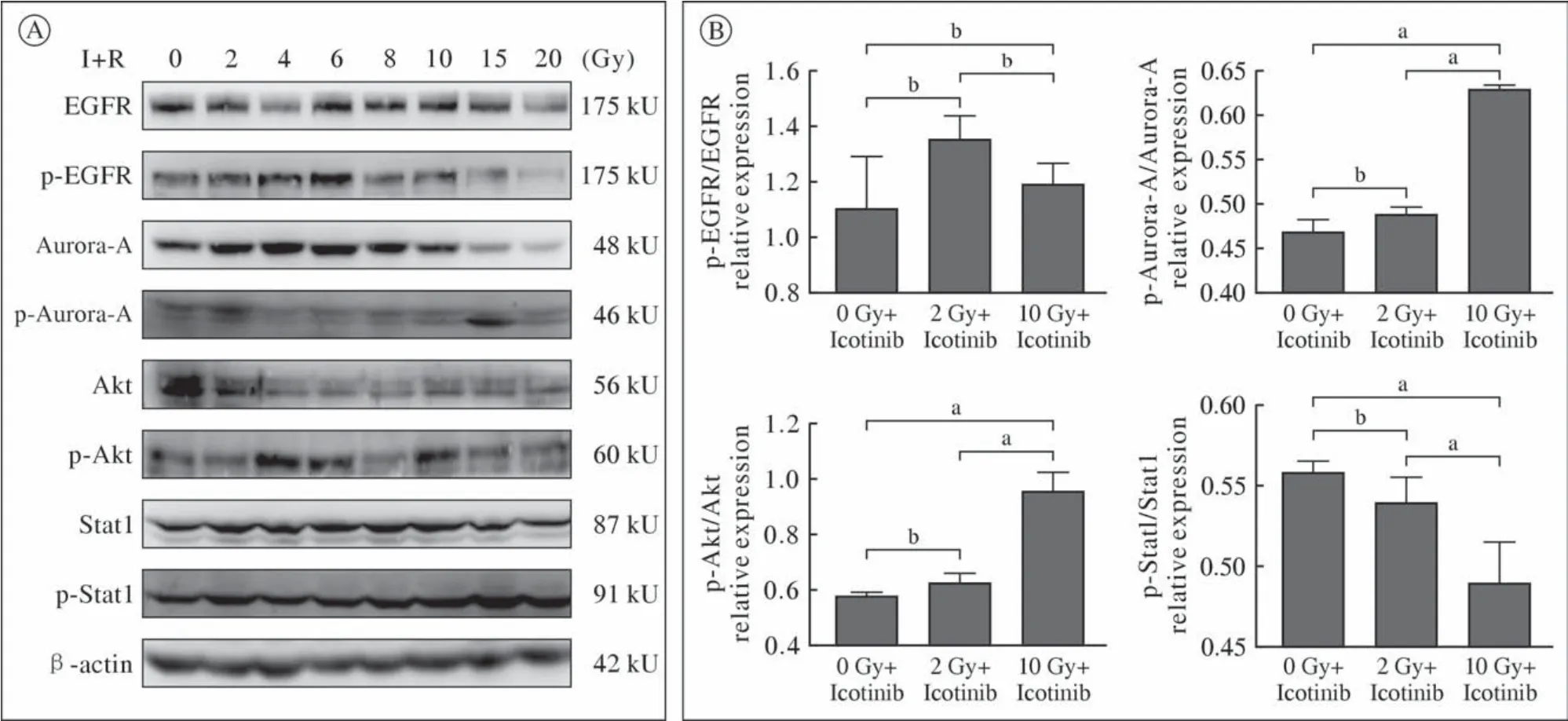
图3 Icotinib联合辐照(I+R)后EGFR和下游激酶在GLC82细胞中的表达 A:Western blot法分析GLC82细胞经Icotinib(2.92 µmol/L)在辐照前预处理24 h,辐照2 h后收集细胞采用抗体进行分析;B:采用Image J 1.53a软件测定蛋白电泳条带密度(aP<0.05,bP>0.05)Fig.3 Expression of EGFR and its downstream kinases in GLC82 cells treated with Icotinib combined radiation (I+R) A: GLC82 cells were pretreated with Icotinib (2.92 µmol/L) for 24 h before receiving radiation. Cells were harvested at 2 h later and analyzed by western blot analysis using antibodies; B: The protein electrophoresis band density was determined by Image J 1.53a software (aP<0.05,bP>0.05)
3 细胞周期分布 流式细胞仪检测显示辐照联合Icotinib随着放射剂量递增,G0/G1期及S期细胞比例递减,G2/M期比例递增,细胞周期分布呈线性变化。见图4。
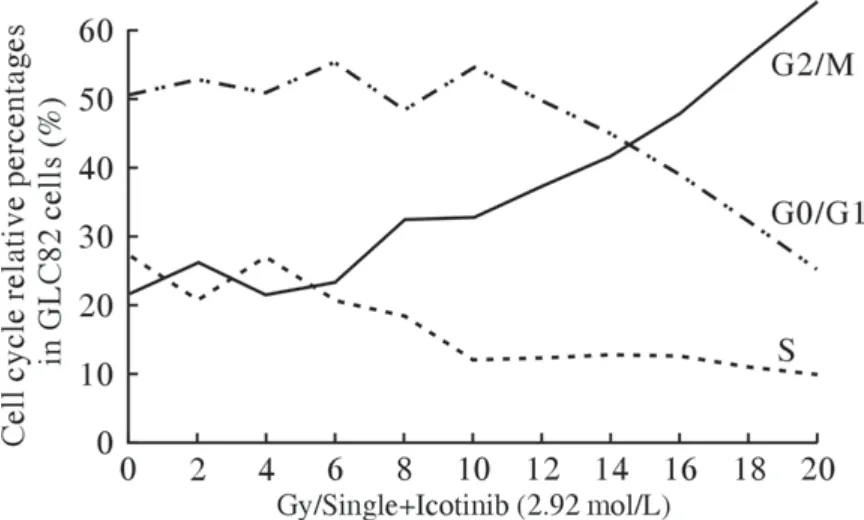
图4 GLC82细胞接受Icotinib (2.92 µmol/L)联合辐照后的细胞周期分布Fig.4 Distribution of cell cycle in GLC82 cells treated with combination of radiation and Icotinib (2.92 µmol/L)
4 细胞凋亡率比较 GLC82细胞接受Aurora-A siRNA、Icotinib(2.92 µmol/L)、辐照(2 Gy、10 Gy)和Icotinib联合辐照后的凋亡情况见图5、图6和表1。在GLC82细胞系中,与对照(未加Icotinib)相比,2 Gy单纯辐照未增加细胞的凋亡率(P>0.05),而Icotinib、单纯大剂量辐照(10 Gy)、Icotinib联合辐照(2 Gy、10 Gy)对于GLC82均有明显的凋亡作用(P<0.05)(图6A)。在接受Aurora-A siRNA干预后,除了Icotinib联合辐照2 Gy导致GLC82细胞凋亡作用相似外(P>0.05)(图6B、表1),Icotinib、辐照(2 Gy、10 Gy)以及Icotinib联合辐照10 Gy均产生明显的促进GLC82细胞凋亡作用(P<0.05)(图6B)。
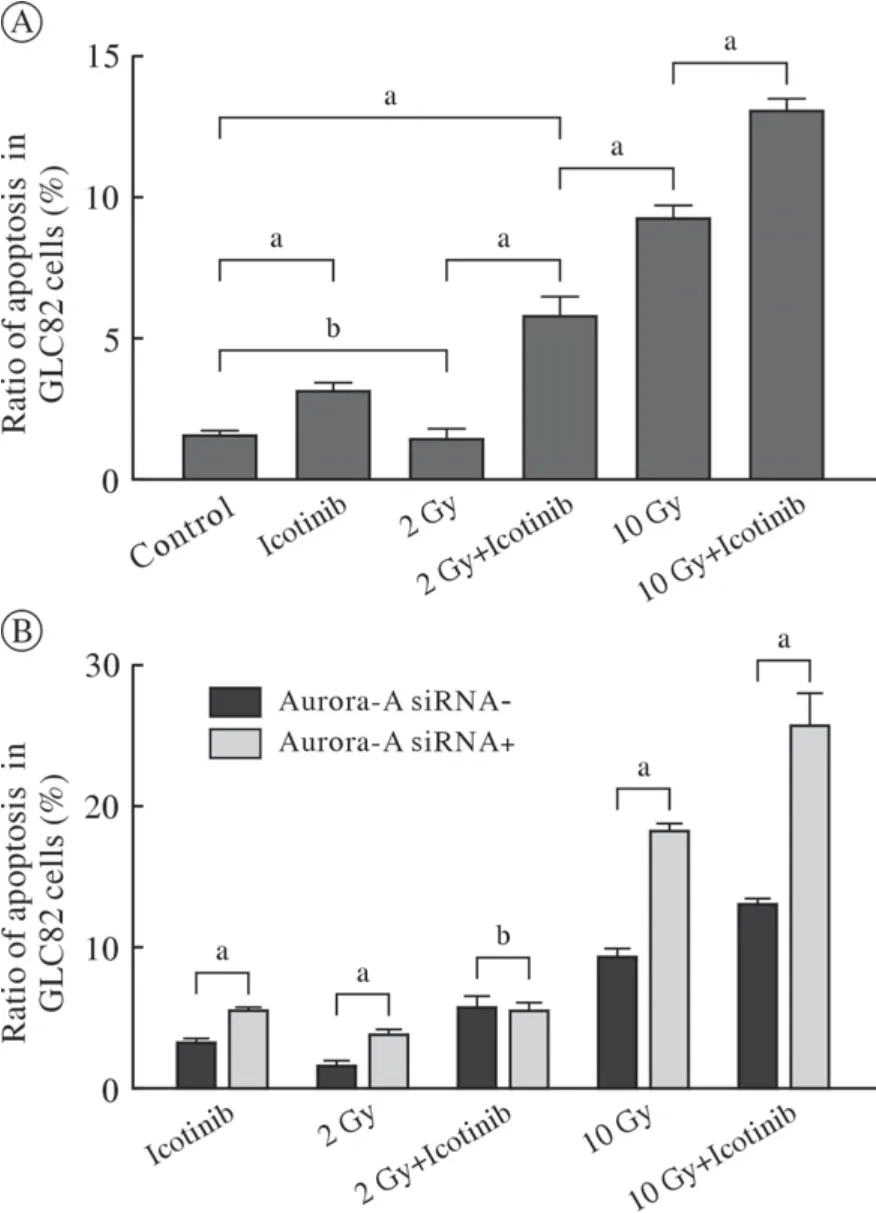
图6 流式细胞仪检测不同干预后GLC82细胞的凋亡率A:GLC82细胞接受Icotinib (2.92 µmol/L)、辐照(2 Gy、10 Gy)、辐照联合Icotinib后细胞凋亡率比较;B:Aurora-A siRNA、Icotinib (2.92 µmol/L)、辐照(2 Gy、10 Gy)、辐照联合Icotinib后GLC82细胞凋亡率的比较(aP < 0.05,bP > 0.05)Fig.6 Comparison of apoptosis of GLC82 cells after treatment A: Apoptosis of GLC82 cells treated with Icotinib (2.92µmol/L), radiation (2 Gy, 10 Gy) and combination of radiation and Icotinib; B: Comparison of apoptosis of GLC82 cells treated with Aurora-A siRNA, Icotinib (2.92 µmol/L),radiation (2 Gy, 10 Gy) and combination of radiation and Icotinib (aP < 0.05, bP > 0.05)
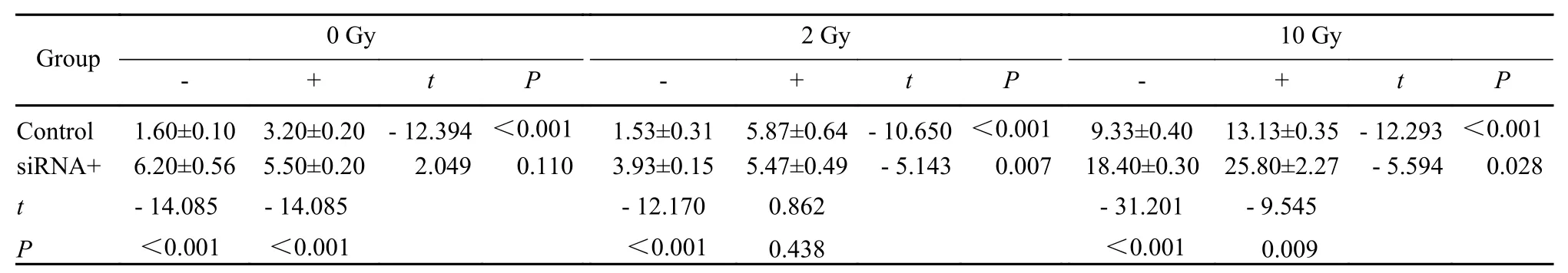
表1 GLC82细胞接受Aurora-A siRNA、Icotinib、辐照及辐照联合Icotinib后的细胞凋亡率比较Tab. 1 Apoptosis of GLC82 cells treated with Aurora-A siRNA, Icotinib, radiation and combination of Icotinib and radiation
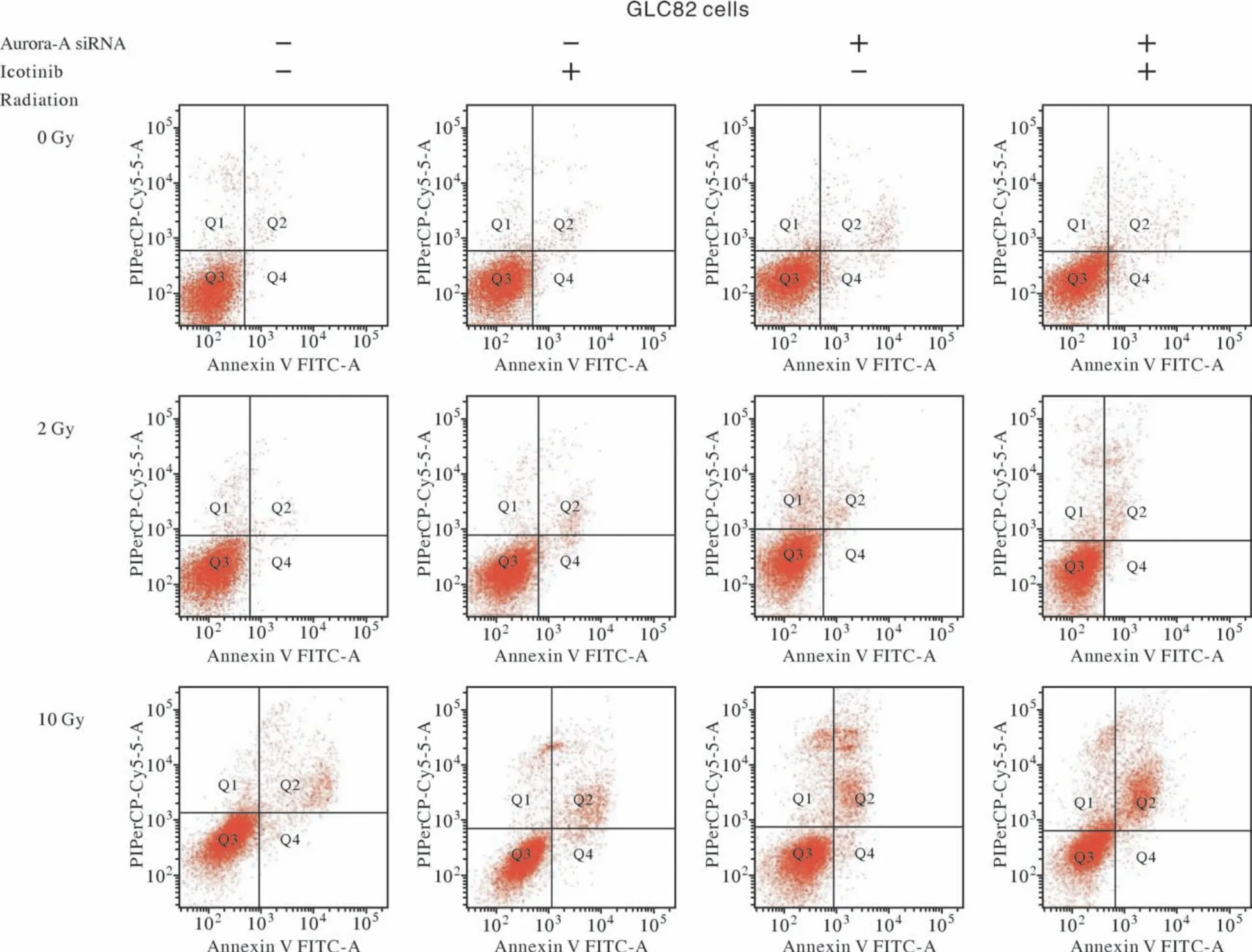
图5 流式细胞仪检测GLC82细胞接受Aurora-A siRNA、Icotinib (2.92 µmol/L)及Icotinib联合辐照(2 Gy、10 Gy)干预后的凋亡情况Fig.5 Apoptosis of GLC82 cells treated with Aurora-siRNA, Icotinib (2.92 µmol/L) and combination of Icotinib and radiation (2 Gy, 10 Gy)by flow cytometry
5 放射生物学评价 根据放射生物学单击多靶模型拟合GLC82细胞存活曲线,辐照联合Icotinib较单纯辐照细胞生存比例明显下降 (图7),辐照联合Icotinib的平均致死剂量(D0值)、2 Gy细胞存活比例(SF2)均较单纯辐照明显下降(表2),表明辐照联合Icotinib可以增强GLC82细胞的放射敏感度(SER=1.60)。
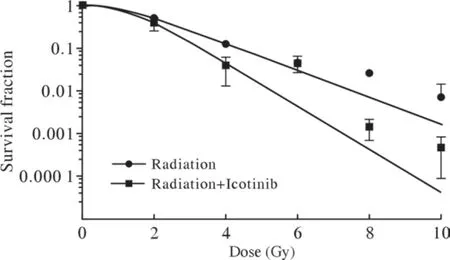
图7 GLC82细胞接受辐照联合Icotinib (2.92 µmol/L)的剂量生存曲线Fig.7 Dose-survival curves in GLC82 cells treated with radiation combined Icotinib (2.92 µmol/L)
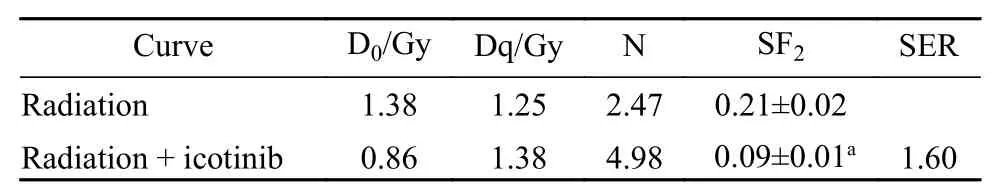
表2 GLC82细胞接受辐照及辐照联合Ictoinib的剂量生存曲线放射生物学指标Tab. 2 Radiobiological parameters of dose-survival curves of GLC82 cells
讨 论
辐照联合小分子EGFR-TKI可以增强NSCLC细胞的放射敏感度[7],但对于放射抗拒的细胞,辐照联合EGFR-TKI的作用尚未确定。本研究首先在两种NSCLC细胞系中筛选出Aurora-A相对高表达的GLC82细胞系,由于在GLC82细胞中Icotinib较Gefitinib对EGFR磷酸化的抑制作用更强,我们选择了Icotinib作为联合辐照的靶向药物。GLC82细胞接受Icotinib、Icotinib联合辐照2 Gy干预时,p-Aurora-A/Aurora-A无明显变化(P>0.05),表明p-Aurora-A/Aurora-A的表达可能对Icotinib、Icotinib联合辐照2 Gy抗拒。Icotinib联合辐照10 Gy时,p-Aurora-A/Aurora-A及p-Akt/Akt明显下降,p-Stat1/Stat1也呈显著改变(P<0.05),表明p-Aurora-A/Aurora-A的表达可以被Icotinib联合大剂量辐照(10 Gy)所逆转,而且p-Aurora-A/Aurora-A的表达并不依赖于p-EGFR/EGFR的表达。细胞周期分布上显示Icotinib联合放疗后GLC82细胞周期呈线性改变,肿瘤细胞明显阻滞于G2/M期。流式细胞仪检测显示单纯常规辐照(2 Gy)并不能增加GLC82细胞的凋亡,而Icotinib、大剂量辐照(10 Gy)及Icotinib联合辐照(2 Gy、10 Gy)均可导致GLC82细胞显著凋亡。Aurora-A siRNA干预GLC82细胞后能明显增加Icotinib、辐照(2 Gy、10 Gy)和Icotinib联合辐照10 Gy的放疗敏感度,促进GLC82细胞凋亡。这些结果表明,Aurora-A可能是GLC82细胞的放射抗拒性基因。细胞克隆形成实验进一步证实,辐照联合Icotinib可以增强Aurora-A相对高表达的GLC82细胞凋亡,表明辐照联合靶向药物可以逆转GLC82中Aurora-A引起的放射抗拒。
Aurora-A是EGFR下游信号通路激酶,不仅参与肿瘤的增殖、迁徙、侵袭和转移,而且介导化疗耐药、放射抗拒和肿瘤的免疫治疗[8]。Aurora-A通过调节细胞有丝分裂底物在肿瘤细胞中异常表达,促进肿瘤细胞增殖,并通过非有丝分裂途径影响其他分子,促进肿瘤细胞侵袭和转移[8]。在许多肿瘤中观察到Aurora-A和EGFR异常表达,并且这种异常表达与预后不良相关[9-11]。目前认为EGFR-Aurora-A通路的异常激活与肿瘤的形成和发展相关[12]。在肺腺癌H1299和A549细胞系的研究中发现,Aurora-A抑制剂诱导细胞周期停滞和凋亡可能与下调EGFR相关[9]。近年有报道EGFR激酶通过激活USP8去泛素化酶抑制了纤毛形成[13]。通过敲降EGFR可以下调USP8 - 毛细血管扩张素 - Aurora-A信号通路,导致纤毛形成。EGFR - USP8 - 毛细血管扩张素 - Aurora-A信号转导通路通过限制分裂细胞中纤毛的形成,促进肿瘤细胞增殖。最近对口腔鳞癌的研究发现,EGFR的激活可以通过Aurora-A磷酸化导致明显的纤毛吸收[14]。Aurora-A沉默可显著恢复纤毛的表达,明显抑制肿瘤生长。Aurora-A介导的磷酸化促进NSCLC的生长和迁移[15]。Aurora-A在很多肿瘤中的过表达还导致对放化疗的抗拒[8,16]。Akt活化的肿瘤细胞对凋亡抗拒,Aurora-A功能可能通过Akt活化介导[16-18]。我们在Aurora-A相对高表达的GLC82细胞中观察到Icotinib、Icotinib联合辐照10 Gy可明显降低GLC82细胞p-Aurora-A/Aurora-A和p-Akt/Akt的表达(P<0.05)。
电离辐射对Stat家族成员有不同影响,有时是非特异性的[19]。EGFR-TKI(如拉帕替尼)产生的巨噬细胞相关的Stat1磷酸化可以刺激和延长抗肿瘤效应[20]。本研究观察到Icotinib联合辐照10 Gy后GLC82细胞的p-Stat1/Stat1显著改变(P<0.05)。另外,在EGFR非依赖性的耐药机制中,受体酪
氨酸激酶的下调或EGFR下游激酶的异常活化可通过激发PI3K/Akt和MAPK信号通路导致EGFRTKI耐药[21]。在肺癌中第3代EGFR-TKI的耐药与Aurora-A相关[22]。我们的研究中观察到Icotinib联合大剂量辐照(10 Gy)可以明显降低p-Akt/Akt和p-Aurora-A/Aurora-A,可能有助于阻断EGFR非依赖性耐药。
综上所述,辐照联合Icotinib对于Aurora-A相对高表达的GLC82细胞具有逆转Aurora-A放射抗拒、增强GLC82细胞凋亡的作用,其具体作用机制还有待进一步研究。
