新型细胞外基质源性神经修复材料的制备与评价
2022-07-05张宇轩李超超孟繁琪管延军刘修志许文静
韩 锋,魏 帅,张 健,张宇轩,李超超,孟繁琪,管延军,刘修志,许文静,彭 江
1 河北北方学院,河北张家口 075000;2 解放军总医院 骨科研究所,北京 100853;3 天津大学天津医院,天津 300211;4 解放军医学院,北京 100853;5 北京大学人民医院 脊柱外科,北京 100044
周围神经损伤及缺损在临床上十分常见,而长段缺损的治疗效果未达到令人满意的程度。不同于中枢神经系统,周围神经系统具有一定的再生能力。当神经缺损长度小于5 mm时,可通过一期端端吻合修复[1]。对于长段周围神经缺损,自体神经移植是缺损修复的最佳治疗方法[1]。但自体神经移植存在以下问题:1)可供移植的神经来源有限;2)供区造成二次损伤和功能缺失,近端可能形成痛性神经瘤;3)手术时间较长[2-3]。因此,寻找合适的自体神经替代移植物成为目前的研究重点。人工合成材料由于仿生程度不高,实际效果不如去细胞生物材料[3]。单纯的同种异体去细胞神经移植修复材料投入临床使用存在很多问题,受到材料来源困难、伦理等因素影响,不易实现标准化和产业化[3]。由于易于获取、低免疫原性等优点,异种去细胞神经基质被认为是替代自体神经移植的一种选择[4]。异种移植的免疫反应主要取决于髓鞘、轴突和脂肪的存在[5],从而抑制移植物再生。传统异种去细胞神经基质修复材料的制备方法:1)反复冻融等;2)化学洗涤 ;3)核酸酶降解[6-8]。然而,传统制备方法对神经移植物内部脂肪的去除并不理想,导致移植物再生受抑制。近年来,脂肪提取方法[微波、超声、酶和超临界二氧化碳(supercritical carbon dioxide,scCO2)]在食品、农业和环境污染领域得到了广泛应用[9-14]。相比其他去脂方法,scCO2萃取更高效、更安全环保。scCO2萃取使用处于临界压力和临界温度以上的二氧化碳流体作为萃取剂,从动植物组织中提取脂肪成分,再通过减压、升温等方式,达到分离提纯的目的。本实验在传统制备方法的基础上,增加scCO2萃取脂肪反应,从而减弱脂肪造成的免疫反应,促进移植物再生。实验选用新鲜猪坐骨神经作为原材料,通过调整反复冻融次数及低毒性十二烷基硫酸钠(sodium dodecyl sulfate,SDS)去除神经中的髓鞘、轴突,通过scCO2去除神经内部的脂肪,从而更好地兼顾去除免疫原性和保存基底膜管结构完整性。通过物理性能测定(外观和规格尺寸)、组织学观察(HE染色、Laminin/DAPI免疫荧光染色和油红O脂肪染色)、DNA含量测定和扫描电镜观察等方法评价制备效果。我们期望证明这种新型细胞外基质源性神经修复材料能够去除免疫原性,替代自体神经移植物修复周围神经缺损,并在不久的将来作为异种异体神经移植物重建人类缺损的周围神经。
材料与方法
1 实验试剂与设备 十二烷基硫酸钠、Pig Laminin Antibody(Sigma公司),磷酸缓冲盐溶液(PBS)、Goat Anti-Mouse IgG/SAlexa Fluor 594、HE试剂盒、改良油红O染色液、封闭山羊血清(Solarbio公司),QIAamp DNA纯化mini试剂盒(Qiagen公司),DAPI染色液(博士德生物公司),定轨摇床(MO-10,Labsun公司),Pannoramic Confocal 3DHISTEC全景共聚焦扫描系统(济南丹吉尔电子有限公司),Nikon ECLIPSE NI科研级正置荧光显微镜(Nikon公司),CM1900冷冻切片机(Leica公司),NanoPhotometer-NP80 Mobile超微量分光光度计(Implen公司),真空冷冻干燥机(河南兄弟仪器设备有限公司),雷磁PHB-4便携式pH计(上海仪电科学仪器股份有限公司),HITACHI Regulus 8100扫描电镜(武汉赛维尔生物科技有限公司),HSFC-35-1-MC-EDU超临界二氧化碳萃取装置(大连卓尔高科技有限公司)。
2 神经修复材料的制备与分组 无菌条件下截取新鲜猪坐骨神经,直径(4 ± 1) mm,长度5 cm。立即在显微镜下仔细剔除神经外脂肪、血管等结缔组织或先放入-80℃冰箱中冻存,需要时再仔细剔除神经外脂肪、血管等结缔组织,PBS液冲洗3 ~ 5遍,每遍10 min,随机分入以下3组,每组30根。新鲜组:将剥除神经外脂肪、血管等结缔组织的新鲜神经置于-20℃预冷5 h,然后置于真空冷冻干燥机中冷冻干燥24 h,作为对照组。0.5% SDS 48 h组:1)将剥离并剔除神经周围的脂肪、血管等结缔组织于-80℃条件下冷冻3 h,恢复室温1 h,反复冻融3次;2)称重SDS 3 g,溶于600 mL去离子纯水中,配制成0.5% SDS溶液,滤纸过滤,高温高压消毒;3)取出坐骨神经置于50 mL离心管中,加入之前配制好的30 mL 0.5% SDS溶液,在室温下利用定轨摇床震荡48 h;4)将神经在4℃条件下于超声仪中间歇处理3次,每次3 min,频率为50 000 Hz;5)取出坐骨神经置于离心管中,在0.01 mol/L PBS中再次漂洗20次,每次4 ~ 6 h;6)将获取的神经于-20℃预冷5 h,然后置于真空冷冻干燥机中冷冻干燥24 h。0.5% SDS 48 h + scCO2组:1)重复0.5%SDS 48 h组制备的1 ~ 6步;2) 将获取的神经在超临界二氧化碳萃取仪中于30℃和5.5 MPa下进行脂肪萃取处理5 h。
3 神经修复材料的组织学观察 将各组神经修复材料分别冰冻切片后行HE染色、Laminin/DAPI免疫荧光染色和油红O脂肪染色,镜下观察照相。
4 神经修复材料的DNA含量测定 每组选取20根不同来源的冻干神经,充分剪碎混匀。每组称取25 mg,按QIAamp DNA纯化mini试剂盒步骤操作。吸取1 µL待测神经修复材料的DNA溶液置于分光光度计中,在260 nm波长下测定各组DNA溶液吸光度,根据公式换算为DNA浓度(ng/mg)。各组神经修复材料DNA含量测定实验独立重复3次。
5 神经修复材料的扫描电镜观察 将各组神经修复材料横向切断,分别固定于扫描电镜的标本金属底座上,置于离子溅射仪中对修复材料喷金,后对神经修复材料内部超微结构进行观察并记录拍照。
结 果
1 神经修复材料的大体观察 新鲜猪坐骨神经为棕黄色,长5 cm,质地较致密。处理后的各组神经长度缩短至约4.5 cm,直径稍增大,颜色呈乳白色半透明状,神经大体轮廓仍完整,质地较新鲜神经疏松,神经外膜白色条纹结构消失;在空气中无塌陷,较易黏着。0.5% SDS 48 h组与0.5% SDS 48 h + scCO2组间肉眼观察未见明显区别。见图1。
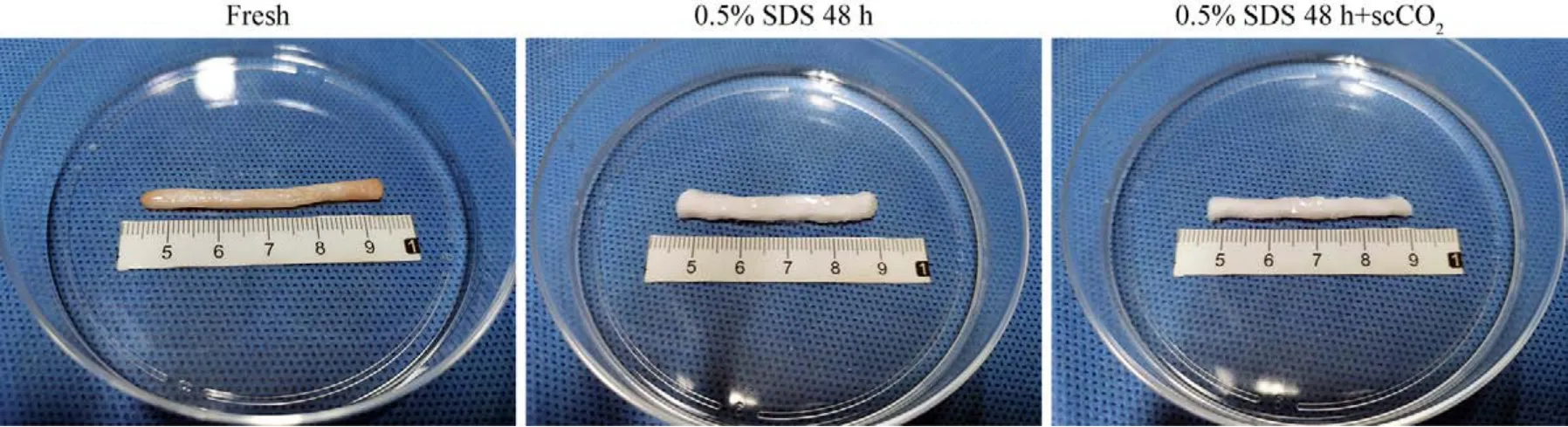
图1 三组神经修复材料的大体观察Fig.1 General observation of nerve repair material in the three groups
2 神经修复材料的组织学观察 1)神经修复材料的HE染色:新鲜组神经可观察到蓝色细胞核,神经束和周围脂肪组织结构完整;0.5% SDS 48 h组未见蓝色细胞核,神经束周围脂肪组织结构稍破坏,神经束膜结构完整;0.5% SDS 48 h + scCO2组未见蓝色细胞核,神经束周围脂肪组织结构明显破坏,神经束膜结构稍破坏(图2)。2)神经修复材料的Laminin/DAPI染色:新鲜组可见完整的神经内膜管状结构(红色)及大量细胞核(蓝色);0.5% SDS 48 h组未见蓝色细胞核,神经内膜管状结构较完整;0.5% SDS 48 h + scCO2组未见蓝色细胞核,神经内膜管状结构稍破坏(图3)。3)神经修复材料的油红O脂肪染色:新鲜组神经束间脂肪(红色)结构完整存在;0.5% SDS 48 h组神经束间脂肪(红色)结构破坏,未见明显减少;0.5%SDS 48 h + scCO2组神经束间脂肪(红色)结构破坏,且明显减少(图4)。
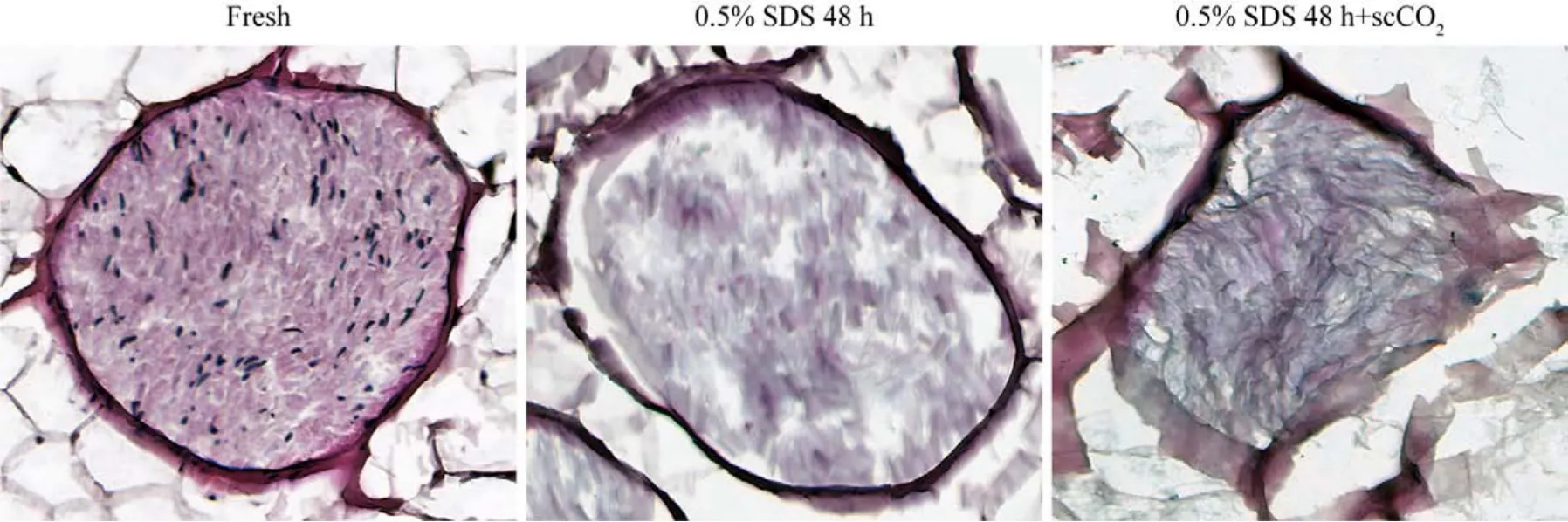
图2 三组神经修复材料的HE染色Fig.2 HE staining of nerve repair material in the three groups
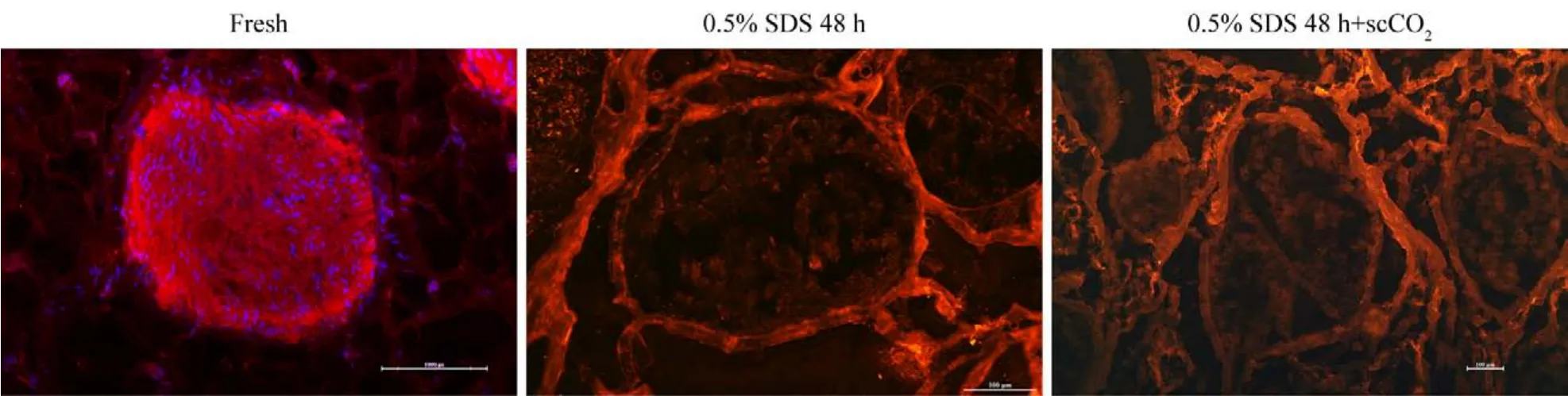
图3 神经修复材料的Laminin(红色)/DAPI(蓝色)染色Fig.3 Laminin (red) / DAPI (blue) staining of nerve repair material
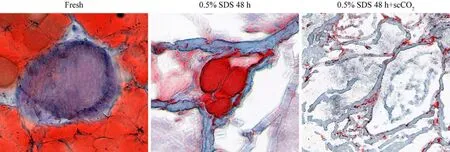
图4 三组神经修复材料的油红O脂肪染色Fig.4 Oil red O staining images of nerve repair material in the three groups
3 神经修复材料的DNA含量测定 0.5% SDS处理新鲜猪坐骨神经48 h后,DNA含量下降(706.7 ng/mg降至59.6 ng/mg,P<0.01),scCO2萃取后DNA含量下降(59.6 ng/mg降至49.2 ng/mg,P<0.05)。见图5。
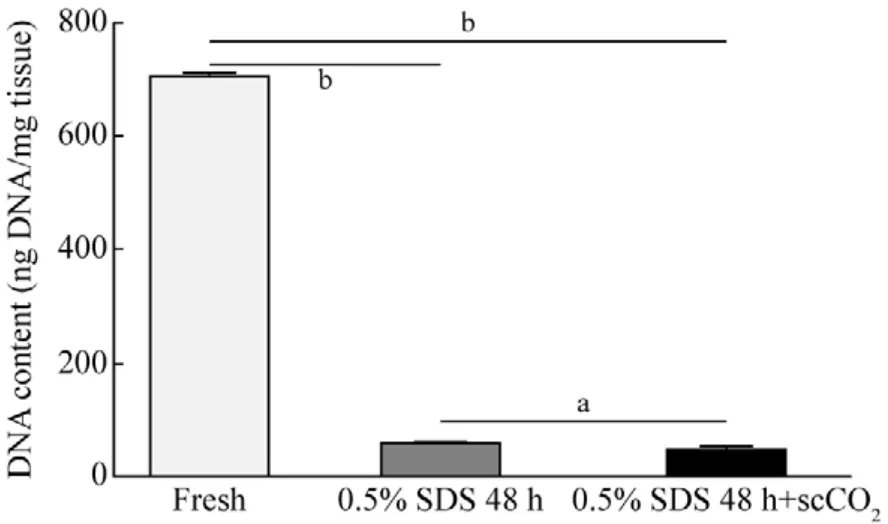
图5 0.5% SDS及scCO2处理后移植物的DNA含量比较(aP <0.05;bP < 0.01)Fig.5 Comparison of DNA content levels of the grafts after treatment between 0.5% SDS group and scCO2 group(aP < 0.05; bP < 0.01)
4 新型细胞外基质源性神经修复材料的扫描电镜观察 对各组神经修复材料内部分别行扫描电镜观察,可见新鲜组完整的神经内膜管状结构及其包绕的髓鞘和轴突;0.5% SDS 48 h组和0.5% SDS 48 h + scCO2组均未见髓鞘和轴突,均有完整的神经内膜管状结构。0.5% SDS 48 h组与0.5% SDS 48 h + scCO2组间扫描电镜观察未见明显区别。见图6。
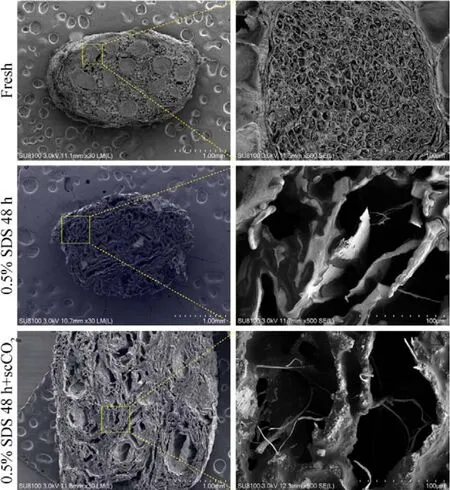
图6 扫描电镜观察三组神经修复材料的内部结构Fig.6 The internal structure of nerves in the three groups was observed by scanning electron microscope
讨 论
周围神经损伤及缺损是临床常见病、多发病。目前长段周围神经缺损的最佳治疗方法是自体神经移植[1]。异种去细胞神经基质以其易获取、低免疫原性等优点,成为替代自体神经移植的一
种选择[4]。异种移植免疫反应主要取决于髓鞘、轴突和脂肪的存在,从而抑制移植物再生[5]。
传统异种去细胞神经基质修复材料的制备方法如下。1)反复冻融:生物组织极易在反复降温、复温过程中受损伤(溶液冻结、融化及溶液渗透压力变化等因素造成),这种低温损伤主要发生在0℃ ~ - 60℃范围内,因此可以使生物组织反复通过该温度范围,破坏组织中的相容性抗原成分,从而降低其抗原性;2)化学洗涤:利用化学试剂去除生物组织中的细胞、可溶性糖胺和可溶性蛋白质等抗原物质,从而减弱其抗原性;3)核酸酶降解(如DNase和RNase):通过水解磷酸二酯键分割核酸序列,使DNA和RNA被特异性降解,有利于从组织中清除[6-8]。但反复冻融会破坏细胞结构而不是实际去除细胞,同时会在一定程度上破坏神经基底膜管结构;去细胞化学试剂具有一定的化学毒性;核酸酶难以从组织中彻底清除,可能引起免疫反应[15]。除了上述问题,传统制备方法对神经移植物内部脂肪的去除并不理想,从而抑制移植物再生。
近几年,scCO2萃取脂肪以其高效、安全和环保等优点,开始逐步应用于动植物组织且效果显著[16-17]。scCO2萃取使用处于临界压力和临界温度以上的二氧化碳流体作为萃取剂,从动植物组织中提取脂肪成分,再通过减压、升温等方式,达到分离提纯的目的。与传统化学萃取法相比,scCO2萃取有以下显著优点。1)更高效:当饱含溶解物的二氧化碳流体流经分离器时,由于压力下降使CO2与萃取物迅速产生气液分离,萃取效率更高;2)更安全环保:CO2是惰性气体,萃取过程不发生化学反应,且属于不燃性气体,无味、无臭、无毒;相对传统萃取方式,scCO2萃取后不含残留酶,不含残留的有害溶剂,更安全更环保[18]。
本实验将传统神经修复材料制备方法与scCO2萃取结合,制备新型神经修复材料。大体观察,本实验处理后的各组神经,直径稍增大、长度稍缩短(图1);HE染色、Laminin/DAPI染色和扫描电镜显示,既清除了髓鞘和轴突,又保留了层粘连蛋白和神经内膜管状结构等有效成分和结构(图2、图3、图6),为移植物再生提供了必要的物质和结构基础。此外,本实验制备的神经修复材料有以下两方面特点:1)油红O脂肪染色显示,scCO2萃取有效破坏神经束间的脂肪结构,去脂效果明显(图4);scCO2萃取脂肪,进一步减轻免疫反应;2)去脂的同时,scCO2对去细胞有一定效果,经scCO2萃取DNA含量从59.6 ng/mg降至49.2 ng/mg(P<0.05)(图5),达到安全标准(<50 ng/mg)[12]。
本修复材料需进一步力学检测、生物安全性及体内体外评价,以确认达到产品临床标准,为下一步进入临床应用提供安全性指标。
综上所述,新型细胞外基质源性神经修复材料的制备方法相比传统方法,去脂更彻底、更安全、更环保,进一步减弱免疫反应,从而更有效促进移植物再生。
2鲁长风. 创伤性神经瘤组织微粒构建的组织工程神经移植物原位修复神经缺损的研究[D]. 北京:解放军医学院,2018.
4孙逊. 马尾神经细胞外基质修复大鼠坐骨神经缺损的实验研究[D]. 天津:南开大学,2015.
