地舒单抗对人脐带间充质干细胞增殖及成骨分化的作用研究
2022-07-05刘修志孟昊业赵金娟林万程管延军许文静
刘修志,孟昊业,赵金娟,王 鹏,林万程,王 恺,管延军,张 健,许文静,彭 江
1 解放军医学院,北京 100853;2 解放军总医院 全军骨科战创伤重点实验室,骨科再生医学北京市重点实验室,北京 100853
股骨头骨坏死(osteonecrosis of the femoral head,ONFH)是由多种原因导致股骨头结构破坏和塌陷而造成关节疼痛和功能障碍的临床难治性疾病[1-3]。通过调节骨代谢以减少破骨、增加成骨是治疗早期ONFH的一个方向。地舒单抗是一种全人源化的RANKL抑制剂,通过抑制RANKL可抑制破骨细胞的功能,减少骨吸收,增加骨密度[4-5]。地舒单抗在临床上还用于骨巨细胞瘤等肿瘤的治疗,但对ONFH的作用尚未见报道。干细胞具有自我更新和形成分化细胞的能力,是再生治疗过程中重要的种子细胞。1993年Hernigou等首次利用自体间充质干细胞联合标准髓心减压(core decompression,CD)治疗ONFH[6]。近年来干细胞疗法成为治疗ONFH的热点。目前用于ONFH治疗的干细胞包括骨髓间充质干细胞、脂肪干细胞、外周血干细胞等[7-9]。与其他来源的间充质干细胞相比,人脐带来源间充质干细胞(human umbilical cord mesenchymal stem cells,hUC-MSCs)具有获取方便、获取率高、多次传代后均一性好等优点[8,10-11]。因此,本研究培养hUC-MSCs,通过体外实验研究地舒单抗对hUC-MSCs的增殖和成骨分化的影响,进一步探索两者的联合应用在ONFH模型中的作用,以期为临床治疗ONFH提供新思路。
材料与方法
1 主要材料与试剂 地舒单抗注射液(Prolia,60 mg/mL),原代hUC-MSCs(中盛溯源股份有限公司,中国),DMEM/F12培养基(Gibco,美国),PBS缓冲液(Hyclone,美国),胰酶、油红O染液(Sigma,美国),胎牛血清(四季青,中国),成骨分化诱导液、成脂分化诱导液、成软骨分化诱导液(赛业,中国),4%多聚甲醛(索莱宝,中国),茜素红染色试剂盒、碱性磷酸酶(alkaline phosphatase,ALP)染色试剂盒、CCK-8试剂盒(碧云天,中国),CD34-PE (BioLegend,343607),CD45-PE(BioLegend,368511),CD73-PE (Abcam,Ab155378),CD90-PE(BioLegend,328113),CD105-PE(BioLegend,323207);流式细胞仪(BD FACSCalibur,美国)。
2 hUC-MSCs的培养及鉴定 复苏原代hUC-MSCs。hUC-MSCs在含10%胎牛血清和100 U/mL青霉素/链霉素的DMEM/F12中培养,在37℃、5% CO2培养箱中培养扩增。每2 d进行换液,当细胞达到80%融合时,用胰酶消化、离心并按照1∶3比例传代培养。取生长状态良好的P3细胞进行后续实验。对hUC-MSCs进行细胞计数,调整细胞密度为1.0 × 106/mL,进行流式细胞分析,所用的抗体为CD34-PE、CD45-PE、CD73-PE、CD90-PE和CD105-PE。为进一步检验hUC-MSCs的干细胞特性,分别进行成骨、成脂、成软骨诱导分化。分化完成后,成骨细胞用茜素红染色,脂肪细胞用油红O染色,软骨细胞用阿利新蓝染色。
3 药物配置及分组 根据地舒单抗生理浓度,将地舒单抗用hUC-MSCs成骨诱导培养基稀释为不同浓度梯度(0.6 mg/mL、0.06 mg/mL、0.006 mg/mL),未加药物的hUC-MSCs成骨诱导培养基为对照组。
4 CCK-8检测地舒单抗对人脐带间充质干细胞的增殖作用 对第3代hUC-MSCs进行细胞计数,用hUC-MSCs成骨诱导培养基稀释为5.0 × 104/mL的单细胞悬液,各取100 µL接种于96孔板,在5% CO2、37℃条件下培养24 h。每2 d进行换液,待细胞贴壁后,分别更换为地舒单抗浓度为0.6 mg/mL、0.06 mg/mL、0.006 mg/mL的hUCMSCs成骨诱导培养基继续培养,对照组用等量不含地舒单抗的成骨诱导培养基培养。按试剂盒说明书,在第1/3天时进行CCK-8实验,使用酶标仪测定450 nm处的吸光度。
5 ALP染色观察地舒单抗对hUC-MSCs的成骨作用 对第3代hUC-MSCs进行细胞计数,用hUC-MSCs成骨诱导培养基稀释为5.0 × 104/mL的单细胞悬液,各取2 mL接种于6孔板培养,每2 d进行换液,待细胞贴壁后,分别更换为地舒单抗浓度为0.6 mg/mL、0.06 mg/mL、0.006 mg/mL的hUC-MSCs成骨诱导培养基培养,对照组用等量不含地舒单抗的成骨诱导培养基培养,每3 d更换新鲜成骨诱导培养基。7 d后吸出培养基,PBS清洗2次,4%多聚甲醛固定15 min,再次用PBS清洗2次,然后按ALP染色试剂盒说明书进行染色,PBS缓冲液冲洗后拍照。
6 茜素红染色观察地舒单抗对hUC-MSCs的成骨作用 对第3代hUC-MSCs进行细胞计数,用hUC-MSCs成骨诱导培养基稀释为5.0 × 104/mL的单细胞悬液,各取2 mL接种于6孔板培养,每2 d进行换液,待细胞贴壁后,分别更换为地舒单抗浓度为0.6 mg/mL、0.06 mg/mL、0.006 mg/mL的hUC-MSCs成骨诱导培养基培养,对照组用等量不含地舒单抗的成骨诱导培养基培养。培养14 d后吸出培养基,用PBS清洗2次,4%多聚甲醛固定15 min,再次用PBS清洗2次,按照茜素红试剂盒配制染液,用PBS冲洗后拍照。
7 实时荧光定量聚合酶链反应检测地舒单抗对hUC-MSCs成骨基因表达的作用 对第3代hUCMSCs进行细胞计数,用hUC-MSCs成骨诱导培养基稀释为5.0 × 104/mL的单细胞悬液,各取2 mL接种于6孔板培养,每2 d进行换液,待细胞贴壁后,分别更换为地舒单抗浓度为0.6 mg/mL、0.06 mg/mL、0.006 mg/mL的hUC-MSCs成骨诱导培养基培养,对照组用等量不含地舒单抗的成骨诱导培养基培养。作用7 d后,吸去孔板中培养基,PBS清洗2次,加入裂解液500 µL,5 min后收集各样本于无酶EP管,按照Takara Total RNA提取试剂盒提取总RNA。使用核酸蛋白分析仪检测A260nm/A280nm的比值和RNA含量确定其纯度。再按照PrimeScriptTMRT reagent Kit with gDNA Eraser说明进行反转录,通过所得cDNA完成PCR反应。最后用2-ΔΔCT统计学方法分析结果。基因引物序列见表1。

表1 成骨相关基因引物序列Tab. 1 Primer sequences of osteogenesis related gene
据以±s表示,使用SPSS19.0统计软件进行统计
8 统计学方法 以上所有的实验均重复3次,数分析,各组间采用单因素方差分析法,两两比较采用LSD检验,若方差不齐则采用秩和检验。P<0.05为差异有统计学意义。
结 果
1 hUC-MSCs的生物学特点 流式细胞检测结果显示 hUC-MSCs 高表达干细胞标志物HLA-DR、CD90、CD73和CD105,同时低表达CD34和CD45(图1A)。对原代hUC-MSCs进行培养,可见细胞生长良好,形态呈双极长梭形或类似于成纤维细胞的扁平形(图1B)。以上结果表明,本实验培养的hUC-MSCs具有良好的细胞活性,并且具有较高的纯度,符合实验要求。通过成骨、成脂和成软骨诱导分化,分别运用特异性茜素红染色(图1C)、油红O染色(图1D)和阿立辛蓝染色(图1E)证实本实验分离培养的细胞确实为hUC-MSCs,细胞状态良好且具有良好的分化潜能。
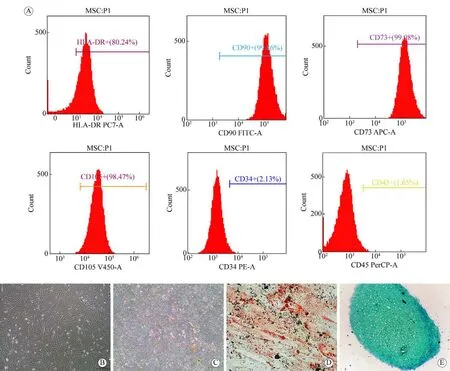
图1 hUC-MSCs的生物学特点A:流式细胞结果显示,hUC-MSCs高表达干细胞标志物HLA-DR、CD90、CD73、CD105,同时低表达CD34和CD45;B:hUC-MSCs形态呈双极长梭形或类似于成纤维细胞的扁平形;C:成骨分化茜素红染色可见成骨结节;D:成脂分化油红O染色可见脂滴空泡;E:成软骨分化阿利新蓝染色Fig.1 Biological characteristics of hUC-MSCs A: HUC-MSCs were bipolar fusiform or flattened similar to fibroblasts; B: Flow cytometry results showed that hUC-MSCs had high expression of stem cell markers HLA-DR,CD90, CD73, and CD105, while low expression of CD34 and CD45; C: The alizarin red stain for osteogenic differentiation showed osteogenic nodules; D: Lipogenic differentiation oil red O staining showed lipid droplet vacuole;E: Chondrogenic differentiation by Alcian blue staining
2 地舒单抗对hUC-MSCs增殖的作用 CCK-8检测结果显示:第1天,与空白对照组相比,0.006 mg/mL的地舒单抗促进hUC-MSCs的增殖(P<0.05);第3天,不同浓度(0.6 mg/mL、0.06 mg/mL、0.006 mg/mL)的地舒单抗均可促进hUC-MSCs的增殖,且与对照组比较均有统计学差异(P<0.05)。见图2。
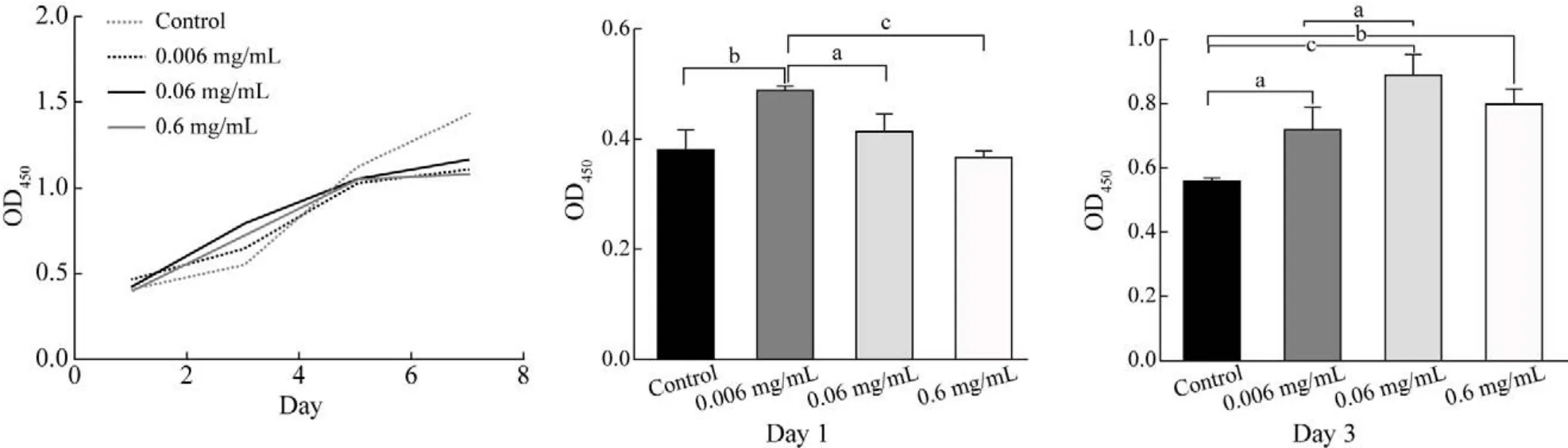
图2 不同浓度地舒单抗对hUC-MSCs的增殖作用(aP<0.05,bP<0.01,cP<0.001)Fig.2 Effect of different concentrations of denosumab on proliferation of hUC-MSCs (aP<0.05, bP<0.01, cP<0.001)
3 地舒单抗对hUC-MSCs生成ALP的作用 ALP染色结果显示,各组hUC-MSCs呈深染蓝色颗粒,ALP染色呈阳性。当地舒单抗浓度为0.006 mol/L时,与对照组相比,ALP染色加深。随着地舒单抗浓度的增加,ALP染色变浅。见图3。
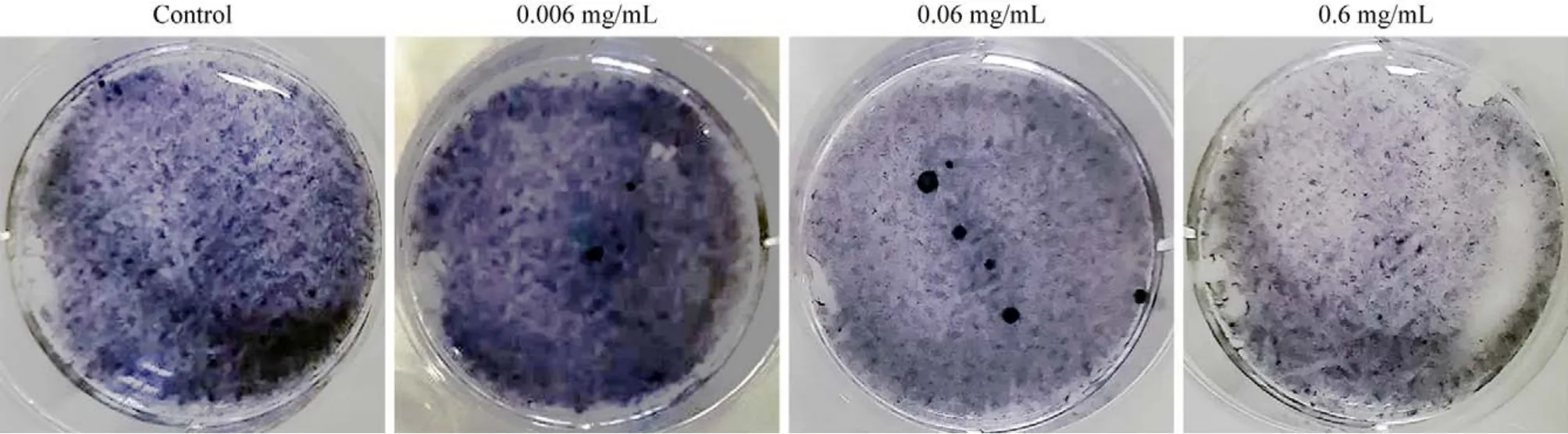
图3 碱性磷酸酶染色不同浓度地舒单抗对hUC-MSCs成骨分化的作用Fig.3 Effects of different concentrations of denosumab on osteogenic differentiation of hUC-MSCs by alkaline phosphatase staining
4 地舒单抗对hUC-MSCs形成钙结节的作用 茜素红染色结果显示,各组均可见红色结节。与对照组相比,地舒单抗的浓度为0.006 mg/mL时可见较多红色结节,随着地舒单抗的浓度增加,茜素红染色变浅。见图4。
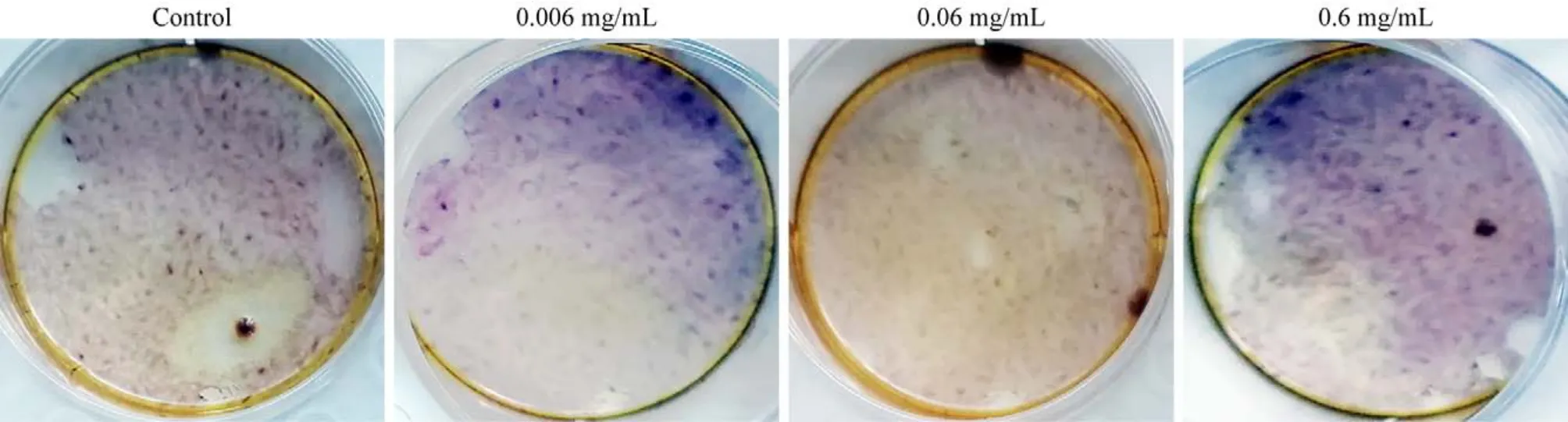
图4 茜素红染色不同浓度地舒单抗对hUC-MSCs成骨分化的影响Fig.4 Effects of different concentrations of denosumab on osteogenic differentiation of hUC-MSCs by alizarin red staining
5 地舒单抗对hUC-MSCs成骨相关基因表达的作用 qRT-PCR检测结果表明,0.006 mg/mL的地舒单抗能促进hUC-MSCs成骨相关基因的表达,
与对照组比较有统计学差异(P<0.05)。0.06 mg/mL和0.6 mg/mL的地舒单抗抑制成骨相关基因的表达,且抑制作用呈浓度依赖性。见图5。
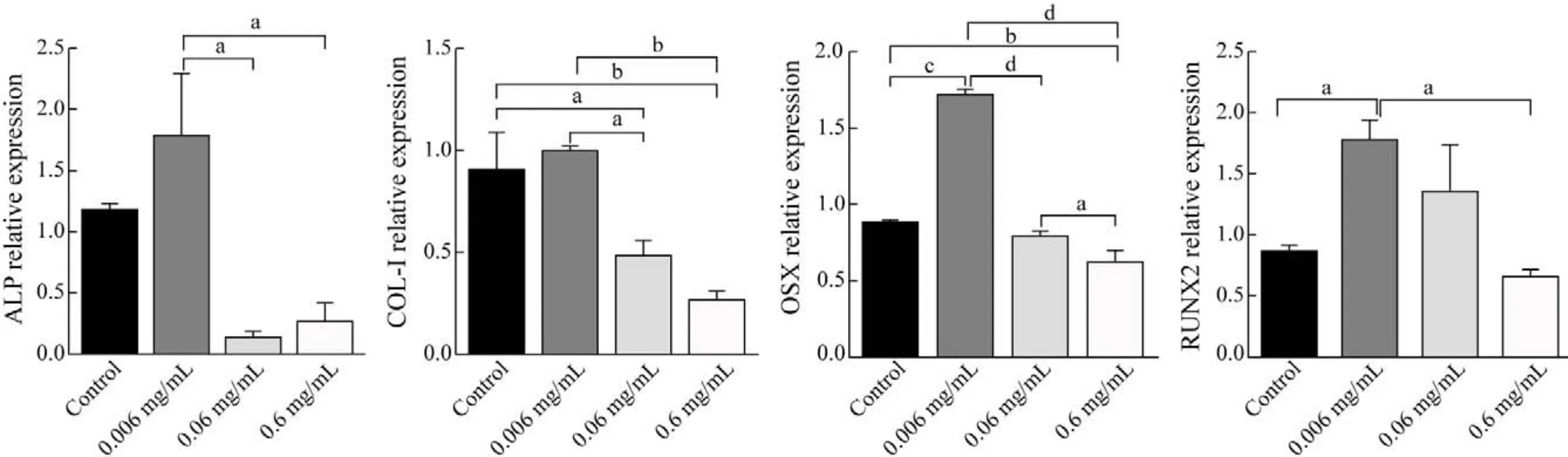
图5 qRT-PCR检测地舒单抗对hUC-MSCs成骨相关基因表达的影响(aP<0.05,bP<0.01,cP<0.001,dP<0.000 1)Fig.5 Effects of denosumab on osteogenic gene expression of hUC-MSCs detected by QRT-PCR (aP<0.05, bP<0.01, cP<0.001, dP<0.000 1)
讨 论
股骨头骨坏死发生后,骨转换失衡,破骨细胞功能增强,导致骨质破坏和骨量减低,同时研究发现坏死区域骨髓间充质干细胞成骨分化能力降低[12]。因此,抑制破骨细胞活性和促进成骨细胞分化成为治疗股骨头骨坏死的策略。地舒单抗作为全人源化的RANKL抑制剂,可以抑制破骨细胞功能的发挥,增加整个骨骼部位的骨密度,且能最大限度地发挥抗骨吸收的作用[13]。间充质干细胞具有多向分化潜能,当组织受到损伤时,具有促进血管生成和成骨分化的能力,从而使受损的组织修复再生[14-15]。
本研究的主要目的是探讨地舒单抗对hUCMSCs增殖及成骨分化的影响。间充质干细胞可以分化为成骨细胞,这对骨转换来说是必需的[16]。本实验使用的hUC-MSCs经流式细胞鉴定,具备干细胞的特点,高表达干细胞标志物HLA-DR、CD90、CD73和CD105,同时低表达CD34和CD45,可分化为成骨细胞、软骨细胞和脂肪细胞。
通过CCK-8检测法发现:第3天,不同浓度的地舒单抗均能促进hUC-MSCs的增殖,当浓度为0.06 mg/mL时,促进增殖的效果最明显。随着时间的延长,高浓度(0.6 mg/mL)的地舒单抗促进增殖的效果减弱。在茜素红染色中,0.006 mg/mL地舒单抗形成的钙结节与对照组相比显著增加,随着浓度的增加,形成的钙结节减少,染色变浅。ALP染色发现,0.006 mg/mL的地舒单抗与对照组相比染色更深,随着浓度的增加,染色变浅。这些结果表明0.006 mg/mL地舒单抗能够促进hUC-MSCs的成骨分化。ALP、OSX、COL-Ⅰ、RUNX-2是成骨分化的重要标志物,当地舒单抗浓度为0.006 mg/mL时能促进ALP、OSX、COL-Ⅰ、RUNX-2的表达。可见,在hUC-MSCs成骨分化的过程中,一定浓度的地舒单抗能促进其成骨分化。
Mosch等[17]研究发现高浓度的地舒单抗对间充质干细胞具有毒性作用,低浓度的地舒单抗可促进间充质干细胞的成骨分化,与我们的研究结果相似。RANKL被认为是间充质干细胞成熟的影响因素。Schena等[18]认为RANKL通过与间充质干细胞上的受体RANK相互作用而产生自分泌/旁分泌作用;在RANKL敲除的小鼠模型中,与野生型相比,间充质干细胞的成骨分化潜能降低。本研究发现低浓度的地舒单抗可以促进hUCMSCs的成骨分化,高浓度的地舒单抗降低了人脐带间充质干细胞的成骨分化能力,表明地舒单抗具有受体和剂量依赖性。
本研究从hUC-MSCs的增殖和成骨方面揭示了地舒单抗的作用,为进一步探究地舒单抗和hUC-MSCs联合应用于ONFH治疗中的作用奠定了一定的基础,但同时本实验对地舒单抗影响hUC-MSCs成骨分化的机制缺乏深入的探讨,需要进一步研究。
