探讨半夏-薏苡仁对PCPA失眠模型大鼠海马食欲素及其受体和血清细胞因子的调控作用
2022-07-05王学林谌盈帆李绍旦杨明会
王 亮,王学林,王 鹏,李 晨,谌盈帆,陈 旸,张 印,李绍旦,杨明会
1 解放军医学院,北京 100853;2 解放军总医院第六医学中心 中医医学部,北京 100089
失眠症以无法入睡、睡眠不足和睡眠质量差为特征,至20世纪初全球有9% ~ 15%的成人有失眠症状[1-2]。目前,失眠症的发病机制尚不明确,镇静催眠药物存在头晕、乏力、戒断反应、宿醉等局限性[3-5]。中医治疗失眠症历史悠久,且部分方剂的镇静催眠作用已被循证医学所证实[6]。半夏秫米汤被称为治疗失眠症“第一方”,其中半夏通过燥湿化痰、通阴运阳来治疗失眠症,秫米可用薏苡仁替代,通过健脾祛湿、调和阴阳来调节睡眠[7]。药理学研究发现半夏和薏苡仁主要化合物包括黄芩素、β-谷甾醇、豆甾醇等[8]。研究表明半夏秫米汤(包括半夏、秫米)加减可有效改善失眠症患者的睡眠质量,具有良好的安神助眠作用[9-10]。另有研究显示海马CA1神经元损伤与睡眠障碍等疾病相关[11]。食欲素(Orexin)可通过调节其受体来影响海马神经元细胞凋亡[12-13]。半夏-薏苡仁治疗失眠症的作用机制鲜有报道。本研究旨在基于海马Orexin介导的神经元细胞凋亡途径,探讨半夏-薏苡仁(BX-YYR)治疗失眠症的具体作用机制。
材料与方法
1 实验动物 5周龄SPF级Wistar雄性大鼠90只,体质量(160±10) g,购自斯贝福(北京)生物技术有限公司[动物合格证:SCXK(京)2019-0010]。实验过程中,大鼠接受标准实验室食物,适应环境温度(25±2)℃、相对湿度50%±5%,12 h/12 h明暗循环,持续1周。本实验经解放军总医院动物伦理委员会批准(2020-X16-102)。
2 主要仪器和试剂 地西泮片(北京益民药业有限公司,批号:H11020898);半夏(安徽普仁药业有限公司,批号2107158)和薏苡仁(北京绿野药业公司,批号20082401)由解放军总医院第一医学中心中药房提供并鉴定;PCPA (美国Sigma公司,批号1003164450);戊巴比妥钠(美国Sigma公司);4%多聚甲醛(北京索莱宝科技有限公司);RIPA buffer总蛋白提取液、SG高纯总RNA提取试剂盒、白细胞介素-6(interleukin-1,IL-6)酶联免疫试剂盒(SG3066-96T)、IL-1β酶联免疫试剂盒(SG2923-96T)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)酶联免疫试剂盒(SG3056-96T)、IL-2酶联免疫试剂盒(SG3068-96T)和Orexin酶联免疫试剂盒(SG3178-96T)由北京信诺金达生物科技有限公司提供;Orexin Receptor 1 Polyclonal Antibody(美 国ProteinTech公 司);Rabbit Anti-Orexin Receptor 2 antibody (中 国Bioss公 司);OX1R、OX2R引物和探针(美国Sangon公司);电泳槽JY-SPFT、电泳仪JY300C、凝胶成像系统JY04S-3C(北京君意东方电泳设备有限公司);分光光度计 (德国Eppendorf公司);定量PCR检测仪StepOnePLUS (美国Applied Biosystems公司)。
3 失眠大鼠造模和分组处理 75只造模大鼠根据文献采用PCPA诱导失眠大鼠模型,腹腔注射PCPA(300 mg/kg),1次/d,持续2 d[14]。在第2次腹腔注射PCPA 28 h后,观察到失眠大鼠模型出现昼夜节律消失,白天持续活动不断,兴奋性和攻击性增加,食欲下降,毛发暗淡和蓬乱。造模成功后将模型大鼠按随机数字表法分为5组,每组15只,分别为模型组(M组)、地西泮组(D组)和BX-YYR低剂量组(ZL组)、中剂量组(ZM组)、高剂量组(ZH组)。正常组(N组)和M组均按10 mL/kg给予0.9%氯化钠注射液灌胃。D组配置成0.83 mg/10 mL地西泮水溶液。半夏-薏苡仁(1∶2)按照常规方法代煎,分别浓缩至1.575 g/kg(ZL组)、3.15 g/kg(ZM组)和6.3 g/kg(ZH组)生药浓度。各组均按10 mL/kg进行灌胃,共7 d。
4 实验取材 取材前大鼠禁食12 h。腹腔注射3%戊巴比妥钠(30 mg/kg)麻醉,腹主动脉取血,3 h内离心并分离出血清。冰上解剖大鼠脑组织,立即在液氮中冷冻,-80℃下保存待测;另一部分用4%多聚甲醛固定脑组织,4℃避光保存待测。
5 行为学测试 戊巴比妥钠翻正实验:造模组随机选15只大鼠和正常组15只大鼠以35 mg/kg戊巴比妥钠腹腔注射,统计睡眠潜伏期与睡眠持续时间[15]。旷场实验:第7天灌胃结束12 h后采用行为学软件分析各组大鼠5 min内的总活动距离、进入中央格距离和修饰次数。整个行为学实验过程中保持安静,并及时清理旷场箱。
6 脑组织HE染色 脑冠状位切片厚度3 µm,烘烤,脱蜡,蒸馏水冲洗1 min。入苏木素染色液中浸染5 min,蒸馏水稍洗,盐酸乙醇分色,水洗,蒸馏水返蓝,入梯度乙醇脱水,二甲苯透明,加盖玻片,中性树胶封片。
7 免疫组化观察海马Bcl-2表达 脑组织石蜡切片脱蜡水化,严格按照DBA试剂盒说明书操作。具体步骤:3% H2O2封闭10 min,5% BSA封闭30 min。一抗4℃孵育过夜,二抗室温孵育30 min,DBA显色。光学显微镜观察海马病理变化,Image J 6.0软件对海马进行半定量分析(100×)。
8 ELISA法检测血清细胞因子和海马Orexin 取血清和海马组织匀浆,液氮研磨后,加PBS,离心,取上清备用。按照ELISA试剂盒说明书检测IL-6、IL-1β、TNF-α、IL-2和Orexin水平,酶标仪测定各孔在450 nm处测吸光度值。
9 RT-PCR法检测海马OX1R和OX2R mRNA表达 在95℃下进行6 min变性,40个循环变性(95℃下30 s)、退火(50℃ ~ 55℃下1.5 min)和延伸(72℃下90 s)。所有实验重复三次。以ACTB为内参基因,用2-△△Ct方法计算基因相对mRNA表达。见表1。
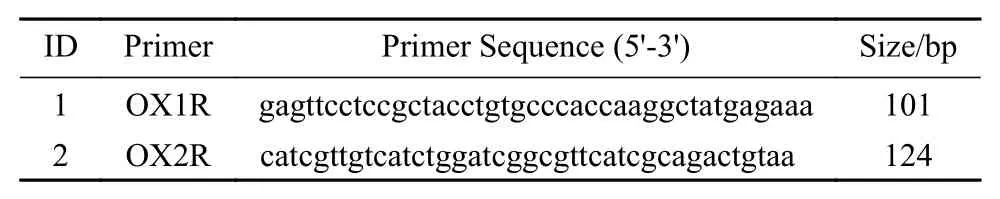
表1 RT-PCR引物序列Tab. 1 List of RT-PCR primers
10 Western blot法检测海马OX1R和OX2R蛋白表达 取约20 mg海马组织,加入200 µL RIPA buffer,提取总蛋白。SDS-PAGE浓缩胶4%,分离胶12%,电泳,转膜2 h。在常温下封闭2 h,加入一抗室温1 h,TBST洗涤3次,每次10 min。二抗孵育1 h,TBST洗涤2次,最后TBS洗1次,每次10 min,然后暗室曝光检测,采用Image J 6.0软件分析条带灰度。
11 统计学分析 采用SPSS22.0和Graphpad Prism 8.0.2软件进行数据分析,统计结果以±s表示,组间比较采用单因素方差分析,两两比较用LSD-t检验,P<0.05为差异有统计学意义。
结 果
1 造模情况 与N组比较,造模组大鼠睡眠潜伏期显著延长(P<0.01),造模组大鼠睡眠持续时间显著缩短(P<0.01),证明PCPA失眠大鼠造模成功。见表2。

表2 戊巴比妥钠翻正实验(n=15)Tab. 2 Pentobarbital sodium correction test (n=15)
2 行为学比较 与N组比较,M组和ZL组大鼠活动总距离显著降低(P均<0.01);与M组比较,ZM组和ZH组的总活动距离显著增加(P均<0.01);与D组比较,ZM组活动总距离显著增加(P<0.01)。与N组比较,M组、D组、ZL组和ZM组大鼠活动进入中央格距离显著增加(P均<0.01);与M组比较,D组、ZL组、ZM组和ZH组大鼠活动进入中央格距离显著增加(P均<0.01);与D组比较,ZH组大鼠活动进入中央格距离减少(P<0.05)。与N组比较,M组大鼠修饰次数显著增加(P<0.01);与M组比较,D组、ZL组、ZM组和ZH组大鼠修饰次数显著减少(P均<0.05)。见表3、图1。
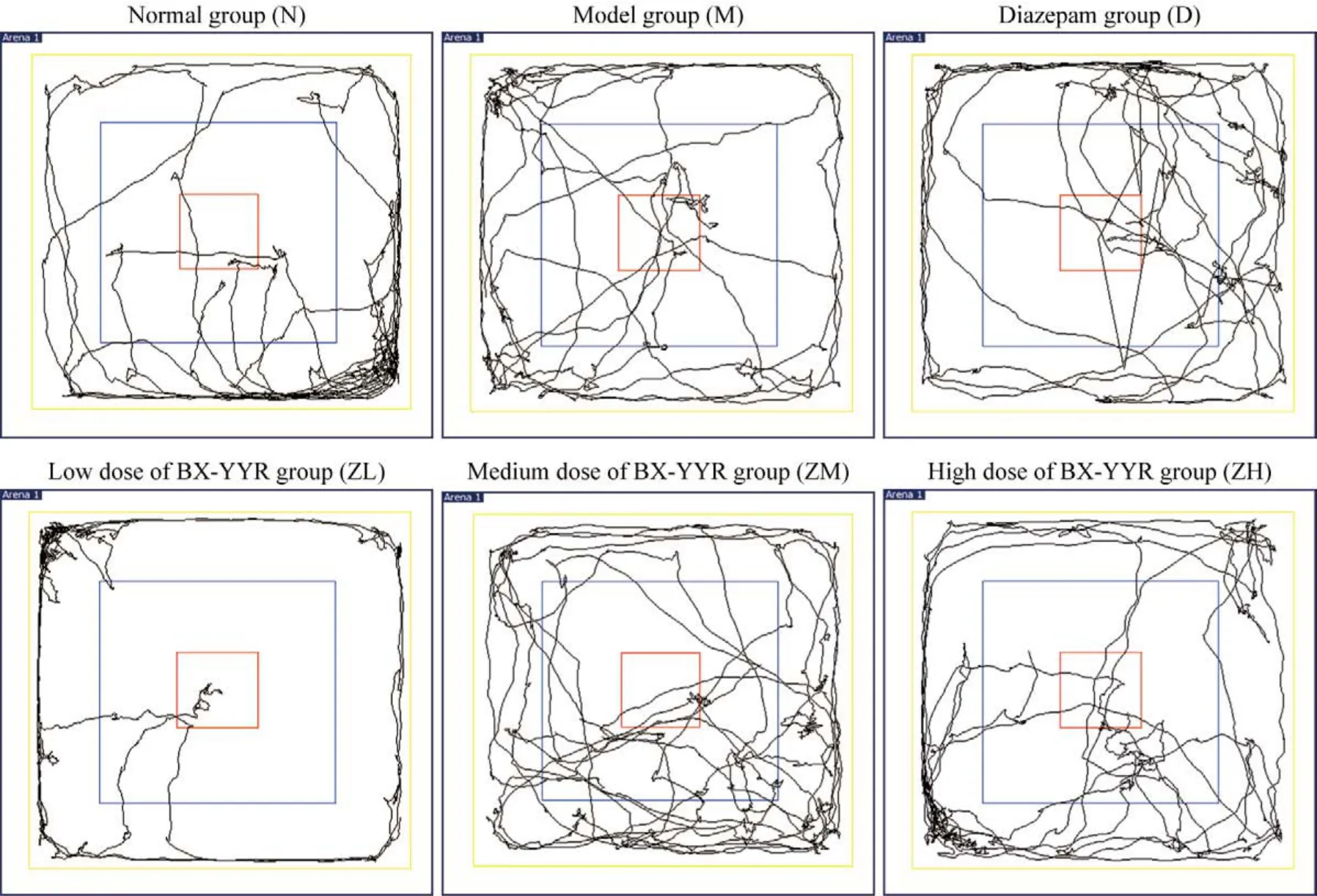
图1 每组大鼠运动轨迹平面图Fig.1 Plane diagram of the rat movement track in each group
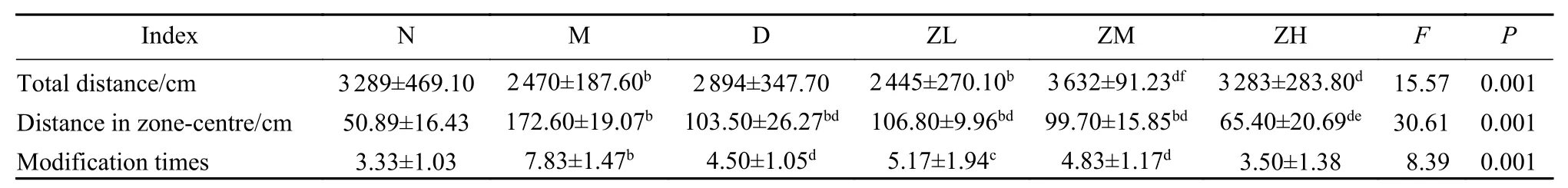
表3 各组大鼠旷场实验行为学比较(n=15)Tab. 3 Behavioral comparison of rat open field experiment in each group (n=15)
3 各组大鼠海马CA1区神经元病理变化 M组:海马CA1区神经元形态与结构损伤比较严重,细胞层次变少,排列比较紊乱,分布不均匀,细胞间隙增大,存活细胞数目减少,细胞体皱缩变小,胞核固缩而深染,形状不规则。D组:与M组相比,海马CA1区神经元形态和结构损害相对减轻,细胞排列稍紊乱,层次增多,存活细胞数目增多,有少量细胞皱缩。ZL、ZM和ZH组:与M组相比,海马CA1区神经元形态和结构损害相对减轻,细胞排列较规整,存活细胞数目增多,细胞体皱缩变小,细胞形状规则。见图2。
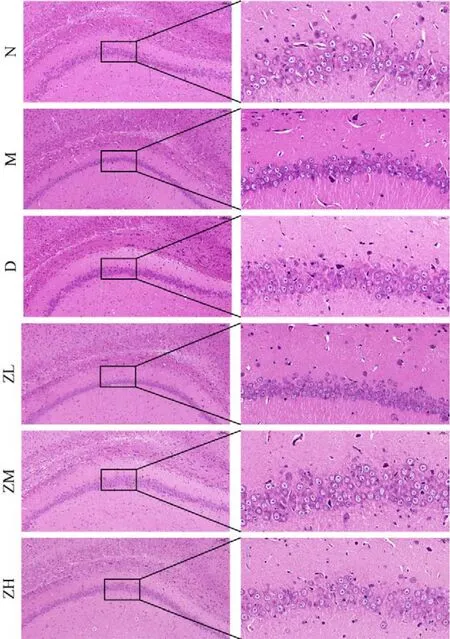
图2 各组大鼠海马CA1区神经元病理变化Fig.2 Neuronal pathological changes of the rats hippocampus CA1 region in each group
4 免疫组化观察各组大鼠脑组织海马CA1区Bcl-2阳性信号面积 与N组比较,M组和ZL组大鼠海马Bcl-2阳性信号面积占比显著降低(P均<0.05)。与M组比较,ZH组大鼠海马Bcl-2阳性信号面积占比升高(P<0.01)。见表4、图3。

图3 各组大鼠海马CA1区Bcl-2阳性信号面积(免疫组化,100×)Fig.3 Hippocampal CA1 Bcl-2 positive signal area in each group(immunohistochemical map, 100×)

表4 各组大鼠海马CA1区Bcl-2阳性信号面积占比比较(n=15)Tab. 4 Comparison of hippocampal CA1 Bcl-2 positive signal area in each group (n=15)
5 血清L-6、TNF-α、IL-1β、IL-2表达 ELISA检测显示,与N组比较,M组大鼠血清TNF-α水平显著升高(P<0.01),ZM组大鼠血清TNF-α水平降低(P<0.05)。与M组比较,D组和ZL、ZM、ZH组大鼠血清TNF-α显著降低(P均<0.01)。与D组比较,ZL组大鼠血清TNF-α水平显著升高(P<0.01)。与N组比较,M组IL-1β水平显著升高(P<0.01),ZH组大鼠血清IL-1β水平降低(P<0.05)。与M组比较,D组和ZL、ZM、ZH组大鼠血清IL-1β水平显著降低(P均<0.01)。与D组比较,ZL、ZM、ZH组大鼠血清IL-1β水平降低(P均<0.05)。与N组比较,M组和ZL组大鼠血清IL-2水平显著升高(P均<0.01)。与M组比较,D组和ZL、ZM、ZH组大鼠血清IL-2水平显著降低(P均<0.05)。与D组比较,ZL组大鼠血清IL-2水平升高(P<0.01),与ZM、ZH组大鼠血清IL-2水平降低(P均<0.05)。与N组比较,D组和ZL组大鼠血清IL-6水平显著升高(P均<0.01)。与M组比较,D组和ZL、ZM、ZH组大鼠血清IL-6水平显著降低(P均<0.01)。与D组比较,ZL组大鼠血清IL-6水平升高(P<0.01)。见图4。
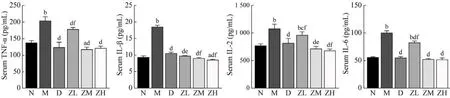
图4 各组大鼠血清TNF-α、IL-1β、IL-2、L-6水平(aP<0.05, bP<0.01, vs 正常组; cP<0.05, dP<0.01, vs 模型组; eP<0.05, fP<0.01, vs 地西泮组)Fig.4 The sera levels of TNF-α, IL-1β, IL-2 and L-6 in each group (aP<0.05, bP<0.01, vs N group; cP<0.05, dP<0.01, vs M group; eP<0.05,fP<0.01, vs D group)
6 血清和海马Orexin表达 ELISA检测显示,与N组比较,M组、ZL组大鼠血清Orexin水平显著升高(P均<0.01)。与M组比较,D组和ZM、ZH组大鼠血清Orexin水平显著降低(P均<0.01)。与D组比较,ZL组大鼠血清Orexin水平显著升高(P<0.01)。与N组比较,M组、D组和ZL组大鼠海马Orexin含量显著升高(P均<0.01),ZH组大鼠海马Orexin含量显著降低(P<0.01)。与M组比较,D组和ZL、ZM、ZH组大鼠海马Orexin含量显著降低(P均<0.01)。与D组比较,ZL组大鼠海马Orexin含量显著升高(P<0.01),ZM、ZH组大鼠海马Orexin含量降低(P均<0.05)。见图5。
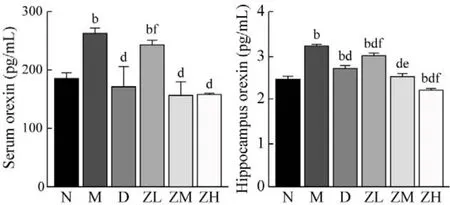
图5 各组大鼠血清和海马Orexin水平(bP<0.01, vs 正常组;dP<0.01, vs 模型组; eP<0.05, fP<0.01, vs 地西泮组)Fig.5 The Orexin levels in serum and hippocampus of each group(bP<0.01, vs N group; dP<0.01, vs M group; eP<0.05,fP<0.01, vs D group)
7 海马OX1R和OX2R mRNA表达 RT-PCR检测显示,与N组比较,M组海马OX1R mRNA表达升高(P<0.01)。与M组比较,D组、ZL、ZM、ZH组大鼠海马OX1R mRNA表达降低(P均<0.05)。与M组比较,ZL、ZM、ZH组大鼠海马OX2R mRNA表达降低(P均<0.05)。见图6。
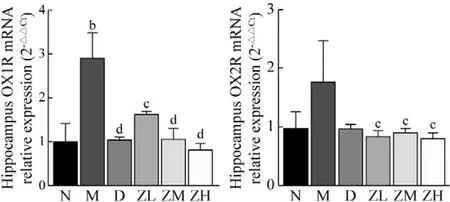
图6 各组大鼠海马OX1R和OX2R mRNA表达(bP<0.01, vs 正常组; cP<0.05, dP<0.01, vs 模型组)Fig.6 The mRNA expression level of hippocampus OX1R and OX2R in each group (bP<0.01, vs N group; cP<0.05,dP<0.01, vs M group)
8 海马OX1R和OX2R蛋白表达 与N组比较,D组大鼠海马OX1R表达升高(P<0.01),ZM组
和ZH组大鼠海马OX1R表达明显降低(P均<0.01)。与M组比较,ZL、ZM和ZH组大鼠海马OX1R表达降低(P均<0.01)。与D组比较,ZL、ZM和ZH组大鼠海马OX1R表达降低(P均<0.01)。与N组比较,M组和ZM、ZH组大鼠海马OX2R表达降低(P均<0.05)。与M组比较,D组和ZL组大鼠海马OX2R表达升高(P均<0.05)。与D组比较,ZL、ZM、ZH组大鼠海马OX2R表达降低(P均<0.05)。见图7。
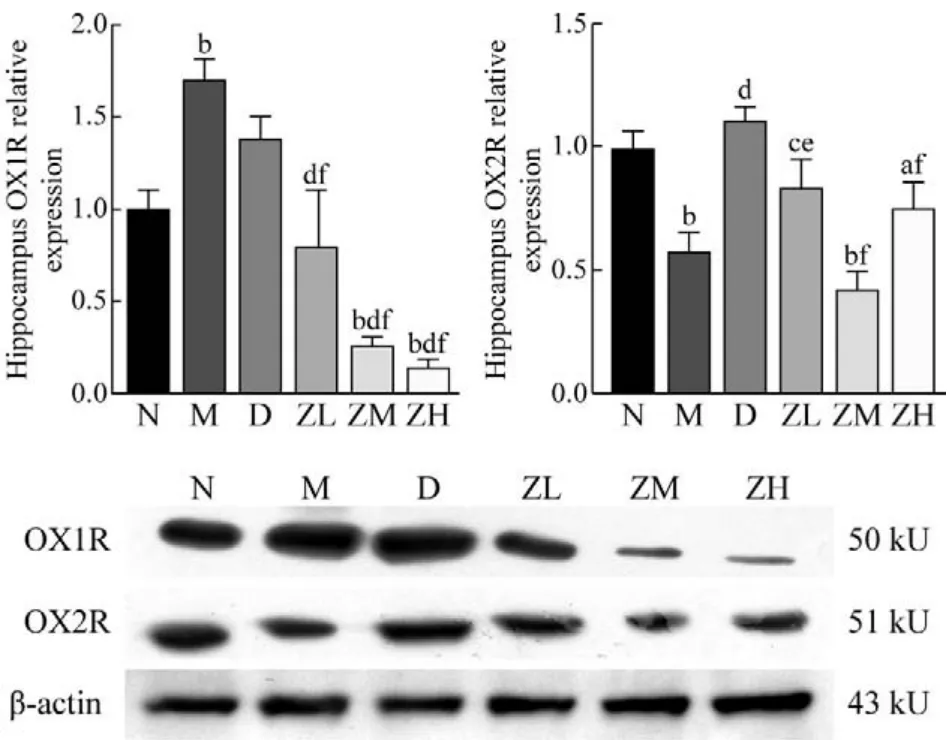
图7 各组大鼠海马OX1R和OX2R蛋白表达情况(aP<0.05,bP<0.01, vs 正常组; cP<0.05, dP<0.01, vs 模型组; eP<0.05,fP<0.01, vs 地西泮组)Fig.7 The protein expression level of hippocampus OX1R and OX2R in each group (aP<0.05, bP<0.01, vs N group;cP<0.05, dP<0.01, vs M group; eP<0.05, fP<0.01, vs D group)
讨 论
本研究选用半夏和薏苡仁治疗失眠症的思路源自中医经典古籍。《温病条辨》记载半夏秫米方中秫米可用薏苡仁替代,而半夏逐痰饮而和胃,薏苡仁能补阳明燥金之不及而渗其饮,饮退则胃和,寐可立至[16]。半夏与薏苡仁配伍体现一温一寒、滋脾和胃,两者合用治疗失眠症起到上下阴阳调和的作用[17]。现代药理学研究发现,半夏主要成分包括黄酮类、脂肪酸、甘油脂类、有机酸类等,具有抗炎、抗氧化、抗抑郁及镇静催眠作用[18-19]。薏苡仁含有大量三酰甘油类,其镇静安神作用与剂量呈正相关[20]。
本研究结果显示,戊巴比妥钠翻正实验中失眠模型组大鼠睡眠潜伏期显著延长,睡眠持续时间显著缩短;旷场实验中模型组大鼠5 min内总活动距离减少,进入中央格距离和修饰次数增加,说明模型大鼠对新环境的探究行为、焦虑和紧张度较高,半夏-薏苡仁在一定程度上缓解了这种情况。海马CA1区神经元病理变化显示造模组海马CA1区神经元形态与结构损伤比较严重,而BXYYR各剂量组能改善海马CA1区神经元结构。免疫组化显示,与M组比较,ZH组大鼠海马Bcl-2阳性信号面积占比升高。Bcl-2 是一种定位于线粒体膜的抑制细胞凋亡因子。研究发现硫化氢能通过减少凋亡细胞数量,激活Caspase-3、下调Bax表达、上调Bcl-2表达,起到预防睡眠剥夺(sleep deprivation,SD)引起海马损伤的作用[21]。研究表明刺激淋巴细胞褪黑激素受体会导致淋巴细胞产生IL-2[22]。
ELISA结果显示,与M组相比,BX-YYR各剂量组可降低大鼠血清TNF-α、IL-1β、IL-2、IL-6等细胞因子水平。有研究表明IL-2具有多种免疫调节功能和生物学特性,可能与调节睡眠-觉醒、记忆功能、运动和神经内分泌轴有关[23]。研究发现,TNF-α、IL-2、IL-6和IL-1β等其他细胞因子的昼夜变化与睡眠关系密切[24-25]。睡眠减少能增加IL-6和TNF-α的分泌,且在睡眠、饮食等自主生命活动中TNF-α发挥着重要作用[26]。报道发现,IL-6和TNF-α会增加非快速眼动睡眠[27-28]。IL-1β是一种具有广泛生物活性的炎症因子,可间接反映睡眠状态[29]。
本实验结果显示,BX-YYR可降低海马Orexin及其受体OX1R的表达,升高受体OX2R表达。海马体是学习记忆的主要功能区,炎症反应会影响其功能。Orexin神经元广泛分布于中枢神经系统,Orexin及其受体参与了重要的生理过程,如睡眠-觉醒、学习和记忆等过程[30-32]。阻断Orexin信号通路会使睡眠-觉醒紊乱,且对哺乳动物的进食行为、神经内分泌功能、睡眠/唤醒周期和能量代谢等生理过程有重要影响[33-34]。2014年苏沃雷生(Suvorexant)作为一种Orexin受体拮抗剂,首次被FDA批准用于治疗失眠症[35]。多项Meta分析和临床试验支持Suvorexant治疗失眠症的疗效[36]。研究发现,Orexin通过与OX1R、OX2R结合激活下游信号通路,参与保护神经元[37]。Orexin神经元通过血清素受体5HT1A在调节睡眠/觉醒状态中发挥着至关重要的作用[38]。另有研究发现SD大鼠的海马体积缩小,结构受损,海马Orexin、OX1R和OX2R表达增加,低剂量Orexin能提高神经元活力,而高剂量Orexin则减弱神经元活力[39]。
综上所述,本研究发现BX-YYR能够改善PCPA失眠模型大鼠的睡眠情况,同时调控血清TNF-α、IL-1β、IL-2、L-6水平,其作用机制可能与调控海马Orexin及其受体OX1R、OX2R表达,上调Bcl-2表达,抑制海马神经元细胞凋亡有关。本研究存在一定的局限性,Orexin如何通过其受体引起细胞凋亡还不明确,还需要进一步的实验研究。
