基于影像组学和机器学习的脑膜瘤病理等级分类研究
2022-07-05徐晨光宋文雄丁飞雨陈玖刘永刘文邹元杰
徐晨光,宋文雄,丁飞雨,陈玖,刘永,刘文,邹元杰
脑膜瘤是颅内好发的良性肿瘤,起源于蛛网膜层的上皮性脑膜瘤约占所有原发性颅内肿瘤的30%,非恶性原发性颅内肿瘤的50%以上[1]。在大多数情况下,脑膜瘤生长缓慢,组织学上表现为良性行为的低级别脑膜瘤(WHO Ⅰ级),但约10%~20%的脑膜瘤被认为是具有侵袭性生物学行为的高级别脑膜瘤(WHO Ⅱ级和WHO Ⅲ级)[2-3]。
脑膜瘤的治疗和预后与手术切除程度及组织学级别密切相关[4]。脑膜瘤病理分级的术前预测有助于治疗计划和手术切除策略制定。根据欧洲神经肿瘤学会最近发布的指南[2],对于偶然发现的无症状脑膜瘤,建议定期随访,无需手术治疗;在这些病例中,组织学验证不是强制性的,寻找无创评估肿瘤病理分级的方法在临床中显得尤为重要。神经影像中MRI是颅内脑膜瘤检测和评估的重要的无创检测技术,既往研究表明,术前MRI影像特征包括肿瘤增强的T1图像的异质性、不规则的肿瘤形状和瘤周脑水肿可用于评价脑膜瘤的分级和组织病理学特征[5-6]。近年来,随着影像组学发展,其已被更多地应用于预测脑肿瘤的病理等级和临床预后[7-8]。通过提取MRI中灰度模式、像素相互关系和光谱特征等定量特征,利用这些特征构建机器学习模型进而鉴别肿瘤等级[9]。研究表明,影像组学分析可以更灵敏、准确地对脑膜瘤图像进行定量统计描述,协助进行脑膜瘤术前分级[10]。
影像组学是一门诞生于2012年的多学科交叉技术,影像组学存在的意义在于,鉴于肿瘤的异质性,常规的穿刺活检技术由于组织取样的限制,仅能表征局部的肿瘤信息;然而放射影像则可以表征整个肿瘤,同时具备无创便捷地观测肿瘤不同生长阶段的能力。影像组学方法将精准的定量分析技术引入到影像诊断领域,使影像诊断方法从定性变为定量,也为辅助甚至代替有创诊断带来可能。研究者已将影像组学分析广泛地运用于胃癌、肝癌、甲状腺癌等肿瘤的研究[11-13],发现影像组学技术可以辨别肉眼无法识别的纹理等特征,从而对疾病进行诊断和预后研究。现阶段针对脑膜瘤病理分级的影像组学研究相对较少,并且这些研究[14-16]所取得的成果有限。在诊断准确性、实用性等方面有很大发展空间。本研究选用五种机器学习算法,在验证组中取得了更高的曲线下面积值(area under curve,AUC),并且在训练组和验证组中预测准确性等指标波动不大,具有良好的稳定性。本研究旨在评估影像组学分析方法在术前预测脑膜瘤病理分级中的作用。
1 资料与方法
1.1 一般资料 经纳入和排除标准选择后剩余227例脑膜瘤患者,WHO Ⅰ级157例,WHO Ⅱ级70例。纳入标准:(1)术后病理确诊为脑膜瘤;(2)患者接受手术治疗前10 d内行头部MRI平扫及增强检查;(3)临床资料完整。排除标准为:(1)MRI质量不佳,例如有运动伪影;(2)患者在接受手术治疗前行肿瘤栓塞或放化疗;(3)磁共振数据不完整或者无法进行预处理。
1.2 MRI参数及影像特征 所有MRI数据均使用西门子3.0 T 8通道头线圈扫描仪进行。术前MRI方案包括T2加权TR/TE 3 500/10 ms,视野255 mm,层厚6 mm,矩阵,384×384;增强T1WI TR/TE 250/2.8 ms,视野255 mm,层厚6 mm;矩阵,384×384图像。增强扫描采用高压注射钆喷酸葡胺Gd-DT-PA造影剂0.2 mmol/kg,2.0 mL/s速率,注射后加入15~20 mL生理盐水,之后行头部轴位、冠状位、矢状位 T1WI扫描。
获取MRI图像特征,包括肿瘤位置(凸面、颅底、镰旁、其他位置)、肿瘤强化异质性(均匀、不均匀)、肿瘤形状(规则、不规则)、瘤脑界面(清晰、不清晰)。术前常规MRI图像处理分析由2名影像科医生完成(高年资和技术职称影像科医生复核结果)。
1.3 方法
1.3.1 图像预处理 使用基于Pythonv3.9.2(http://www.python.org)实现的开源Simple ITK模块,对每个序列图像进行N4偏置场校正,以校正磁场强度的不均匀性。
1.3.2 肿瘤分割 将T1WI增强和T2WI图像以DICOM格式导入ITK-SNAPv3.8.0(http://www.itksnap.org)软件手动描绘肿瘤的ROI。分别在轴位、冠状位和矢状位T1C和轴位T2WI序列上勾画ROI,在T2WI序列上勾画ROI包括瘤周水肿和肿瘤。累计每个切片的体积生成ROI总体积。将T2WI序列上的包含瘤周水肿和肿瘤的总体积减去轴位T1C序列上的肿瘤ROI体积,计算出瘤周水肿体积[17]。
1.3.3 影像组学特征提取 使用开源python包Pyradiomics1.18.1(http://www.radiomics.io/pyradiomics.html)[18]提取进行影像组学特征,从每个MRI序列中提取1 502个特征。
1.3.4 影像组学特征筛选 筛选前采用Z-score归一化以减少在使用机器学习模型进行分类前异常值和噪声的影响。采用LASSO回归和10折交叉验证筛选T2WI轴位和T1C轴位、冠状、矢状位影像组学特征数据。使用皮尔逊相关系数计算筛选后影像组学特征参数的冗余度并绘制相关系数的热图。随机保留相关系数绝对值大于0.8的两个特征中的一个以避免共线性。
1.3.5 模型构建和机器学习算法比较 将患者按脑膜瘤级别分层随机抽取,分为训练组(158例)和验证组(69例)。采用随机森林(random forest,RF)、逻辑回归(logistic regression,LR)、高斯朴素贝叶斯(Gaussian NB)、支持向量分类器(support vector classifier,SVC)和K邻近算法(K-nearest neighbor,KNN)五种机器学习算法在训练组中建立模型。每一种算法依据纳入变量不同构建三类模型,分别为:(1)依赖于影像组学特征的模型(T2WI序列所有特征和增强T1WI每个轴位特征分别独自构建模型);(2)临床特征(包含影像学特征)的模型;(3)包含所有影像组学特征和临床特征的综合模型。对上述模型,在训练组中采用网格搜索的方法确定机器学习算法最佳参数。在验证组中验证模型预测性能,评价指标包括AUC,精确度(accuracy,ACC),F1值(F1-Score),灵敏性(sensitivity,SEN)和特异性(specificity,SPE),以AUC为主要判断指标。本研究随机分组3次以使结果稳健,将3次计算的评价指标结果取均值展示。
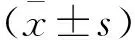
2 结 果
2.1 临床和影像学特征在脑膜瘤级别的组间差异低级别组中Ki-67(%)为(4.55±2.033);高级别组中Ki-67(%)为(9.6±7.817)。统计分析后得出高级别脑膜瘤与S100、肿瘤增强异质性(P=0.017,0.021)、Ki-67(%)、轴位体积、冠状位体积、矢状位体积、肿瘤体积、瘤周水肿体积、轴位直径、冠状位直径、矢状位直径、肿瘤直径、肿瘤形状和瘤脑界面清晰度显著相关(均P<0.001)。低级别和高级别脑膜瘤患者在年龄、性别、孕激素受体和肿瘤位置方面均无统计学差异(P值分别为0.708,0.206,0.539和0.956)。患者的临床和影像学特征统计结果见表1。
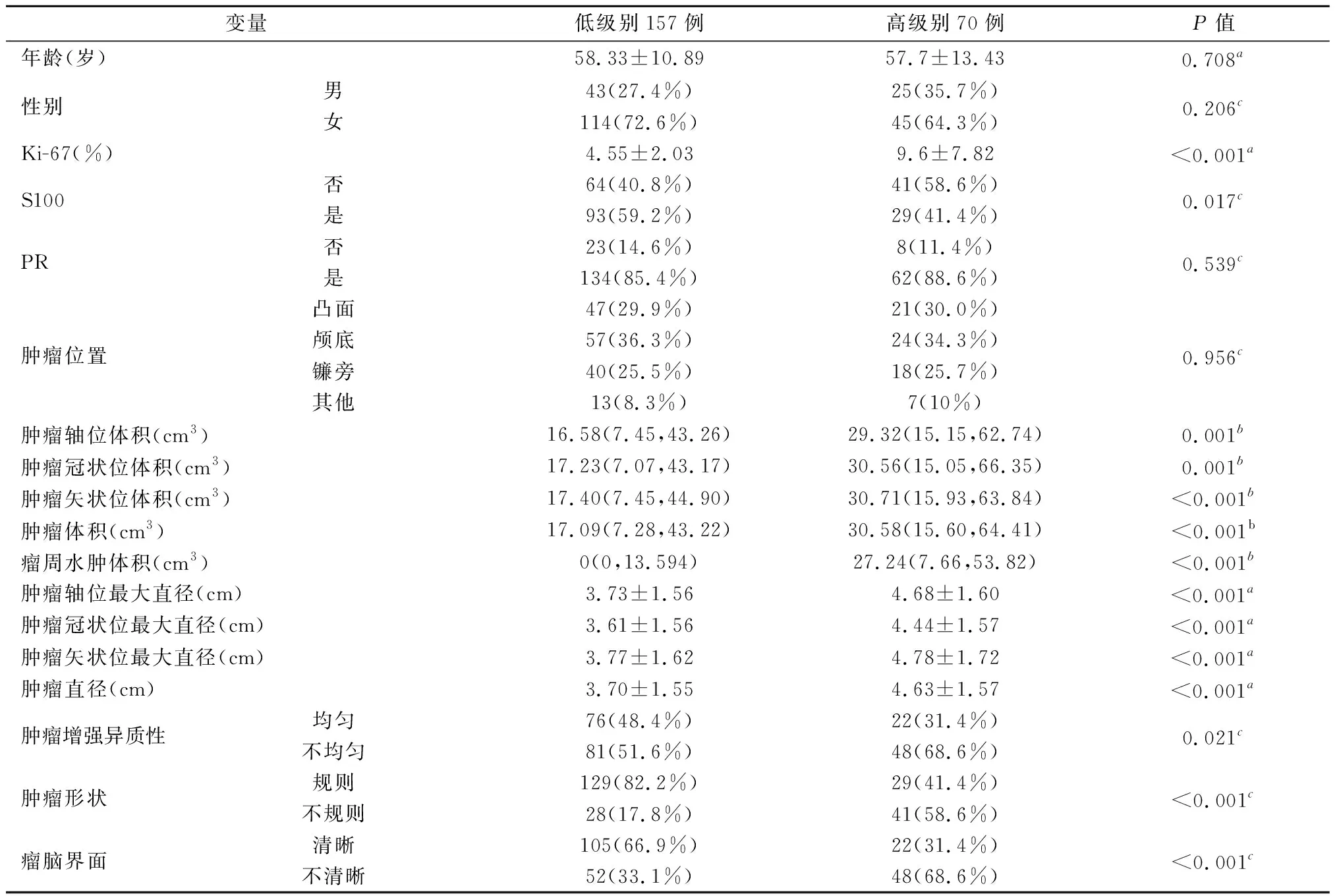
表1 不同病理级别脑膜瘤的临床特点
2.2 特征筛选结果 采用LASSO回归和10折交叉验证对T2WI轴位和T1C轴位、冠状、矢状位特征进行降维,最终分别筛选出15、20、16、10个具有非零系数的影像组学特征。将表1中P<0.05的临床特征与这些影像组学特征共同使用皮尔逊相关系数的方法计算特征参数之间的冗余度,并比较临床特征与影像组学特征之间的相关性;绘制相关系数热图。最终T2WI轴位、T1C轴位、冠状、矢状位分别保留特征14、17、8和6个。见表1。剩余临床特征5个,分别为瘤周水肿体积、肿瘤直径、肿瘤增强异质性、肿瘤形状和瘤脑界面清晰度。
2.3 预测模型性能比较 本研究比较了五种分类算法,基于同样特征的情况下,发现在训练组中RF算法具有最好的预测性能,每种模型的AUC值均接近0.990,而在验证组AUC有较大幅度下降,仅在综合模型中表现出优异的性能,AUC为0.931。验证组中LR算法性能最好。通过对5种算法的综合评价,发现基于LR算法的模型不仅在训练组中具有较高的AUC值,而且在验证组中同样较高,特别是在融合了所有特征的综合模型中其AUC值在验证组相较于训练组没有明显下降,分别为0.988和0.959;本研究建立的脑膜瘤机器学习分类模型,分别是依赖于影像组学特征的模型、临床和影像学特征的模型,以及包含所有特征的综合模型。相比之下,综合模型的表现最佳,在所有的算法运行下均获得了高于其他模型的AUC值,是唯一在验证集上依赖各类算法获得的AUC值均大于0.9的模型。综上,基于LR算法的综合模型是最佳的脑膜瘤等级预测模型,其在训练组AUC=0.988,95%CI:0.952~0.996;在验证组中AUC=0.959,95%CI:0.878~1.000。各模型结果见表2-6。各模型的ROC曲线见图1。
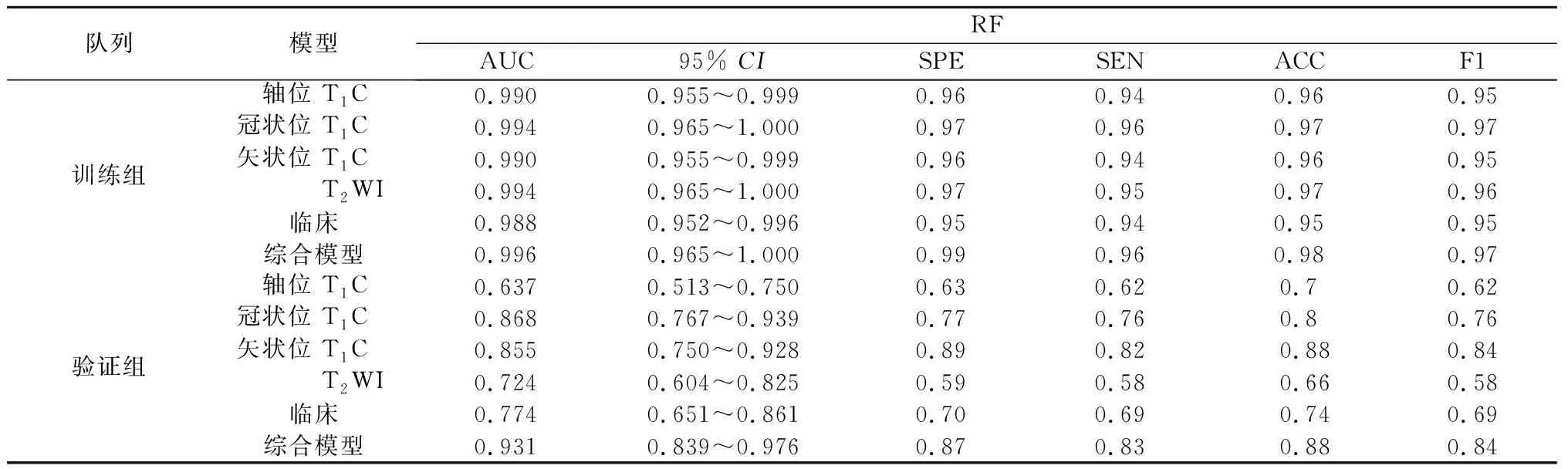
表2 RF模型评价指标
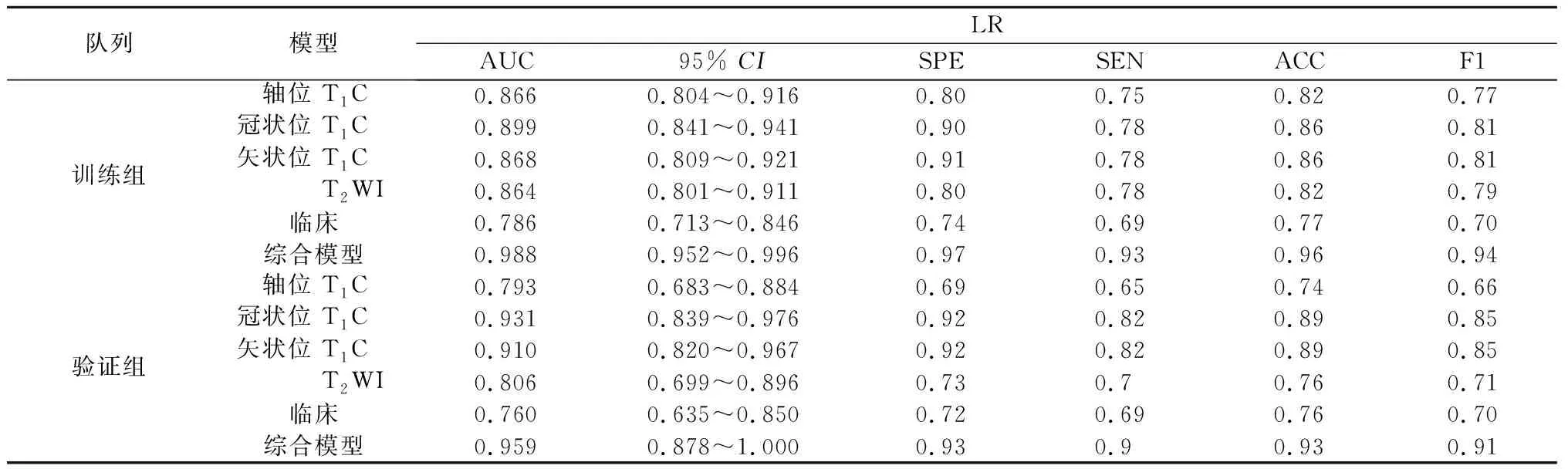
表3 LR模型评价指标
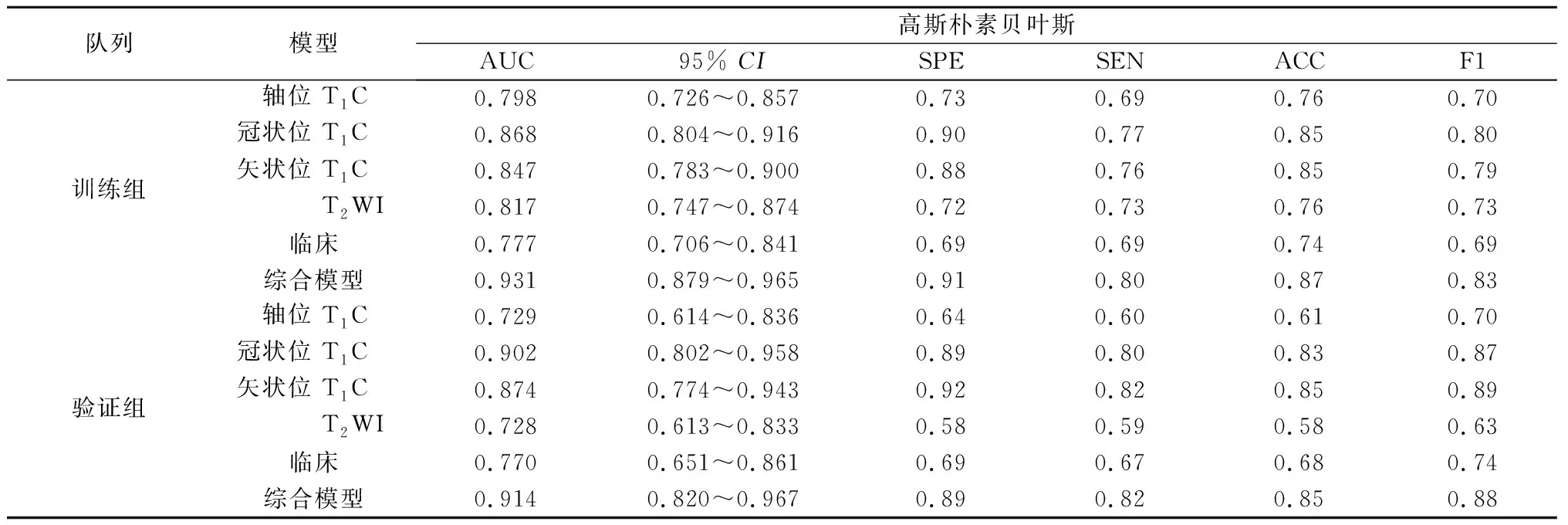
表4 高斯NB模型评价指标
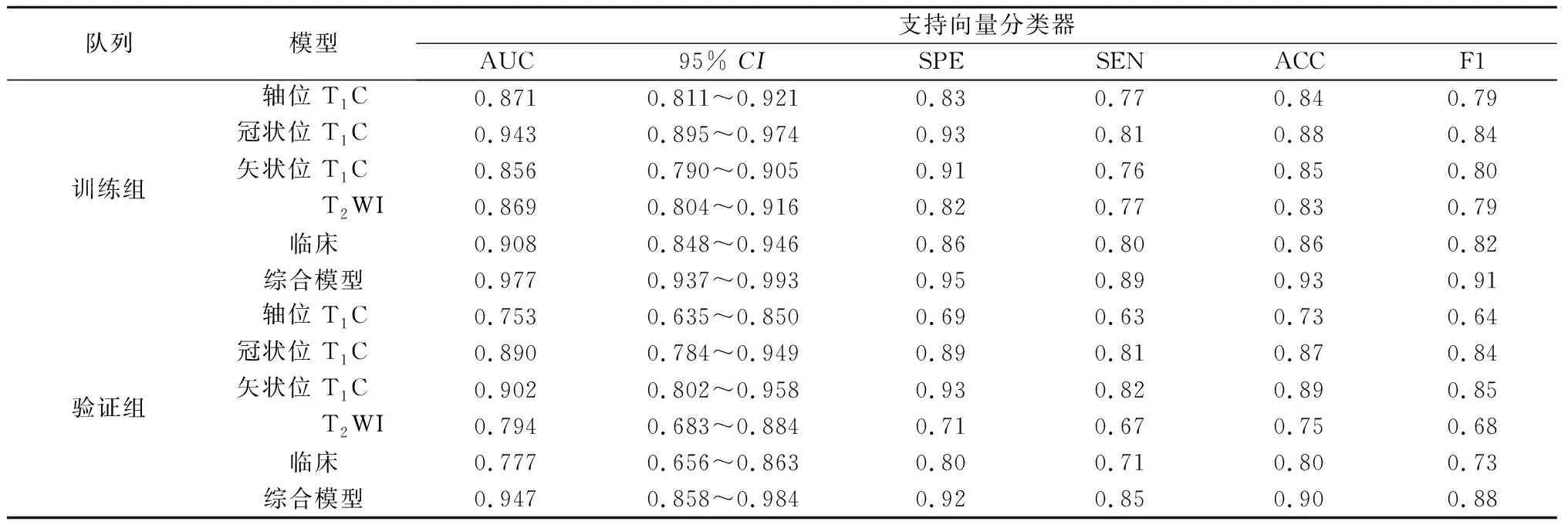
表5 SVC模型评价指标
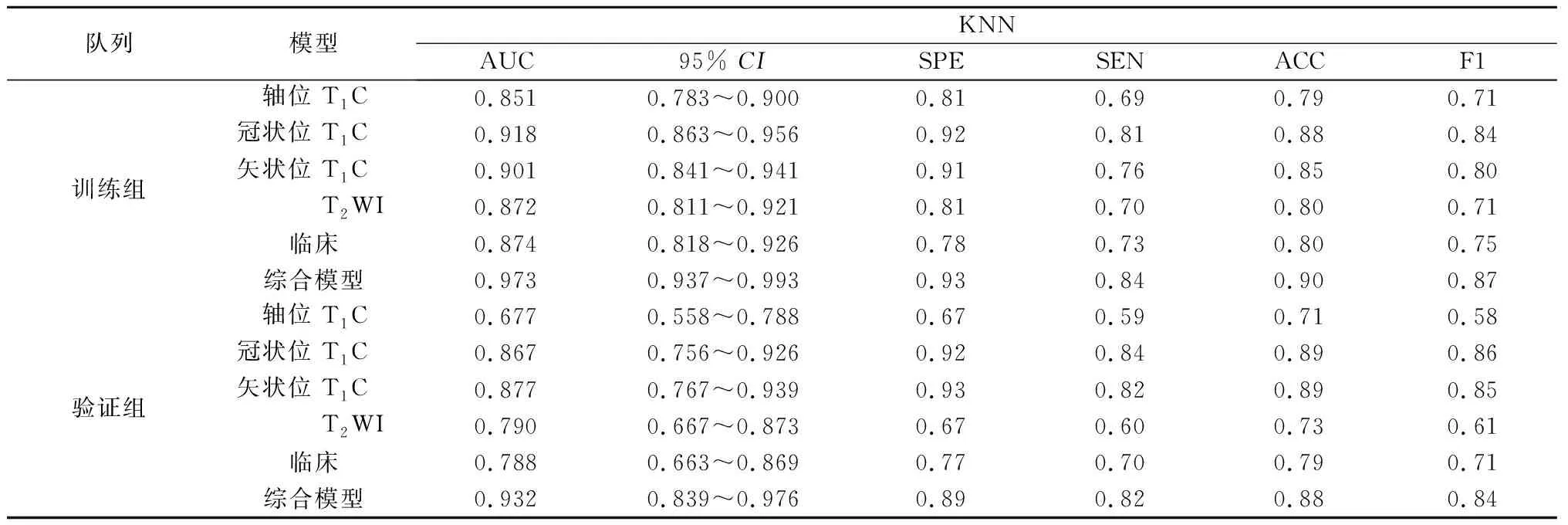
表6 KNN模型评价指标
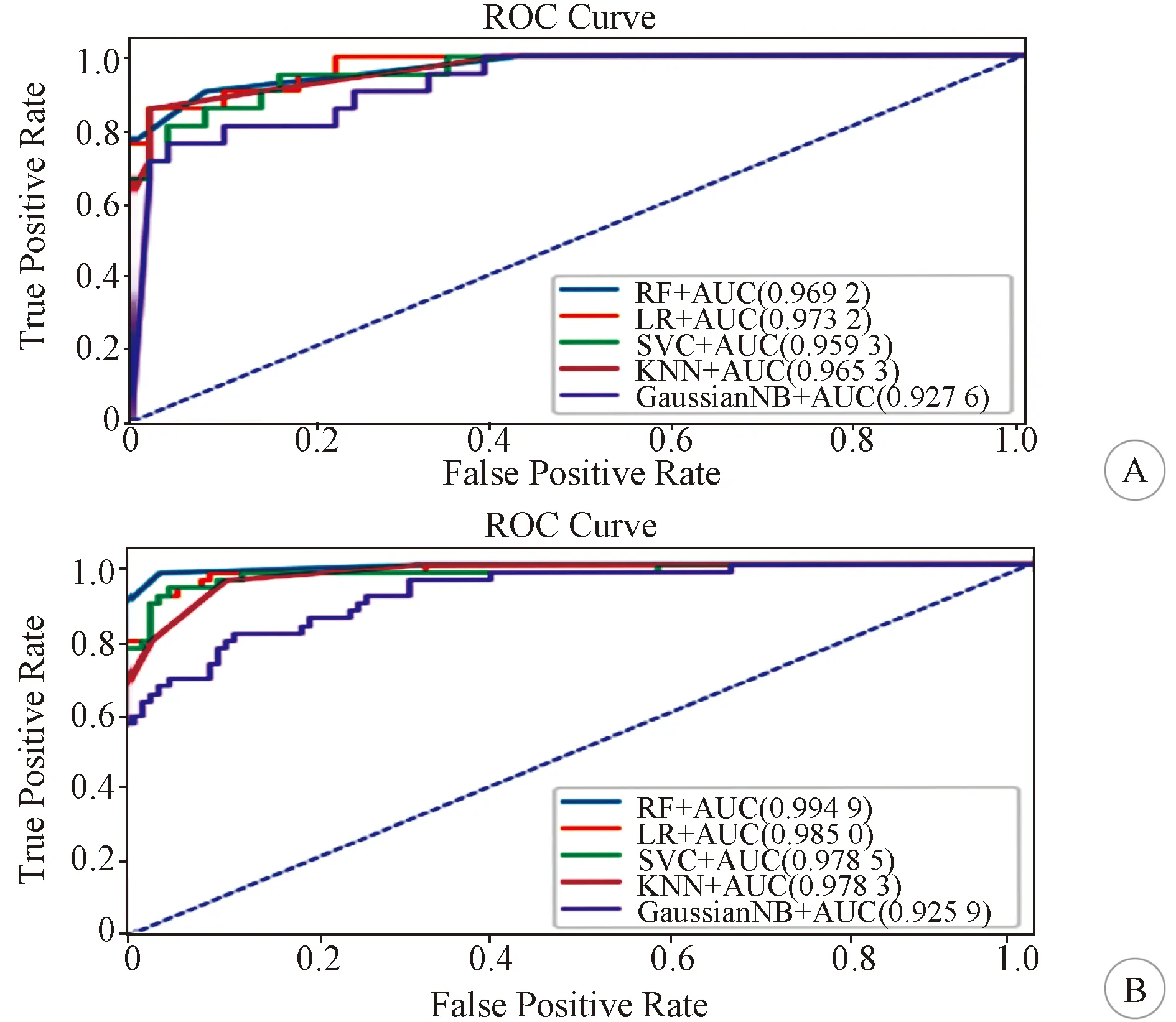
A:综合模型在验证组中基于五种机器学习算法的ROC曲线; B:综合模型在实验组中基于五种机器学习算法的ROC曲线,蓝色曲线表示RF模型,橙色曲线表示LR模型,绿色曲线表示支持向量机模型,红色曲线表示最小近邻算法模型,紫色曲线表示高斯朴素贝叶斯算法模型;横坐标表示假阳性率,纵坐标表示真阳性率,由于篇幅限制仅展示综合模型的ROC曲线
3 讨 论
影像组学技术为本研究提供了可靠的术前无创诊断方法。经过影像数据标准化、ROI勾画、影像组学特征提取、模型建立与验证等步骤将磁共振影像中肉眼无法辨别的高通量信息转化为定量数据,利用五种机器学习算法构建脑膜瘤病理等级分类模型,对比模型AUC值发现基于LR算法的综合模型能有效评估脑膜瘤病理特征,通过训练组和验证组的分析处理,没有出现过拟合的现象,表明该模型具有较强泛化能力。
常规MRI影像可经验性预测脑膜瘤病理分级,但偏差过大,影像组学的发展提高了其预测准确性。利用MRI影像特征和肿瘤最大直径等临床特征等要素组成的模型,无论基于何种机器学习算法,其鉴别脑膜瘤病理等级的准确性和AUC值均显著低于基于影像组学特征的模型。这表明影像组学方法具有相比以往的肉眼鉴别脑膜瘤MRI影像特征进行术前脑膜瘤病理等级的鉴别具有更大的优势,能有效提升术前脑膜瘤病理等级的鉴别能力。影像组学相较于既往临床医生根据经验判断的准确性提升,在一项关于脑膜瘤侵袭性预测的研究中也得到了证实[19]。
本研究发现通过LASSO筛选后的影像组学特征主要是小波特征,其中灰度共生矩阵和灰度大小区域矩阵的LASSO系数最大。灰度共生矩阵是涉及像素距离和角度的矩阵函数,它通过计算图像中一定距离和一定方向的两点灰度之间的相关性,来反映图像在方向、间隔、变化幅度及快慢上的综合信息,包含了两个熵特征,熵值越大,表明肿瘤组织的局部差异越大。游程矩阵主要反映纹理的粗糙度和方向性,长笔画主导值越小,说明图像的纹理越粗糙。同时,灰度大小区域矩阵有效地描述了纹理的均匀性。这些高阶特征能更有效地反映不同级别脑膜瘤病变的空间差异[20-22]。
本研究注意到T1C在轴位图像上筛选的特征多于其在冠状位和矢状位筛选的特征,但模型的AUC值和准确度却低于后者。这表明模型的准确性不随特征数量增多而提高,构建模型需选择代表性特征以简化模型并提高准确性。有学者提出,相比T2WI,利用T1C数据构建的模型效能更高[23]。因为在增强T1WI序列中脑膜瘤的血供明显增强使肿瘤边界显示更清晰更利于精确勾画ROI以提取完整的肿瘤影像组学特征,从而提高模型性能。但他们仅使用增强T1WI的单一轴位数据而未比较各轴位数据之间的差异。我们使用T1C各轴位数据构建模型发现,基于轴位数据构建的模型的AUC值和准确率远低于基于冠状位和矢状位构建的模型。这可能由本研究的MRI影像层厚较大而无法完整描绘肿瘤特征所致。
脑膜瘤属大脑实质外肿瘤,一般存在于靠近颅骨的位置。由于层厚较大,若肿瘤较小,则无法被扫描或扫描层数过少,导致很多特征丢失。特别是在轴位,那些在颅底和大脑凸面的肿瘤更容易受颅骨影响。由此我们建议对于拥有各轴位的MRI数据,可首选冠状位和矢状位的影像数据用于研究以避免丢失特征,提高模型性能。
Han等人[20]发现基于单T1WI序列的模型优于多序列构建的模型,因为虽然多序列模型包含更多信息,但样本量较小而提取的特征数量较多会增加过度拟合的风险。然而大部分研究的结论与之相悖,认为多序列模型的预测性能更高。如Hu等人[9]利用常规MRI+ADC+SWI序列构建的脑膜瘤等级预测模型使用RF算法所得AUC值为0.84,而仅依赖单序列的模型AUC值均小于0.8,与另一些研究结果类似[21,22],表明结合不同MRI参数的影像组学特征可显著提高对脑膜瘤分级的分类能力。本研究发现与此一致,即多参数综合模型,相比单序列模型,在五种机器学习算法中均表现出更优性能,特别是在综合-LR模型中,其特异性为0.93、敏感性为0.9、准确性0.93、F1值为0.9,明显优于其他模型。这可能是由于多序列模型比单序列模型包含更多的影像组学特征,包括肿瘤细胞数量、血管密度、代谢活性和退行性变化等区域差异的相关信息[26]。相较于单序列模型,多序列模型包含更多的影像组学特征,包括肿瘤细胞数量、血管密度、代谢活性和退行性变化等区域差异的相关信息[25]。本研究得出了类似的结论,组建的多参数综合模型,相较单序列模型,在所有的五种机器学习算法中均表现了优异的性能,特别是在综合-LR模型中,在验证组中特异性为0.93、敏感性为0.9、准确性0.93、F1值为0.9,明显优于其他模型。相较于其他机器学习算法,LR在进行脑膜瘤病理等级分类时获得了更高的敏感性,表明运用LR算法可以减少分类模型的漏诊率,提高了高级别脑膜瘤的检出率,这对于实际的临床应用很有意义。相较于其他机器学习算法,使用LR对脑膜瘤病理等级分类具有更高敏感性,表明运用LR算法可降低分类模型的漏诊率,提高高级别脑膜瘤的检出率,这对实际临床应用意义深远。
综上所述,本研究通过机器学习的方法对常规MRI图像进行影像组学定量分析,探讨了术前鉴别脑膜瘤病理等级的可行性。验证队列的结果表明,基于常规MRI序列的影像组学特征模型在术前鉴别脑膜的病理等级时已具有较好的效能表现。而整合了所有特征构建的综合模型,预测效能有了进一步的提升。LR算法对于脑膜瘤病理等级分类的影像组学研究具有很高的应用价值。
利益冲突:所有作者均声明不存在利益冲突。
