肿瘤电场治疗的精确电磁建模与仿真研究
2022-07-05杜宗伦曹群生吕著海汪洋刘宏毅吕文奇王梦遥
杜宗伦,曹群生,吕著海,汪洋,刘宏毅,吕文奇,王梦遥
众所周知,电场可以影响细胞的功能。直流电或者低频的交变电场,如(小于103 Hz,即kHz)会影响细胞膜的极化特性。因此低频场可用于包括神经和肌肉等一系列组织的医疗目的[1];高频电场(如106 Hz,即MHz范围)可以造成细胞膜的极化发生变化,但是极性分子会在这样的高频电场作用下快速振荡引起组织发热。因此高频电磁场可用于透热疗法、组织和肿瘤消融等医学手段[2-3]。中频范围的电场(几百kHz范围)一直都没有被应用于医疗目的,因为这个频率范围的电场变化太快不能刺激神经和肌肉等组织细胞,又只能通过欧姆损耗和介质损耗产生很小的加热效果[4]。2000年初以来,一些研究已经表明中频电场可以破坏肿瘤细胞的分裂。肿瘤治疗电场的工作的频率范围是100~500 kHz,其可以阻止细胞正常的有丝分裂,以对抗快速分裂的癌细胞[5]。在施加的中频电场之下,癌细胞在有丝分裂中期,微管蛋白无法形成纺锤丝,有丝分裂被打断;在有丝分裂的末期,极性细胞成分向卵裂沟聚集,细胞不能正常分裂,导致细胞凋亡[6]。电场的作用与所形成的强度有关。细胞生长速率随场强的增加而降低。对于大多数细胞株来说,当场强超过1伏特/厘米(V/cm)时,生长速度开始下降;当场强超过2.5 V/cm时,生长完全停止。此外,电场对细胞有丝分裂的作用也依赖于频率,每个细胞变化都对应一个最优频率,此时对细胞生长的抑制作用最为显著。此外,平行于外加电场方向分裂的细胞比其他方向分裂的细胞更容易受到电场的影响[6-7]。计算机仿真研究对肿瘤电场治疗的临床应用有非常重要的参考价值。本研究旨在通过计算机三维建模与电场仿真,探讨肿瘤电场治疗中的电场变化规律,进而揭示肿瘤电场治疗中组织物理参数、电极片阵列特性、施加电压大小等因素影响大脑内电场强度分布的物理机制。
1 材料与方法
1.1 材料 南京脑科医院的西门子MAGNETOM Prisma 3.0 T磁共振人体头颅MRI原始数据,MRI图像的扫描间距为1.2 mm,分辨率为256 256,扫描图像为170张的医学数字成像和通信(digital imaging and communication,DICOM)格式文件。
1.2 方法
1.2.1 电极片阵元数目与阵元特性仿真 人体头颅电场仿真中,电极片阵列特性与阵元特性比如电极片大小、角度、数目、形状、距离等对电极片之间场强会产生不同程度的影响。通过电磁场仿真软件MAXWELL 2D和MAXWELL 3D的仿真分析,可以为人体头颅电场仿真中的电极片阵列设计与阵元设计提供重要的参考价值。
1.2.2 人体头颅几何建模 肿瘤电场治疗研究基础需要进行人体头颅和电极片的建模仿真。人体头颅内的电场精确仿真需要建立符合实际的三维几何模型。通常,健康的人体头部分为不同的类型:头皮、颅骨、脑脊液、灰质和白质[8]。用于电场仿真的人体头颅三维模型的建模,可通过医学成像得到的MRI数据用专门的建模软件建模得到。本研究依据南京脑科医院的西门子MAGNETOM Prisma 3.0 T磁共振人体头颅MRI原始数据构建了三维重构模型(图1)。建模采用MIMICS软件,将头部的MRI扫描得到的DICOM数据导入MIMICS中,进行大脑各部分组织结构的三维重建。人体头颅内的不同组织之间的灰度值相差较大,通过软件中的阈值化和区域增长等功能就可以将不同的组织分离开。通过遮罩修改、形态学处理、光滑等步骤完善遮罩,最后从多层遮罩中用三维计算功能重构出三维模型[9-10]。
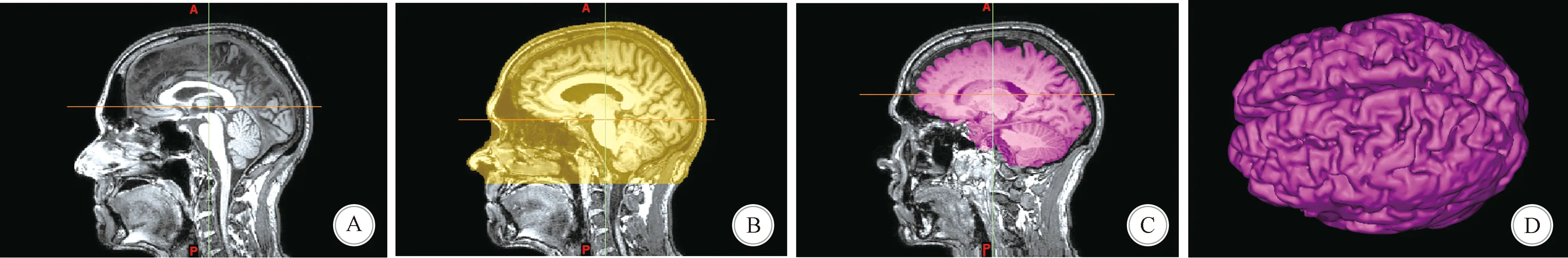
A:整头颅的MRI数据图像; B:上半头颅的遮罩; C:头颅脑组织的遮罩; D:重建脑组织的三维模型
1.2.3 人体头颅网格优化 对建模完成的头颅各部分三维表面网格模型进行网格的优化。采用自适应网格重剖分来优化表面网格质量,并使用光滑等选项进一步改善三维重建后的器官组织表面网格。三维模型表面网格的优化过程见图2。

A:优化前的脑组织表面网格; B:A的局部放大图; C:优化网格剖分后的脑组织表面网格; D:C的局部放大图
1.2.4 人体头颅电极片几何建模 人体头颅建模后,要进行电极片和凝胶的建模。电极片与凝胶的建模过程中,电极片模型为厚度为1 mm,半径为9 mm的类圆柱体;凝胶的模型为厚度为0.7~1.5 mm,半径为10 mm的类圆柱体(图3)。先构建电极片和凝胶的模型草图,确定电极片和凝胶的形状,通过合适的角度,将草图上的电极片和凝胶形状投影到头颅的皮肤上并将皮肤表面分割开,再通过向外移动投影在皮肤上被分割开的表面,就可以生成凝胶的实体模型;同理,电极片也可以通过类似的方法生成。由于皮肤表面是曲面,使用投影方式生成的实体模型会因皮肤表面倾斜角度不同,大小、形状存在一定的微小差异,此微小差异在电磁仿真中造成的影响可忽略不计。经过精细建模,电极片和凝胶完全贴合到头颅表面,满足电磁仿真要求。
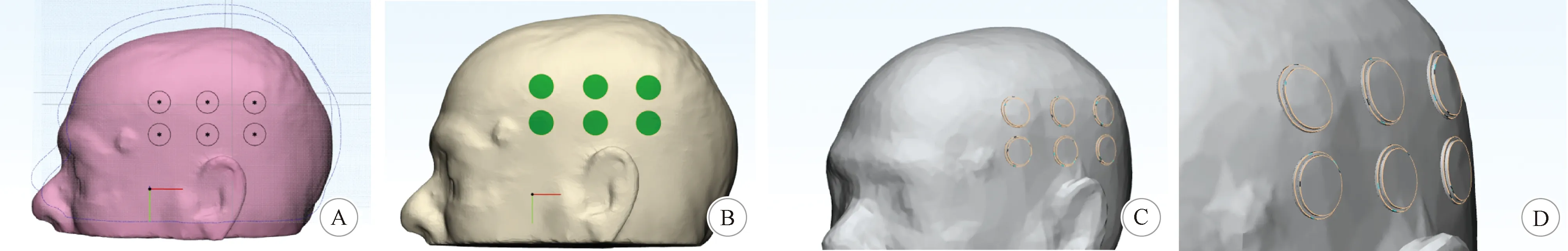
A:电极片和凝胶的模型草图; B:电极片和凝胶在头颅表面的投影; C:建模完成后的电极片与凝胶; D:C的局部放大图
1.2.5 人体头颅仿真 电场治疗的精确电场仿真采用电磁全波软件COMSOL,选择交流/直流(AC/DC) 中的频域电流接口,“电流”接口可以用于计算导电介质中的电场、电流及电势分布。将优化后的组织表面网格模型与电极片模型通过网格零件导入到COMSOL中,导入的模型要进行组合导入、创建域、创建自由四面体网格等过程,最后将生成的整体模型的四面体网格导入到组件中。导入后的网格模型见图4。
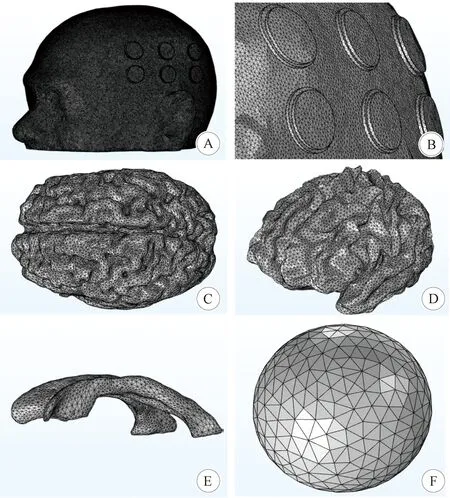
A:上半头颅、电极片及凝胶; B:A的局部放大图; C:大脑灰质; D:大脑白质; E:中心脑室中的脑脊液; F:肿瘤外壳模型
1.3 电磁仿真模型的组织与材料 整体的电磁仿真模型分为以下几个部分:空气域、头皮、头骨、灰质、白质、脑脊液、凝胶、电极片、肿瘤外壳、肿瘤核心区域[11],仿真过程中需对其赋值材料的电参数,包括电导率与相对介电常数[12-14],组织与材料的物理参数见表1。在材料特性赋予之后,要为仿真模型设置边界条件、初始值、终端、工作频率等基本仿真条件。在本研究的仿真计算中,将最外层的空气域设置为电绝缘的边界条件,所有域初始值均设置为0 V,两侧的电极片阵列分别设置为30 V与-30 V作为终端,工作频率在研究模块中设置为200 kHz。

表1 组织与材料的物理参数
2 结 果
2.1 电极片阵元数目和阵元特性的影响 极片阵列-阵元数目和阵元特性影响仿真的过程见图5。通过电极片阵列-阵元数目和阵元特性仿真结果可以发现,电极片尺寸越大,电极片中间的电场越均匀;在分布范围不变且电极片总面积没有较大变化的情况下,大的电极片分裂成多个小的电极片,对中间的场强大小几乎没有影响;电极片旋转一定角度,对电极片紧邻空间内的电场大小分布有较大影响,但对电极片中心空间的场强大小的影响较小;单个电极片大小固定的情况下,电极片的数目增加,电极片中间空间的场强会有所增加;电极片设计成面积相近的圆形、三角形,四边形或是任意多边形,甚至是弯曲的月牙形、带尖端的多刺形,对电极片中心空间场强的影响均较小。

A:宽电极片电场分布; B:窄电极片电场分布; C:大电极片电场分布; D:小电极片阵列电场分布; E:电极片旋转不同角度后电场分布; F、G:电极片三维电场分布
2.2 颅内电磁仿真规律 健康大脑和带有模拟肿瘤大脑的电场分布图见图6。可以看出颅内的电场强度分布与人体组织的物理参数有很大的关系,在加入模拟肿瘤[15]后,大脑内的电场强度分布有明显改变。通过颅内电磁仿真规律仿真结果可以看出,颅内的电场强度分布是不均匀的。在不同组织分界面的两侧,场强大小往往是不连续的,在电导率比较低的组织中,场强比较大。整个头颅中场强最强的部分是在靠近电极片阵列的头皮与头骨中。大脑白质中靠近脑脊液的部分,往往有更高的电场强度。在加入模拟肿瘤后,沿电极片连线方向肿瘤周边的脑组织电场强度有明显增强。

A:健康头颅; B:带有模拟肿瘤的头颅
电极片23阵列在施加±30 V的电压情况下,肿瘤及外周组织仿真结果见图7。肿瘤及外周组织仿真电场强度分布显示,肿瘤沿电场方向邻近的外周区域,如A、D区域,组织中电场强度达到了2 V/cm,部分紧邻肿瘤的区域电场强度达到了2.5 V/cm;肿瘤的其余外周区域,如E、I区域、电场的强度较低,只有1 V/cm左右。在肿瘤外壳中,沿电场方向的肿瘤组织区域,如B、C区域,电场强度达到了1.5 V/cm的治疗强度,而在非沿电场方向的肿瘤组织区域,如F、H区域,电场强度就只有0.6 V/cm。但是整体来讲,肿瘤外壳中有超过60%的区域电场强度达到了1 V/cm的基础治疗标准。相对于肿瘤外周组织区域和肿瘤外壳区域的电场强度,肿瘤核心中的电场强度就要更弱一些,平均只有0.4 V/cm。
电场在颅内、肿瘤及肿瘤外周的电场仿真分布规律,与国外既往研究中得到的仿真规律一致(图8)[15-17]。在不同组织分界面,场强不连续;靠近脑脊液的区域,电场强度更高;肿瘤外壳中沿电场方向的区域,电场强度相比于垂直与电场方向的区域,电场强度更高;肿瘤核心相对于肿瘤外壳,电场强度更低。

A:肿瘤及其外周组织的电场仿真结果; B:肿瘤外壳与肿瘤核心的电场仿真结果
加入模拟肿瘤的大脑模型中,选取图7肿瘤外壳中的B点、C点、F点、H点作为电场强度取样点,改变电极片上施加电压的大小,查看取样点处电场强度随电压大小的变化,其电场值与施加电压之间的关系见图9。可见,在理想的仿真状态下,大脑内的电场强度的大小随着电极片上施加电压的增大而增大,且呈线性关系。
为探究人体头颅电场仿真中大脑内电场强度随电极片数目与分布变化的关系,将目前医疗中常用的3×3电极片分布分为甲、乙、丙三组(图10)。选取图7中的B点为电场强度取样点,在电压大小一定的情况下,分别激活乙、乙丙、甲乙丙,大脑内电场强度随电极片数目的增加而增加,基本呈线性关系,但非严格的线性关系(图11A)。依旧选取图7中的B点为电场强度取样点,在电压大小一定的情况下,分别激活乙丙、甲乙、甲丙,同样为单侧六个电极片单元,电极片分布的改变,会引起头颅内场强大小较为明显的变化(图11B)。这也是大脑内电场强度与电极片数目不呈严格线性的主要原因。
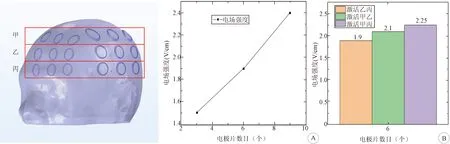
图10 3×3电极片分布方案分组说明A:颅内电场强度与电极片数目的关系; B:颅内电场强度与电极片分布的关系
3 讨 论
极片阵列-阵元数目和阵元特性仿真,使用的工作电场波长为200 kHz,对应的波长是1 500 m,电极片之间的距离设置最大为30 cm,电极片尺寸也在厘米量级。电极片之间距离与电极片尺寸相对于工作电场的波长可以忽略不计,故电极片特性对电极片中心空间场强的影响均较小。电极片形状不同会影响电极片表面的电荷分布,电极片特性改变仅仅会对电极片附近的局部空间造成影响。电极片数目改变,直接影响了电场源的数目,故会对电极片中心空间场强有较大影响。在人体头颅电场仿真中,电极片形状不会对头颅内部中心空间场强产生较强的影响,故电极片阵元形状可选取较为容易加工的圆形。在电极片阵列分布范围不变且电极片总面积没有较大变化的情况下,由于皮肤表面是曲面,可选取适当大小的阵元以让阵元更好地贴合皮肤表面。单个电极片大小固定的情况下,电极片的数目增加可以增加空间内部场强,恰当地增加电极阵列中阵元的数目,可以增强治疗效果。
由于头颅内不同类型组织的电导率与相对介电常数有差异,故颅内电场强度分布不均匀。不同组织分界面两侧,场强大小往往是不连续的,在电导率比较高的组织中,由于部分电场的反射,其内的场强相对比较小。因为头皮介电常数与电极片的介电常数相同,头骨的电导率很小,且头皮与头骨距离电极片最近,故靠近电极片阵列的头皮与头骨中有着最大的电场强度[16]。大脑白质中靠近脑脊液的部分,往往有更高的电场强度,可能是由于脑脊液的电导率比较大,产生了类似于电容器的较高电容性电抗[17]。加入模拟肿瘤后,改变了原来组织处的介电常数与电导率,故颅内场强分布会发生较大变化。
在模拟肿瘤处,整个肿瘤电场分布不均匀,是由于肿瘤外壳和肿瘤核心物理参数不同且电极片分布并没有完全覆盖周边所有方向。如需达到更好的治疗效果,就需要加大施加在电极片上的电压,增加治疗电极片的数目或是优化治疗电极片在颅周的分布。
在肿瘤仿真中,肿瘤内电场分布的不均匀性主要是由颅内组织电导率、介电常数、形状等不同和电极片分布位置决定的,施加在电极片上的电压大小并不会直接影响颅内电场分布的不均匀性,故大脑内的电场强度的大小随着电极片上施加电压的增大而增大,在理想情况下呈线性关系。
改变电极片的位置,颅内场强大小与分布会有较为明显的变化[18-19],故大脑内的电场强度和电极片的数目基本呈线性关系,但并非绝对的线性关系。同样数目的电极片,可通过合理安排其在头颅表面的分布,来获取患处最大的电场强度,以达到最好的治疗效果。为不同的肿瘤治疗患者进行个性化的计算机仿真设计来决定治疗电极片的位置是非常有必要的[20]。
综上所述,颅内电场强度及分布与电极片阵元并没有明显的关系,颅内电场强度及分布主要由电极片数目、电极片分布、电极片施加电压大小和组织物理参数决定。每个患者的头颅大小、头颅形状、肿瘤形状、肿瘤体积及肿瘤位置等都是不同的,在对每个患者进行电场治疗之前都要为其制定个性化治疗方案。对患者做磁共振扫描,根据得到的MRI数据,为患者进行个性化头颅建模及肿瘤建模,确保电场仿真拥有精确的物理模型。针对肿瘤的位置,对电极阵列的分布进行合理选择,通过有限数目的电极片和较低的电压在病灶处实现最大的电场强度。
随着研究的进一步深入,在未来有望实现针对患者头颅与肿瘤的计算机快速个性化精确建模,减少人工建模的工作量。还可使用计算机人工智能技术,通过电极片分布优化算法来自动优化电极阵列排布,以实现更加科学有效的医疗方案制定。
利益冲突:所有作者均声明不存在利益冲突。
