基于表观遗传因子的肝细胞癌预后模型的构建和验证
2022-07-05张海航曾江正孙华茂卢彦达
张海航,曾江正,朱 旭,孙华茂,杨 璐,付 裕,卢彦达
(1.海南医学院第一附属医院肿瘤内科,海南 海口 570102;2.海南医学院生物医学信息与工程学院,海南 海口 571199)
肝细胞癌(hepatocellular carcinoma,HCC)是世界上最常见的恶性肿瘤之一,也是主要的癌症致死原因[1,2]。在中国,由于乙型肝炎病毒(hepatitis B vi⁃rus,HBV)或 丙 型 肝 炎 病 毒(hepatitis C virus,HCV)感染引起慢性肝炎及肝硬化是HCC 的主要危险因素[3,4]。尽管各种临床治疗手段不断用于肝癌的治疗,但是大多数HCC 患者的复发率高且预后不佳,总体生存期(overall survival,OS)仅有3%~5%[5]。一方面是由于肝癌的高度异质性,另一方面是由于HCC 发生、发展的生物学过程十分复杂。目前为止,甲胎蛋白是肝癌最广泛使用的生物标志物,由于甲胎蛋白可靠性差,因此需寻找新的HCC预后相关分子标志物,对肝癌的诊断、预后和治疗具有重要意义[6,7]。
HCC 的发生和发展不仅涉及DNA 编码的遗传基因突变,还与表观遗传调控基因的异常积累、肿瘤基因的激活及抑癌基因的失活与丢失有关[8]。与基因改变相反,表观遗传调控是一种不涉及DNA序列改变的基因表达和调控。例如通过miRNA 转录后调控、共价组蛋白修饰和DNA 甲基化来影响基因的染色质结构和转录[9,10]。虽然无法逆转基因改变,但表观遗传修饰是一个动态和可逆的过程[11]。目前HCC 研究所要解决的问题是这些DNA编码的遗传基因和表观遗传变化的异质性和复杂性之间的机理及对患者预后的影响。分析复杂的遗传和表观遗传变化与HCC 发展的机制有助于寻找有效的治疗方法。
虽然,近年来表观遗传的研究取得了很大进展,已经开发出了针对表观遗传调节蛋白的各种药物,这些蛋白能够将恶性癌细胞恢复正常状态[12]。然而,大多数研究多集中于单一的表观遗传方面,仍然缺乏评估与miRNA 转录后调控的表观遗传基因在HCC 预后关系方面的研究。因此,探究HCC中miRNA 靶向的表观因子的调控关系,识别预后显著相关的表观因子,可以为HCC 中表观遗传基础研究提供新思路。
1 资料与方法
1.1 HCC 中差异基因的筛选
从TCGA 数 据 库(https://portal.gdc.cancer.gov/)下载371 例HCC 样本和50 例正常肝组织样本的RNA 测序数据以及372 例HCC 样本和50 例正常肝组织样本的miRNA 测序数据。利用R 程序比较HCC 样本和正常肝组织样本的基因表达水平,根据∣log2FC ∣>1 且FDR<0.05 为 标 准,筛 选 差 异 表 达miRNA 和mRNA。
1.2 构建miRNA⁃DEEFs 调控网络
从TCGA 数据库下载所有样品的临床资料,并将整理好的临床资料与差异分析miRNA 整合成一个矩阵,使用单因素COX 分析获得预后显著的差异miRNA,多因素COX 分析采用逐步回归法,最后成功建立了将HCC 患者分为高危和低危两组的风险回归预测模型。通过在线数据库预测模型中miR⁃NA 的靶基因。此外,从表观因子数据库下载所有的表观因子,然后与miRNA 靶基因取交集,识别出模型中miRNA 靶向的表观因子。HCC 中miRNA靶向的表观因子与差异表达的mRNA 取交集筛选出DEEFs。根据miRNA 对靶基因的调控机制,最终成功构建了miRNA 和DEEFs 的调控网络。
1.3 DEEFs 的富集分析和蛋白质相互作用网络构建
使用“clusterProfiler”R 软件包(3.14.3 版)[13]对调控网络中的DEEFs 进行基因本体论(gene ontolo⁃gy,GO)分析、京都基因和基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)途径分析,GO 分析揭示了DEEFs 在生物过程、细胞组成和分子功能中的作用,KEGG 分析显示了DEEFs 的富集途径。使用STRING 工具构建蛋白质-蛋白质相互作用(PPI)网络,探索表观遗传基因相互作用[14]。此外,使用Cytoscape 软件(版本3.7.1)[15]及CytoHubba 插件选择核心基因。
1.4 风险评分模型和临床特征的综合分析
为了进一步探讨预测模型中miRNA 与肝细胞癌临床特征的相关性,在单因素COX 比例危险回归分析找出影响OS 率的关键临床指标,选择P<0.05的临床指标然后进行多因素COX 比例危险回归分析,确定风险评分模型能否独立预测预后。绘制单因素回归分析及多因素回归分析的森林图,研究临床指标的价值和风险评分模型在临床实践中的潜在应用。
1.5 调控网络中DEEFs 的生存分析
首先对下载的临床资料进行整理,删除肝细胞癌临床信息中无OS 或OS 低于30 d 的病例,然后,将患者生存时间、生存状态与HCC 中差异表达mRNA 测序数据合并。使用Kaplan-Meier(K-M)法分析网络中表观因子与HCC 预后的关系。
1.6 统计学处理
所有数据通过R 软件包(版本3.6.3)、Perl 脚本工具进行分析处理。连续变量使用t检验和方差分析(ANOVA),分类变量使用Pearson 的卡方检验和Fisher 精确检验来检测统计差异。当P<0.05 表示差异具有统计学意义。
2 结果
2.1 HCC 测序数据的差异分析
从肿瘤基因组图谱(TCGA)数据库中获得HCC 的RNA-seq 数据,下载时间为2020-10-18,其中原发性肝细胞癌374 例(3 例为复发肿瘤样本),其中包括371 例初治HCC 样本和50 个正常组织的mRNA 的表达谱数据,同时下载包括原发性肝细胞癌375 例(3 例为复发肿瘤样本),其中包括372 例初治HCC 样本和50 个正常组织的miRNA 的表达谱数据,所有肿瘤样本来源于未经治疗之前。基因采用gencode.v22.annotation.gtf.gz 探针注释,如有多个探针对应同一基因则取平均值。基因表达量标准化形式采用log2(TPM+1)。本研究所涉及的所有数据从TCGA 下载,数据采集和应用均按照TC⁃GA 发布指南和数据访问策略进行,不需要伦理审查。差异分析使用R(3.6.3 版)上BioConductor 中的“edge”R 软件包[16]来执行,根据(LogFC>=1,FDR<0.05)筛选出差异表达的mRNA 的测序数据,选择高低表达的25 差异表达的mRNA 通过聚类分析绘制热图(图1A)。在mRNA 中上调基因4 815 个,下调基因1 367 个的组间差异通过绘制火山图展示(图2A)。同样方法对miRNA 表达谱数据进行差异分析,分别选择高低表达的25 差异表达的miRNA 通过聚类分析绘制热图(图1B),其中上调基因257 个,下调基因48 个并绘制火山图(图2B)。

图1 HCC 中差异表达的mRNA 和miRNA 的热图Fig 1 Heatmap of differentially expressed mRNA and miRNA in HCC

图2 HCC 中差异表达mRNA 和miRNA 的火山图Fig 2 Volcanic plots of differentially mRNA and miRNA in HCC
2.2 预测模型的构建与选择
通过以上方法获得候选miRNA 后,使用计算机生成的随机数将整个TCGA-HCC 数据集(n=343)分为训练集(172 例)和测试集(171 例)。接着对HCC 患者的临床资料进行整理,删除无OS 或OS 低于30 d 的病例,然后,将患者生存时间、生存状态与差异miRNA 表达数据合并。在训练集中进行模型构建,然后应用于测试集、整个TCGA-HCC数据集以进行最佳模型选择。使用单因素COX 分析,根据P<0.01 选择与肝细胞癌的整体生存(OS)具有预后价值的miRNA。多因素Cox 回归分析在训练集中建立了一个效果良好且稳定的基于3 个miRNA 的预测模型(表1)。
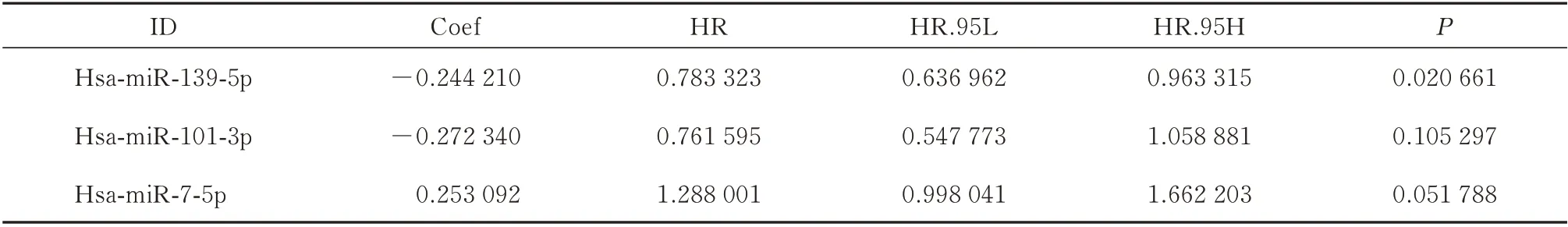
表1 HCC 预后模型中相关的miRNA 列表Tab 1 List of related miRNAs in the prognostic model of HCC
Kaplan-Meier(K-M)生存曲线提示miR-7-5p 的HR>1,是高风险miRNA,随着miR-7-5p 表达量的增加,患者的预后危险性逐渐增加(图3C);相反,miR-139-5p 和miR-101-3p 的HR<1,是 低 风 险miRNA,随着它们表达水平的增加,患者的预后危险性逐渐降低(图3A、B)。多因素Cox 回归的逐步加权相关系数如下:生存风险分值=(-0.293 71×ExpmiR-139-5p)+(-0.247 25×ExpmiR-101-3)+(0.376 329×ExpmiR-7-5p)。根据肝细胞癌患者风险评分值的中位数,把训练组的患者分为高低表达两组,高风险组(n=86 例)患者的OS 比低风险组(n=86 例)更差(图4A)。笔者使用时间相关ROC 评估风险评分模型的可靠性,曲线下面积(AUC 值)为0.742(图5A),说明预测模型在生存监测中取得了很好准确性。同时风险分数曲线、生存状况和表达模式显示两组患者的评分较低的患者通常比风险评分较高的患者预后更好(图6A)。进一步证明预测模型的准确性。

图3 HCC 中与预后相关的差异表达miRNA 的Kaplan-Meier 生存曲线Fig 3 Kaplan-Meier survival curves of differentially expressed miRNA associated with prognosis in HCC
2.3 评估预测模型
为进一步证实风险评分模型,在测试集和整个TCGA-HCC 数据集上验证,该模型成功地把测试集(n=171,P=6.561e-03)的HCC 患者分为高风险组(n=90)和低风险组(n=81),并在OS 方面存在显著差异(图4B),随时间变化的ROC 分析表明,该模型对测试组HCC 患者的预测中表现良好。该组的RUC 值为0.757(图5B),同样,在整个TCGAHCC 数据集(n=343,P=8.273e-06)上验证显示,与低风险组患者(n=167)相比,高风险组患者(n=176)的OS 较差(图4C)。随时间变化的ROC 分析表明,该模型对整个TCGA-HCC 数据集的HCC 患者也有良好的预测表现。该组的RUC 值为0.757,(图5C)。在测试集和整个TCGA-HCC 数据集中的风险得分、生存状态和表达模式的分布也显示出与训练组一致的结果,风险评分较高的患者存活率低于风险评分较低的患者(图6B、C)。结果不仅证明了高低风险的肝细胞癌患者在生存时间和风险程度上存在显著差异,而且也证明了风险模型的准确性。
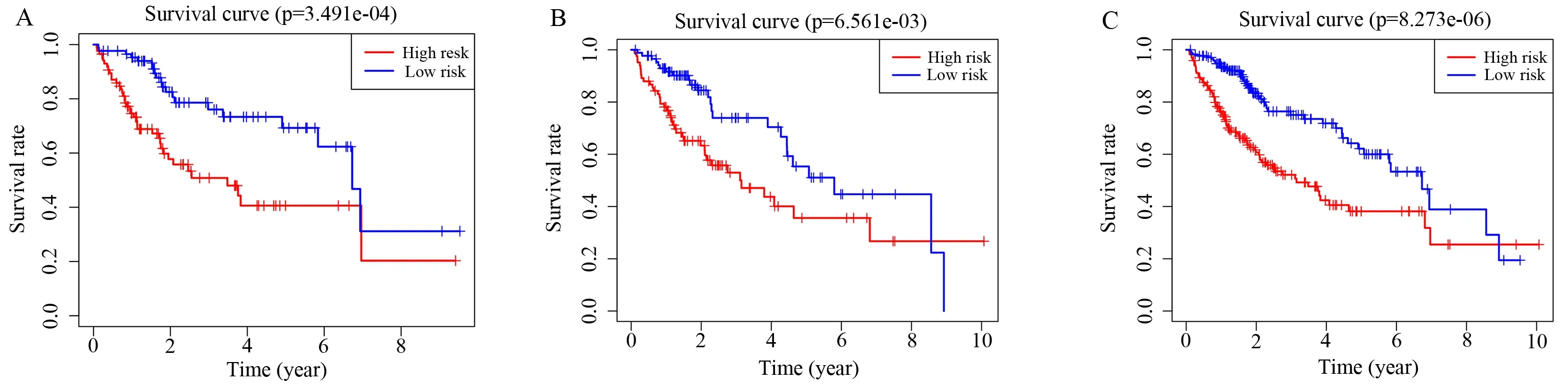
图4 HCC 中与预后相关miRNA 风险模型的Kaplan-Meier 生存曲线Fig 4 Kaplan-Meier survival curve of miRNA risk model related to prognosis in HCC

图5 HCC 中miRNA 风险模型预测患者预后方面准确性的ROC 生存分析Fig 5 Receiver operating characteristic(ROC)curve analysis on the accuracy of miRNA risk models in HCC to predict the prognosis of patients
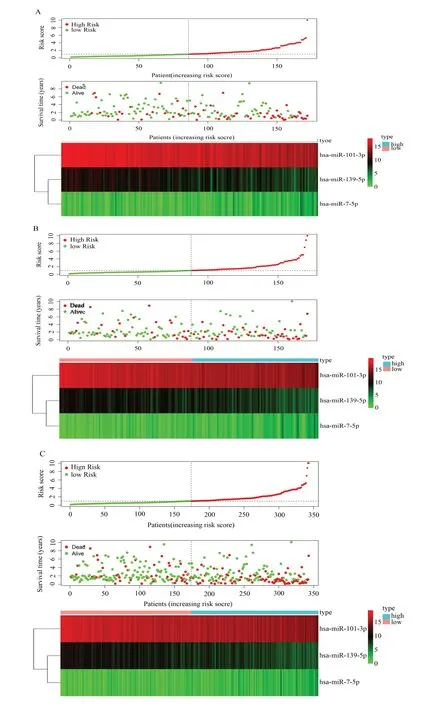
图6 HCC 患者的风险评分、生存状态和基因表达谱热图Fig 6 Risk score,survival status and gene expression profile heatmap of HCC patients
2.4 风险评分模型和临床特征的综合分析
评估预测的miRNA(miR-139-5p、miR-101-3p和miR-7-5p)相互作用是否与HCC 患者的总体存活率相关。首先,根据miRNA 的风险评分将HCC患者样本被分为高表达组和低表达组,然后,确定预测信号的预后价值是否独立于HCC 患者的其他临床病理变量。选定的变量包括年龄、性别、病理TNM 分期、病理分级和AJCC 分期和我们的风险评分进行单因素和多因素Cox 回归分析。结果表明该预测风险评分模型是HCC 患者的独立预后因素(图7)。综上所述,预测风险评分对于HCC 患者预后的预测独立于其他临床特征。

图7 HCC 中miRNA 风险模型和患者的临床病理变量的预后准确性评估Fig 7 Evaluation of the prognostic accuracy of miRNA risk models and patients'clinicopathological variables in HCC
2.5 肝细胞癌中miRNA-DEEFs 调控网络的构建
通 过miRTarBase、TargetScan 和miRDB 数 据库预测模型中miRNA 的靶基因,总共获得了21 763对miRNA-靶基因。首先从表观因子数据库获得720 个表观因子(EpiFactors database(http://epifac⁃tors.autosome.ru/)与miRNA 靶基因取交集,识别出模型中miRNA 靶向的533 个表观因子。然后,把HCC 中miRNA 靶向的表观因子与差异表达的mRNA 取交集筛选出63 个DEEFs。其中34 个表观因子与miRNA 的表达呈负相关(8 个下调靶基因,26 个上调靶基因)。最终,基于HCC 中预后相关的3 个miRNA 和34 个差异表达的表观遗传因子,构建一个miRNA-DEEFs 的调控网络(图8)。

图8 筛选分析得到HCC 中miRNA⁃DEEFs 网络图Fig 8 Screening and analysis to obtain the miRNA‑DEEFs network diagram in HCC
2.6 DEEFs 的功能富集分析和蛋白质相互作用网络
对miRNA 靶向的DEEFs 进行GO 富集分析,GO 富集由三个部分组成:生物学过程(biological process,BP)、细胞成分(cellular component,CC)和分子功能(molecular function,MF)。生物学过程的前三个GO 术语是共价染色质修饰、组蛋白修饰和肽基赖氨酸修饰,细胞成分的前三个GO 项是染色体区域、核染色质和染色体,着丝粒区,分子功能的前三个GO 术语是甲基转移酶活性、转移酶活性,转移一碳基团和S-腺苷甲硫氨酸依赖性甲基转移酶活性(图9A)。KEGG 富集结果证实癌症中的赖氨酸降解和MicroRNAs 是最显著的富集途径(图9B)。GO 和KEGG 的富集表明,预测的目标基因与表观遗传因子的调控密切相关。主要影响染色质的共价修饰、组蛋白修饰和肽基赖氨酸修饰、甲基转移酶活性、赖氨酸降解和miRNA 表达后的调控。为了进一步探究表观因子之间的相互作用,使用蛋白相互作用(Protein-protein interaction net⁃work,PPI)分 析 的 搜 索 工 具(STRING,https://string-db.org/)[图10A]构建miRNA 靶向的表观因子PPI 网络,使用Cytoscape 软件(版本3.7.1)及Cy⁃toHubba 插件选择核心基因进行可视化(图10B)。

图9 HCC 中miRNA 调控的表观因子的富集分析结果Fig 9 Enrichment analysis of miRNA regulated epigenetic factors in HCC
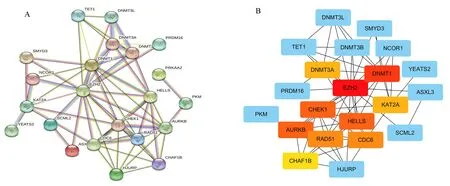
图10 差异表观因子的调控网络Fig 10 Regulatory network of differential apparent factors
2.7 miRNA 靶向调控的DEEFs 的生存分析
Kaplan⁃Meier(K-M)法分析miRNA 靶向 调控的表观因子表达水平与HCC 预后的关系。在HCC中miR-139-5p、miR-101-3p 表达水平减低时,其调控的表观因子(EZH2、PKM、HJURP 和CHEK1)高表达与较差的预后相关。表明这些表观因子可能起到致癌作用(图11A~D)。虽然本文已经证实miR-7-5p 高表达预示着HCC 患者的预后较差,但在本研究K-M 生存分析中没有发现miR-7-5p 靶向调控的表观因子对肝细胞癌患者预后有抑癌的影响。

图11 HCC 中差异表观因子的Kaplan-Meier 生存曲线Fig 11 Kaplan Meier survival curve of different apparent factors in HCC
3 讨论
肿瘤中的miRNA 表达特征与正常组织不同,也因肿瘤类型而异。在HCC 中经常观察到miRNA表达的增加,这些上调的miRNA 在HCC 中充当致癌miRNA[17]。因此,当miRNA 的调控解除时可以影响肿瘤细胞的增殖、侵袭和转移,可能是肿瘤抑制基因的目标[18]。显然,miRNA 内源性表达的改变是肝癌发生的重要机制。考虑到miRNA 通过转录后对表观遗传调控的协同作用,我们试图通过整合分析来研究miRNA 与靶向表观因子在HCC 中的影响。最终通过构建一个miRNA 靶向的表观因子调控网络,综合分析miRNA 转录后对表观遗传调控的协同作用,结果得出miR-139-5p、miR-101-3p 和miR-7-5p 与HCC 预后显著相关。此外,对miRNA靶向的表观因子进行生存分析发现EZH2、PKM、HJURP 和CHEK1 对肝细胞癌生存有显著影响。
研究表明,miR-139-5p 在不同的器官中具有抗癌功效,miR-139-5p 高表达与较好的预后有关[19]。我们通过对HCC 测序数据分析发现肝癌组织中miR-139-5p 相比正常组织中是显著上调的miRNA。而miR-139-5p 的过表达可以通过增加SLITRK4 通路表达来减少HCC 细胞的入侵和增殖能力[20],表明miR-139-5p 将成为肝细胞癌治疗的有效靶点。有证据表明miR-139-5p 调控的表观遗传因子HJURP高表达,促进了HCC 细胞的增殖,临床上,HJURP高表达与HCC 个体的不利预后相关[21]。PKM 在肝癌中的作用是增强糖解促进HCC 进展,主要机制是抑制了HCC 葡萄糖代谢重新编程、细胞增殖和转移[22,23]。因 此,PKM 的 高 表 达 促 进HCC 中 进 展。在本研究中,证实miR-139-5p 和靶向调控表观遗传因子HJURP 和PKM 在人类肝细胞癌的发生、发展中起到重要作用。因此,新识别的表观遗传因子HJURP 和PKM 可能成为肝细胞癌治疗的新靶点。
此外,乙型肝炎病毒(hepatitis B virus,HBV)可以通过抑制其启动子的活性来抑制miR-101-3p 表达,在HCC 中miR-101-3p 相比正常组织明显低表达[24]。而特定miR-101-3p 抑制剂能增强HCC 的细胞 增 殖、转 移 和 入 侵 能 力[25,26]。miR-101-3p 靶 向 的表观因子EZH2 在HCC 中是最显著地解除调节之一,EZH2 的上调与HCC 进展和转移密切相关[27]。此外,肝细胞癌中CHEK1 过表达导致HCC 患者的整体存活率(OS)较差[28]。在本研究中,HCC 中miRNA-101-3p 表达上调且患者预后较差。此外,其靶向表观因子EZH2 和CHEK1 表达上调患者预后较差,证实miR-101-3p 和靶向调控表观遗传因子EZH2 和CHEK1 在人HCC 的病因中具有重要作用。
本研究中miR-7-5p 的发现扩展了在癌症发展过程中对转录后表观因子调控的认识。众所周知,miR-7-5p 可以直接被长非编码RNA(lncRNA)RUSC1-AS1 结合,促进HCC 细胞的增殖并减少凋亡。在肝细胞中表达上调可以促进HCC 在体内发生和发展[29],这意味着miR-7-5p 在肝细胞癌发展过程中起到至关重要的作用。虽然,没有发现miR-7-5p 靶向表观因子与HCC 预后显著相关。但是,我们推测它们在肝细胞癌的发生、发展过程中的作用不可忽视。
虽然在调节蛋白质编码基因表达中认识到miRNA 的重要性,目前miRNA 的精确功能仍然难以确定。但是,miRNA 在人类致癌物质中却起着重要的作用。大量的研究发现miRNA 可以协同作用于靶基因,关注miRNA 与靶基因之间的相互作用可能更真实地捕捉到肝癌的潜在病理机制。在本研究中,成功构建的miRNA 靶向DEEFs 的调控网络,揭示了在HCC 中存在差异表达的miRNA 与HCC 预后关系。其中与肿瘤抑制剂相关的miR-139-5p 和miR-101-3p 在肿瘤发生、发展和转移过程中被降低表达,可能是潜在的治疗靶点。相反,与癌症基因相关的miR-7-5p 高表达可能促进HCC 的进展。在正常细胞中miRNA 调节各种生物过程受到严格监控[30]。 每个miRNA 都有可能通过各种调节器独立控制表观遗传调控[31-33]。 因此,构建miR⁃NA 靶向差异表观因子的调控网络,揭示了肝细胞癌表观遗传学上复杂的调控机制,有助于加深HCC中miRNA 对表观遗传基因调控机制的研究。
作者贡献度说明:
实验设计:张海航、卢彦达。实验实施:张海航、曾江正、朱旭、孙华茂、杨璐、付裕。实验评估:张海航。审校:卢彦达。
