枸骨果多糖的分离纯化和单糖分析及抗氧化特性
2022-07-04田俊雅刘克海
田俊雅,刘克海,2
(1.上海海洋大学食品学院,上海 201306;2.上海水产品加工及贮藏工程技术研究中心,上海 201306)
枸骨(Ilexcornuta)为冬青属常绿灌木,分布广泛[1],含有多种生物活性成分,如多糖、三萜、皂苷、黄酮等,具有抑菌、降血脂和消炎等功效[2-4]。其叶常被用作苦丁茶供人们饮用,根、果均可药用,目前关于枸骨的研究主要集中于根、叶,而果实较少,尤其是其多糖组分。多糖通常源于动植物和微生物,是重要的大分子活性物质,具有抗氧化、抑菌、抗肿瘤和降血糖等作用,本文对枸骨果中多糖进行提取并评价其抗氧化活性。多糖提取常用水提醇沉法,但其存在能耗高、费时、提取率低等缺点[5-6],而利用超声波空化作用的超声辅助提取可提高多糖提取效率[7]。陈鑫等[8]使用超声波辅助提取金针菇多糖,缩短了提取时间并提高了提取率。响应曲面法(response surface methodology,RSM)广泛用于提取条件优化,可从多种因素中高效确定最佳工艺[9]。多糖的分离纯化是研究其性质和活性的基础[10],目前柱层析是常用的手段,其中阴离子交换法及凝胶色谱法常用于多糖的分级纯化[11],具有可回收、易操作和分离度好等优点。本研究以枸骨果为原料,通过响应面优化超声辅助提取粗多糖工艺,经柱层析分级纯化,得到均一酸性多糖,进而考察其理化性质与抗氧化活性,以期为枸骨果开发提供试验数据。
1 材料与方法
1.1 材料与试剂
枸骨果(购买自安徽省亳州市),洗净,烘干至恒质量,锤碎备用;文中所用化学试剂均为分析纯;DEAE-52 纤维素阴离子交换柱(DEAE-52)、Sephadex G-100(G-100,上海兰拓生物科技有限公司)。
1.2 仪器
氮吹仪,杭州瑞诚仪器有限公司;冷冻干燥机,Thermo Savant公司;恒温水浴锅,上海仪电精密仪器有限公司;TG20G型离心机,上海颜麒生物科技有限公司;紫外分光光度计,青岛聚创环保集团有限公司;RE3000-D旋转蒸发仪,深圳市三莉科技有限公司。
1.3 试验方法
1.3.1 枸骨果多糖提取、纯化工艺流程
1.3.2 粗多糖提取 恒温干燥箱60 ℃烘干枸骨果至恒质量,称取适量,加入10倍体积的蒸馏水,超声恒温(60 ℃,1 h)浸提,滤液减压浓缩。浓缩液与无水乙醇按1∶3的比例混合,混合液在4 ℃条件下静置12 h后8 000 r/min离心10 min得到多糖沉淀,沉淀使用冷冻干燥机冻干48 h得枸骨果粗多糖。
1.3.3 单因素试验设计 参考文献[12-13]利用超声辅助方法考察超声时间、超声温度和液料比对枸骨果多糖得率的影响。按(1)式计算枸骨果多糖得率:
W(%)=(m/M)×100%
(1)
式中:W,多糖得率,%;m,多糖质量,mg;M,枸骨果质量,mg。
1.3.4 响应面法优化试验设计 以单因素试验为依据,选择三因素三水平进行响应面试验,测定各试验条件对多糖得率的影响,利用Design-Experter软件进行回归分析,确定枸骨果多糖最佳提取工艺条件。
在单因素试验基础上,按照Box-Behnken原理设计试验,研究三因素三水平对多糖得率的影响,因素与水平设计见表1。

表1 响应面分析的因素与水平
1.3.5 粗多糖分离、纯化 取适量粗多糖溶于蒸馏水,加入适量20%三氯乙酸溶液,使其终浓度为3%,搅拌均匀,混合液在4 ℃静置12 h后离心(5 000 r/min,10 min),上清液浓缩、冻干。采用DEAE-52柱分离粗多糖,配制1 mg/mL的多糖溶液上样,用氯化钠溶液(0,0.1,0.3,0.5 mol/L)依次洗脱,苯酚-硫酸法测吸光度,绘制曲线,收集多糖组分。使用G-100对多糖组分进一步纯化,同理,收集洗脱液,浓缩、透析、冻干,即为枸骨果均一多糖(LCFP-3)。
1.3.6 含量测定 采用苯酚-硫酸法测定LCFP-3中总糖含量[14],BCA(bicinchoninic acid)法测其蛋白含量[15]。
1.3.7 分子量测定 精确称取5 mg LCFP-3用0.1 mol/L的硝酸钠配制成5 mg/mL的溶液,上清液过0.45 μm滤膜,GPC法测其相对分子量。色谱条件:WATERS 2414示差折光检测器,WATERS凝胶色谱柱*3,聚乙二醇(PEG)作为标准品,流动相为0.1 mol/L的硝酸钠水溶液,流速为1 mL/min,进样量为100 μL,柱子方向为正向,柱子及检测器温度为40℃。
1.3.8 单糖组成测定 取2 mg LCFP-3溶于3 mL三氟乙酸溶液(2 mol/L),110 ℃反应4 h后氮气吹干,加入3 mL甲醇,氮气吹干,重复4~5次,加水1~2 mL溶解并洗净瓶子,25 mL容量瓶定容,样品保存在4 ℃冰箱等待上样。
上机条件:Dionex公司生产的ICS-2500离子色谱仪,分析柱的型号为CarboPacPA20,脉冲安培检测器,480 mmol/L NaOH为流动相(0.45 mL/min,30 ℃),25 μL待测样品。海藻糖(fucose)、鼠李糖(rhamnose)、阿拉伯糖(arabinose)、葡萄糖胺(glucosamine)、半乳糖(galactose)、葡萄糖(glucose)、木糖(xylose)、甘露糖(mannose)、果糖(fructose)、半乳糖醛酸(GalA)、葡萄糖醛酸(GluA)作为标品,绘制标准曲线。
1.3.9 DPPH自由基清除率的测定 参考张曼等[16]所述试验方法,配制0.04 mg/mL的DPPH-乙醇溶液和不同浓度LCFP-3溶液(0.1、0.5、1.0、2.0、4.0、8.0 mg/mL)。向不同浓度的LCFP-3溶液(70 μL)中加入180 μL DPPH-乙醇溶液,避光反应15 min,517 nm测吸光值作为试验组,DPPH溶液为空白组,按式(2)计算DPPH自由基清除率:
M(%)=(1-A1/A0)×100%
(2)
式中:M,为自由基清除率,%;A1,样品组吸光度,Abs;A0,空白组吸光度,Abs。
以不同质量浓度的LCFP-3对DPPH自由基清除率作图,并进行线性拟合,计算IC50值(自由基清除率为50%时,LCFP-3的质量浓度),以IC50值作为评价待测液抗氧化能力指标。
1.3.10 总还原能力的测定 参考龚文静等[17]所述试验方法测定总还原力。取1 mL不同浓度的LCFP-3溶液(3、6、10、15、20、25 mg/mL)与试管,每个浓度做3个平行,依次加入2.5 mL的磷酸盐缓冲液(0.2 mol/L,pH 6.6)和2.5 mL 1%六氰合铁钾溶液,在50℃的水浴锅保温20 min后快速冷却,加入2.5 mL 10%的三氯乙酸溶液,3 000 r/min离心10 min,取5.0 mL上清液,依次加入5.0 mL蒸馏水和1.0 mL 0.1%FeCl3溶液,静置10 min,以蒸馏水为空白对照,在700 nm处测吸光值。
2 结果与分析
2.1 单因素试验结果
由图2-A可知,在30~60 ℃范围内,多糖得率随超声温度的升高而增加,这源于温度升高加速多糖溶出,随后多糖得率出现下降趋势,可能由于超声和高温共同作用,致使多糖降解[18]。图2-B中在20~50 min范围内,多糖得率随超声时间的延长而逐渐提高,超过50 min,多糖得率增幅减缓,考虑减少经济负担,将超声时间定为50 min。如图2-C所示,加大液料比可增加溶液与样品接触面积,利于多糖溶出,但超过25 mL/g时,多糖在水中含量达到饱和,故多糖得率增加缓慢[19]。
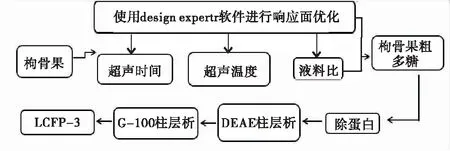
图1 多糖提取、纯化工艺流程

图2 单因素对多糖得率得影响
2.2 响应面法优化枸骨果多糖提取工艺
2.2.1 响应面试验设计及结果 以单因素试验为基础,根据Box-Benhnken试验设计进行17组试验,结果如表2。每个试验3组平行,取3次多糖得率的平均值代入表2,对超声时间(A)、超声温度(B)、液料比(C)进行多元回归拟合,得到方程:

表2 响应面法试验设计及结果
Y=0.086A+0.081B+0.080C+0.011AB-6.941E-003AC-6.185E-003BC-0.17A2-0.17B2-0.16C2+1.54

2.2.3 响应面模型分析 各因素交互作用的三维响应面图及等高线如图3所示。从表3的P值和图3可知,A和B间的交互作用为显著水平(P<0.05)。多糖提取率呈现先增加后下降的趋势,与实际试验结果一致。通过C和A、C和B在图3中响应面的坡度和等高线的形状以及表3中P值均大于0.05、,说明AC、BC之间的交互作用不显著。

表3 回归模型方差分析

图3 各因素交互影响的响应面和等高线图
根据回归模型分析,得到最优工艺条件为超声时间52.59 min、超声温度62.48 ℃、液料比26.19∶1(mL∶g),多糖得率2.47%。为了实际操作便利,将超声提取时间、超声提取温度、液料比分别设定为53 min、63 ℃、26∶1(mL∶g),测得得率为2.36%,与模型得出的结果相近,表明该最佳提取工艺可行。如表4所示,与传统水提法比,超声法可提高多糖得率,减少提取时间。

表4 超声法与水提法比较
2.3 枸骨果多糖的分离、纯化
如图4所示,在氯化钠0.3 mol/L浓度下的多糖组分其吸光度明显高于其它组分,说明多糖主要集中在该洗脱液中,因此,收集该洗脱液并对其进行浓缩透析后,使用G-100进一步纯化,得到单一对称峰,收集后浓缩,透析,冻干即得枸骨果纯化多糖LCFP-3(图5)。
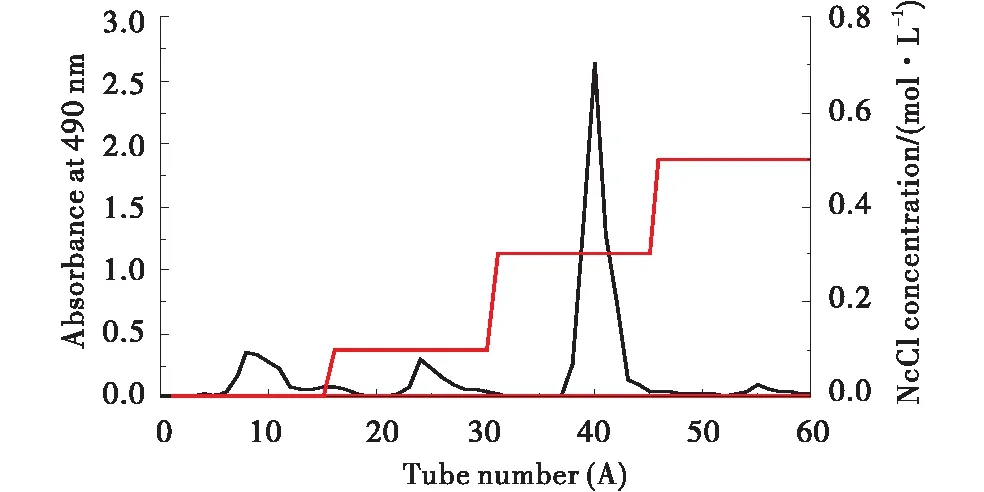
图4 粗多糖经DEAE-52分离

图5 多糖经G-100纯化
2.4 总糖含量及分子量
LCFP-3采用苯酚-硫酸法测定总糖含量为90.31%,BCA法测定蛋白质含量为0.246%,表明多糖纯化效果较好,进一步通过GPC测定其分子量,如图6所示,GPC洗脱峰为单一对称的曲线,无杂峰,其重均分子量(Mw)为41 199 U,数均分子量(Mn)为21 704 U,分散系数为1.898,说明其均一性相对较好。

图6 多糖的相对分子量
2.5 单糖组成
如图7所示,经高效阴离子色谱分析可知,枸骨果多糖主要含有半乳糖(31.92%)、阿拉伯糖(25.87%)、半乳糖醛酸(23.35%)并含有少量鼠李糖(6.43%)、葡萄糖(6.26%)、甘露糖(3.69%)和木糖(2.48%)。此外,位于7-GalA左侧的高峰为溶剂峰即水峰。

采用HPAEC分析得到LCFP-3的单糖组成。Rha,鼠李糖;Ara,阿拉伯糖;Xyl,木糖;Man,甘露糖;Glu,葡萄糖;Gal,半乳糖;GalA,半乳糖醛酸。
2.6 DPPH自由基清除率
由图8可知,在3.125~50 mg/mL浓度范围内,LCFP-3对DPPH自由基清除率逐渐增大。当浓度达到50 mg/mL时,LCFP-3对DPPH的清除率约为79.0%。在3.125~19 mg/mL浓度范围内,LCFP-3对DPPH自由基的清除率的线性回归方程为:y=4.18x-12.404,R2=0.995 1(图9所示)。由线性回归方程计算得出枸骨果多糖清除DPPH自由基的IC50值为(14.929±0.131)mg/mL,表明LCFP-3具有较好的清除DPPH自由基能力。
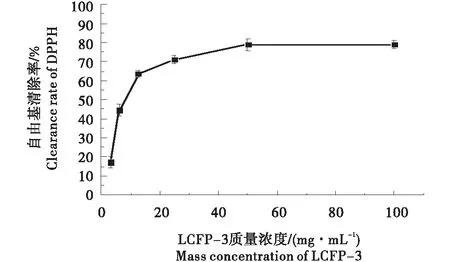
图8 多糖清除自由基反应曲线

图9 多糖浓度对DPPH清除率的线性拟合
2.7 总还原力测定
抗氧化剂具有强的还原力,可以使体内三价铁还原成二价铁,从而增强血红蛋白的运氧能力,也可以与自由基反应,减轻自由基对人体的损害。如图10所示,吸光度随LCFP-3浓度的增加而逐渐升高,在3~25 mg/mL范围内具有线性关系,线性拟合方程为y=0.023 1x+0.042 63,R2=0.998 8,表明其可作为抗氧化剂提供电子,具有较强还原性。如图11可知,还原力与DPPH自由基清除率作为LCFP-3抗氧化活性的两个指标,二者相关系数为R2=0.992 8,表明相关性良好。

图10 多糖的总还原能力

图11 还原力与DPPH自由基清除率的相关性
3 讨论与结论
本文通过超声辅助、单因素试验以及正交试验法对枸骨果多糖提取方法进行优化,得出最佳提取工艺为超声时间53 min、超声温度63 ℃、液料比26∶1(mL∶g)。通过柱层析法首次从枸骨果中分离纯化得到均一多糖LCFP-3,其总糖含量为90.31%,其单糖主要为半乳糖、阿拉伯糖、半乳糖醛酸,并含有少量鼠李糖、葡萄糖、甘露糖和木糖。单糖组成是多糖重要的理化性质,对多糖生物活性有直接影响,如糖醛酸残基可改变多糖缀合物的理化性质和溶解度,进而影响其活性,有文献报道富含糖醛酸的多糖具有更高的抗氧化活性[20]。LCFP-3糖醛酸含量较高,具有发展为抗氧化剂的潜能。多糖作为天然的抗氧化剂,其含有多个羟基可作为良好的电子或氢原子供体中和自由基、活性氧(ROS)或氮形态(RNS)[21]。抗氧化剂的作用机理主要包括消除活性自由基、消除非活性氧化因子和结合金属离子等[22],其中DPPH自由基清除能力和总还原力的测定是研究多糖体外抗氧化常用的试验方法[23-24]。本研究发现LCFP-3在浓度3~25 mg/mL范围内与还原力存在量效关系,并与DPPH自由基清除率具有良好相关性,表明其具有良好抗氧化活性。氧化应激(OS)产生的自由基、ROS和RNS与许多疾病密切相关,尤其是慢性退行性疾病(CDD),如癌症、糖尿病、心血管疾病和肥胖症等[25-26],因此,评价LCFP-3抗氧化活性可为研究其辅助抗肿瘤、降血糖及降血脂等功能奠定基础,从而进一步开发为功能性基料。
