新鲜当归采后青霉病病原菌分离鉴定、生物学特性及毒素积累
2022-07-04杨董云吕丙钰薛华丽杨志敏
杨董云,吕丙钰,薛华丽,杨志敏
(1.甘肃农业大学理学院,甘肃 兰州 730070;2.兰州市食品药品检验检测研究院,甘肃 兰州 730000)
当归为伞形科植物当归Angelicasinensis(Oliv.)Diels的根,在《神农本草经》中被列为中品,具有广泛的药用价值,素有“十方九归”的美誉[1-2]。可入肝、心、脾经,药性甘、辛、温,主要用于血虚萎黄、眩晕心悸、月经不调、经闭痛经、肠燥便秘等症状[3]。当归主产于我国甘肃东南部,其中以岷县当归产量多、品质好。当归在甘肃岷县的人工种植已有近2000年的历史,是甘肃道地药材之一,占全国产量、销量的90%以上[4]。
近年来随着当归种植规模的不断扩大,当归病害日益严重。目前当归病害研究主要集中在采前田间生长阶段,如当归腐烂茎线虫病、根腐病、褐斑病、菌核病、炭疽病、锈病和白粉病等[5],而采后贮藏期间病害研究鲜见报道,对于当归采后青霉病研究,陈娟从江西药材市场的中草药饮片中分离出皮落青霉(Penicilliumcrustosum)、鲜绿青霉(P.viridicatum)、橘灰青霉(P.aurantiogriseum)等青霉属病原菌,但未对病原菌的生物学特性及其毒素积累报道[6],同时,中药饮片与新鲜药材原材料上存在差异。当归采收时间正值深秋,低温高湿,且采后主要放在田间或农民家里自然晾干,在晾晒过程中由于温湿度不当,使当归极易发生腐烂、发霉,通常农民对发生霉变的组织进行简单的清洗。然而,众所周知,有一部分病原真菌在适宜的温湿度条件下会代谢产生真菌毒素,这不仅严重降低当归药材的使用价值,还会给人类健康带来巨大的安全隐患与威胁。所以,即使当归田间病害得到了有效的控制,而采后贮藏期间发病,仍然会前功尽弃。因此,对当归采后贮藏期间病害研究显得尤为重要。
本试验拟从新鲜当归采后贮藏期间具有典型的青霉病病害症状组织进行分离、平板划线,分离纯化得到引起当归青霉病的病原菌菌株,然后进行回接验证,根据科赫氏法则证明其分离菌的致病性,通过形态学和分子生物学技术对采后当归青霉病的病原菌进行鉴定,再从传统植物病理学角度对该病原菌进行生物学特性分析,以期为有效控制该病害提供理论依据并通过HPLC法对青霉病原菌侵染当归过程中积累的真菌毒素进行了分析。
1 材料与方法
1.1 材料与试剂
新鲜当归采购于甘肃省岷县药材种植基地,主要选取具有典型的青霉病病症和健康的新鲜当归,当日运抵甘肃农业大学理学院化学与生物学实验室。
1.2 培养基
供试培养基:PDA培养基(马铃薯200 g,葡萄糖20 g,琼脂17 g,水1 000 mL,自然pH)、查氏培养基(硝酸钠2 g、磷酸二氢钾1 g、氯化钾0.5 g、硫酸镁0.5 g、硫酸亚铁0.01 g、蔗糖30 g、琼脂15 g、水1 000 mL)。碳源培养基:以葡萄糖、麦芽糖、β-环糊精、甘露醇、果糖替代查氏培养基中蔗糖,其他相同;氮源培养基:以硫酸铵、酵母浸粉、蛋白胨、甘氨酸、尿素替代查氏培养基中硝酸钠,其他相同。
1.3 试验方法
1.3.1 病原菌分离 选取具有典型青霉病病害症状的新鲜当归,用灭菌的不锈钢刀片切取霉变当归病健交界处3 mm×3 mm大小的组织,置于75%酒精中清洗5 s,后用无菌水漂洗3次,晾干后置于PDA培养基上,于28 ℃培养箱中培养3~5 d。根据菌落形态对产生的真菌菌落进行分组,并随机选择特定组的代表性菌落在PDA平板上划线,反复进行传代培养,直至得到纯的分离株。
1.3.2 分离菌株回接试验 根据科赫氏法则,挑选无损伤、新鲜、健康的当归,用0.1%次氯酸钠溶液浸泡15 min,蒸馏水洗涤2次,室温下自然风干。将浓度为1×106CFU/mL的分离菌株孢子悬浮液以喷雾接种的方式,接种于已消毒的当归组织,观察并记录发病情况,30 d后从霉变组织中重新分离纯化菌种,并与第一次纯化的霉菌进行形态学对比是否一致,形态一致则确认其为致病菌。
1.3.3 病原菌形态学鉴定 将分离纯化后致病菌接种于PDA培养基上,25 ℃培养5 d,观察致病菌形态,记录菌落形态结构、颜色变化并测定其菌落大小。通过光学显微镜(40倍物镜下观察)进行观察菌丝体有无横隔膜,以及孢子囊的形态,以扫描电子显微镜观察致病菌孢子形态,参考真菌鉴定手册[7],鉴定病原菌种类。
1.3.4 病原菌分子生物学鉴定 将致病菌的孢子(1×106CFU/mL)接种在PDB培养基中,并在25 ℃下培养5 d。将过滤液体培养物收集真菌的菌丝体用液氮研磨成细粉。使用UNlQ-10柱真菌基因组DNA提取试剂盒(Sangon公司,中国上海)提取其DNA。
以上述提取DNA为模板,以ITS1(TCCGTAG-GTGAACCTGCGG)和ITS4(TCCTCCGCT-TATTGATATGC)为引物进行PCR扩增,扩增产物委托北京博迈德生物公司测序。将测序结果从GenBank数据库中进行BLAST比对分析,选取合适的序列,利用MEGA-7软件以邻接法构建系统发育树。结合分子生物学鉴定与形态学鉴定结果确定致病菌种属。
1.3.5 温度对致病菌生长的影响 PDA培养基上培养7 d的致病菌,刮取其孢子制成悬浮液(1×106CFU/mL),备用。
致死温度测定:上述致病菌孢子悬浮液分别置于35、45、50、55、60、65 ℃条件下恒温水浴15 min,取2 μL孢子悬浮液滴于PDA平板中心处,置于25 ℃恒温培养箱中培养7 d,观察菌落形态,并采用十字交叉法测定菌落直径[8]。
最适生长温度:取配制好的孢子悬浮液2 μL接种于PDA培养基中心处,分别置于15、20、25、30、35 ℃(每个温度梯度设置3个重复),恒温暗培养7 d,观察菌落形态、测定菌落直径,并以血球计数板测定产孢量。
1.3.6 pH对致病菌生长的影响 用HCl与NaOH溶液调节PDA培养基pH值分别至5、6、7、8、9、11,分别将2 μL致病菌孢子悬浮液接种于6个pH梯度PDA平板中心处(每个pH梯度设置3个重复),25 ℃恒温暗培养7 d,观察菌落形态、测定菌落直径和产孢量。
1.3.7 光照对致病菌生长的影响 将2 μL致病菌孢子悬浮液接种于PDA平板中心处,分别置于12 h光照、12 h黑暗交替环境中(设置3个重复),25 ℃恒温培养7 d,观察菌落形态、测定菌落直径和产孢量。
1.3.8 不同碳源对致病菌生长的影响 分别以葡萄糖、麦芽糖、β-环糊精、甘露醇、果糖为不同碳源,查氏培养基为对照组,将2 μL致病菌孢子悬浮液接种于上述碳源培养基中(设置3个重复),25 ℃恒温暗培养7 d,观察菌落形态、测定菌落直径和产孢量。
1.3.9 不同氮源对致病菌生长的影响 分别以硫酸铵、酵母浸粉、蛋白胨、甘氨酸、尿素为不同氮源,查氏培养基为对照组,将2 μL致病菌孢子悬浮液接种于上述氮源培养基上(设置3个重复),25 ℃黑暗恒温培养7 d,观察菌落形态、测定菌落直径和产孢量。
1.3.10 棒曲霉素含量的测定 根据《食品安全国家标准食品中展青霉素的测定GB 5009.185-2016》测定棒曲霉素[9],取回接当归青霉病致病菌30 d后的病部组织,液氮研磨,称取当归研磨的粉末5.0 g,置于离心管中,加入20 mL乙酸乙酯于离心机中离心(5 000 r/min,4 ℃,5 min),重复3次,合并提取液于烧瓶中,于40 ℃下旋转蒸发至近干,氮气吹干,2 mL pH为4的乙酸复溶,0.45 μm微孔滤膜过滤,样液进行高效液相色谱进行检测[10]。
2 结果与分析
2.1 病原菌的分离和致病性分析
通过组织分离法从霉变新鲜当归组织(图1-A)中分离纯化得到1株青霉菌,命名yang2。根据科赫氏法则进行回接试验,结果表明yang2分离菌回接的当归均有不同程度的病变(图1-B),取霉变部位与正常部位交界处组织进行分离纯化菌株,结果表明,重新分离菌株与yang2菌株形态特征一致,因此yang2为当归采后青霉病的主要致病菌。
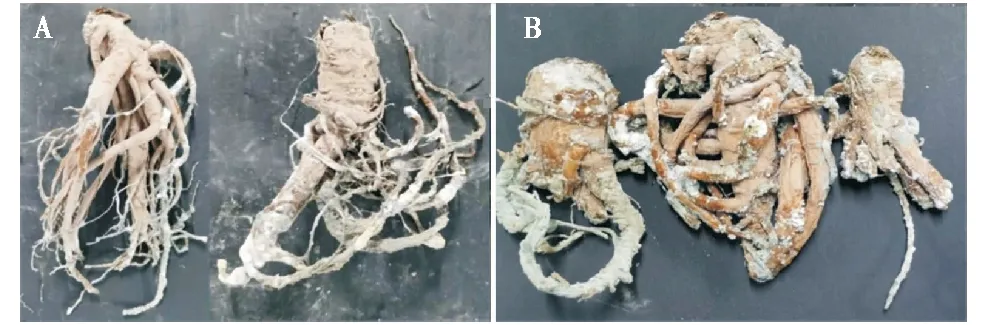
A:当归自然发病的症状;B:致病性检测病害症状。
2.2 霉菌鉴定
2.2.1 形态学鉴定 根据形态学特征进行鉴定,yang2在PDA培养基上的菌落形态如图2-A~B所示。并对其分生孢子梗(图2-C)和孢子形态(图2-D)进行观察。25 ℃ 培养5 d,平均菌落直径26.6 mm,菌丝体边缘为白色,放射状皱纹,正面呈深绿色,反面呈黄褐色,分生孢子梗为扫帚状,分生孢子呈念珠状串生,单孢无色,近球形,初步鉴定yang2为波兰青霉(Penicilliumpolonicum)。
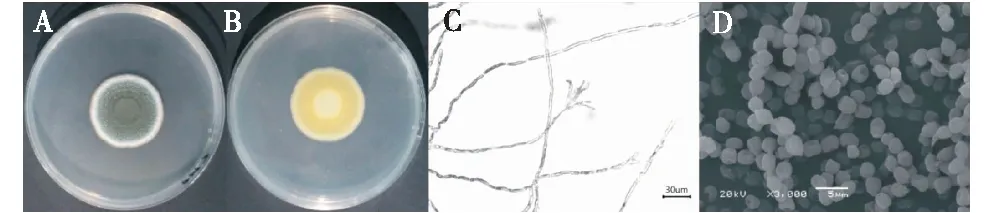
A:菌落形态(正面;B:菌落形态(反面);C:分生孢子梗形态;D:孢子形态。
2.2.2 分子生物学鉴定 形态学鉴定初步确定yang2为波兰青霉,经过ITS通用引物进行PCR扩增,所得电泳图如图3所示,分子量为589 bp,对所得扩增序列进行测序,所得结果在NCBI上进行BLAST比对分析,选取合适序列,利用MEGA-7软件以邻接法构建系统发育树(图4)。结果表明,yang2与波兰青霉同源性为95%,结合形态学鉴定结果,确定yang2为青霉属的波兰青霉(Penicilliumpolonicum)。
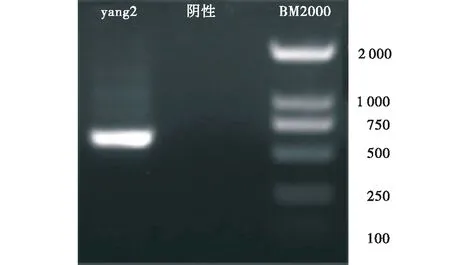
图3 yang2 ITS序列扩增结果

图4 yang2 基于ITS序列构建系统发育树
2.3 病原菌生物学特性分析
2.3.1 波兰青霉致死温度影响 由图5可知,波兰青霉在35~55 ℃均能正常生长,在60 ℃时,生长受到抑制,而在65 ℃时不再生长,故波兰青霉的致死温度为65 ℃。

图5 波兰青霉致死温度
2.3.2 温度对波兰青霉生长的影响 温度对微生物的生长发育以及代谢具有显著的影响,结果表明,波兰青霉在15~35 ℃均能生长,其中在35 ℃时生长缓慢,最适生长的温度范围为20~25 ℃(图6-A),且25 ℃与20 ℃生长差异不显著;波兰青霉在15~35 ℃均能产孢,而在25 ℃时产孢量最高,显著高于其他温度,而在15 ℃与35 ℃时产孢量远低于其他温度条件下(图6-B)。

图6 温度对波兰青霉菌丝生长和产孢的影响
2.3.3 pH对波兰青霉生长的影响 pH对波兰青霉的生长具有显著影响,由图7-A可知,波兰青霉在pH为5~11均能生长,但在过酸或过碱的条件下波兰青霉的生长明显较慢,而在pH为7时的菌丝生长显著高于其他pH条件;pH对波兰青霉产孢量的影响如图7-B所示,波兰青霉在pH 5~11均能产孢,而在pH为7时产孢量最高。综上所述,当pH为7时波兰青霉最适生长和产孢。

图7 pH对波兰青霉菌丝生长和产孢的影响
2.3.4 光照对波兰青霉生长的影响 光照对波兰青霉生长具有显著的影响(图8-A),在黑暗条件下,波兰青霉生长最好,12小时光暗交替次之,光照条件下生长最为缓慢;对波兰青霉产孢而言(图8-B),光照也是抑制其产孢,黑暗条件产孢量最高,而光照条件下产孢量最低,且光照对产孢量的抑制极为显著,光暗交替条件下生长速度与光照条件下差异不明显,显著低于黑暗条件生长情况。综上所述,光照会显著抑制波兰青霉的生长和产孢。

图8 光照条件对波兰青霉菌丝生长和产孢的影响
2.3.5 碳源对波兰青霉生长的影响 不同碳源对波兰青霉的菌丝生长的影响如图9-A所示,在6种不同碳源的培养基中,波兰青霉均能正常生长,其中麦芽糖作为碳源时波兰青霉菌丝生长最好,其次为β-环糊精、甘露醇均显著高于其他碳源,而蔗糖作为碳源时,菌丝生长最慢;而不同碳源对波兰青霉产孢量影响(图9-A)所示,蔗糖作为碳源时产孢量最高,其次为麦芽糖、甘露醇,β-环糊精作为碳源时产孢量最低。综上所述,麦芽糖是波兰青霉生长的最适碳源,蔗糖是波兰青霉产孢的最适碳源。

图9 碳源对波兰青霉菌丝生长和产孢的影响
2.3.6 氮源对波兰青霉生长的影响 不同氮源对波兰青霉的影响显著,由图10-A可见,波兰青霉以蛋白胨为氮源时波兰青霉生长最好,其次酵母浸粉,两者显著高于其他4种氮源条件下的生长,其中尿素和硫酸铵作为氮源时生长最缓慢;而不同氮源对波兰青霉的产孢量影响(图10-B)结果表明,酵母浸粉作为氮源时产孢量最好,显著高于其他氮源的培养基,其中硫酸铵作为氮源时产孢量最低。综上所述,波兰青霉最适氮源为酵母浸粉。

图10 氮源对波兰青霉菌丝生长和产孢的影响
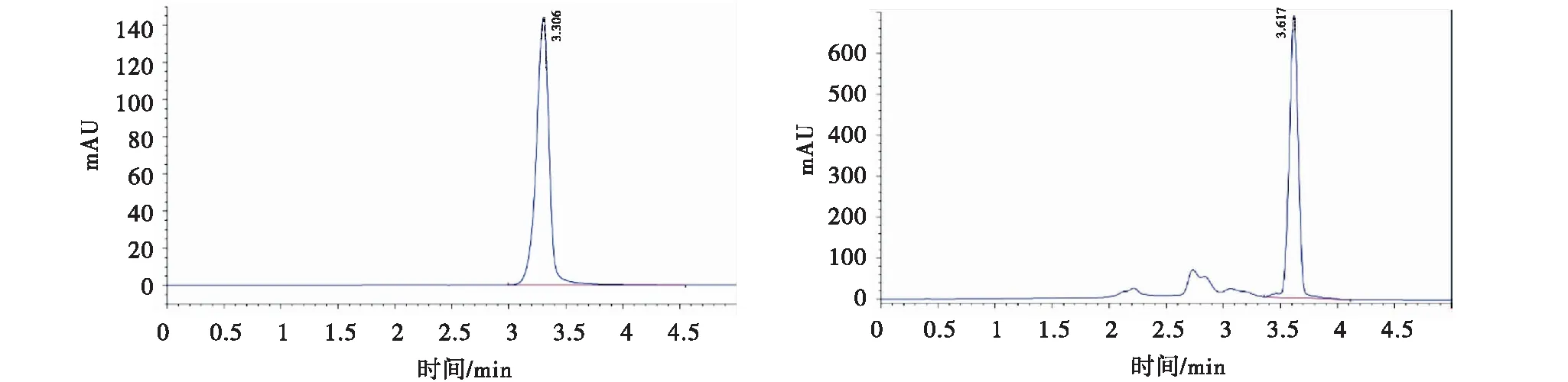
A:标品色谱图;B:青霉病当归组织中棒曲霉素色谱图。
2.4 青霉病当归组织中真菌毒素积累分析
据报道波兰青霉为棒曲霉素(patulin,PAT)产毒菌株[11],本研究对波兰青霉侵染采后新鲜当归的青霉病组织中产毒情况进行检测,发现波兰青霉侵染引起的青霉病当归组织中有棒曲霉素的积累,其含量为6.166 μg/g。
3 讨论
有关中草药的病害在国内外常有报道,如由黄芪白粉菌(Erysipheastragali)引起的黄芪的白粉病[12];由立枯丝核菌(Rhizoctoniasolani)、尖孢镰刀菌(Fusariumoxysporum)和腐皮镰刀菌(F.solani)引起的黄芪根腐病[13];由茄病镰刀菌(Fusariumsolani)和尖孢镰刀菌(Fusariumoxysporum)引起的甘草根腐病[14];由甘草尾孢、甘草单胞锈菌分别引起的甘草锈病、褐斑病等[15];由燕麦镰刀菌(F.avenaceum)和锐顶镰刀菌(F.acuminatum)所造成的岷县当归根腐病[16];由束状炭疽菌(Colletotrichumdematium)危害引起的当归炭疽病[17]等。然而,上述报道均属于田间病害,而采后贮藏期间病害研究鲜见报道,虽然陈娟从采后储藏期间的霉变的中药材饮片当归组织中分离出了皮落青霉(Penicilliumcrustosum)、鲜绿青霉(P.viridicatum)、橘灰青霉(P.aurantiogriseum)等病原菌[6],然而,药材饮片与新鲜药材在原料上存在差异,同时,该研究未对分离病原菌的生物学特性及毒素积累情况进行系统报道。
本研究对甘肃岷县新鲜当归采后贮藏期间青霉病病害的致病菌进行分离纯化、致病性检测,并通过形态学和分子生物学技术进行分析,确定引起新鲜当归采后青霉病的主要致病菌为波兰青霉(Penicilliumpolonicum)。
波兰青霉具有较广的寄主范围,如沙娜瓦尔·色买提从枣贮藏期的霉烂组织[18]、Duduk从洋葱贮藏期的青霉病病害组织[19]、及闵晓芳从柑橘青霉病病害组织中[20]均分离出波兰青霉(P.polonicum)。陈娟从霉变巴戟天、甘草的饮片上分离出P.polonicum等,但在当归霉变组织中并未分离出P.polonicum[6]。
波兰青霉的孢子致死温度较高,不易失活,在温度20~25 ℃、pH 7、黑暗、以麦芽糖为碳源、蛋白胨为氮源条件下菌丝生长最好:在温度25 ℃、pH 7、蔗糖为碳源、酵母浸粉为氮源时产孢量最高。冉隆贤从霉烂竹材中分离出的指状青霉在温度25 ℃、pH 5~6、葡萄糖和淀粉为碳源时生长最好[21];丁仁惠从霉变采后柑橘中分离的指状青霉在温度28~30 ℃、pH 6~7、葡萄糖为碳源时生长最好[22],并且没有差异性;郜海燕等发现,从蓝莓采后病害中分离出的波兰青霉在温度30 ℃、pH 9、果糖为碳源、蛋白胨为氮源条件下生长最好。由此表明,不同宿主青霉病病害组织中分离得到的病原菌种类不同,病原菌的生物学特性也存在显著差异。甘肃岷县地处甘肃省南部,青藏高原东麓与西秦岭陇南山地接壤区,境内海拔为2 200~3 872 m,10月底11月初正值该地区低温高湿季节,极有利于青霉菌类病原菌的生长与繁殖。
值得关注的是,本研究在波兰青霉侵染的霉变当归组织中检测到棒曲霉素的存在,含量为6.166 μg/g。棒曲霉素为曲霉属和青霉属等真菌产生的主要次生代谢产物[23-24],具有致畸、致癌、影响生育和免疫抑制等毒理作用[25]。谢芳超从阳信鸭梨腐败果中分离鉴定出波兰青霉,且伴有棒曲霉素的检出[11];苏青峰从浓缩苹果汁生产原料中也分离鉴定出波兰青霉,且同时有棒曲霉素的检出[26]。有关棒曲霉素的限量标准,不同国家标准不一,中国、美国及欧盟等国家规定果汁中棒曲霉素最大限量为50 μg/kg[27-28],其中欧盟对婴幼儿食品中棒曲霉素的最大限量规定为10 μg/kg[29],1995年联合国粮食农业组织(food and agriculture organization,FAO)规定每人每天棒曲霉素最大量摄入不超过0.4 μg/kg体质量[30]。而对中草药中棒曲霉素限量标准尚缺乏。
4 结论
新鲜当归采后青霉病的主要致病菌为波兰青霉(Penicilliumpolonicum),波兰青霉的孢子致死温度为65 ℃,在温度20~25 ℃、pH 7、以麦芽糖为碳源、蛋白胨为氮源时菌丝生长最好,而在温度25 ℃、pH 7、蔗糖为碳源、酵母浸粉为氮源时产孢量最高。在波兰青霉侵染鲜当归的过程中会积累棒曲霉素,其严重威胁人类的健康。本研究可为有效防治当归采后青霉病及当归中真菌毒素积累提供理论依据。
