塔里木裂腹鱼肾细胞系的建立及盐碱度对其增殖的影响
2022-07-04代金彩强壮杨敏魏杰聂竹兰
代金彩,强壮,杨敏,魏杰,聂竹兰
(1.塔里木大学动物科学学院,新疆生产建设兵团塔里木畜牧科技重点实验室,省部共建塔里木盆地生物资源保护利用国家重点实验室,新疆 阿拉尔 843300;2.塔里木大学生命科学学院,新疆 阿拉尔 843300;3.新疆生产建设兵团兴新职业技术学院,新疆 铁门关 841007)
塔里木裂腹鱼(Schizothoraxbiddulphi)俗称“尖嘴鱼”,是塔里木河水系的特有物种,曾广泛分布于阿克苏河、叶尔羌河、和田河、渭干河等[1-2]。近年来,由于生态环境变化、人为活动干扰、生长缓慢、性成熟晚及繁殖力低等因素的影响,塔里木裂腹鱼的种群数量急剧减少[3-4]。有关塔里木裂腹鱼的报道主要集中在地理分布[5]、形态特征[6]、繁殖特性[7]、线粒体DNA结构分析[8]、遗传标记开发[9]及遗传多样性[10]等方面。
鱼类肾脏的功能不仅具有泌尿作用,还具有造血功能和免疫调节的功能。肾是鱼体维持体内离子平衡,调节渗透压的重要器官,水体的盐碱度增加可使鱼类体内与外环境之间的渗透压差值逐渐升高,迫使鱼类调节渗透压,影响鱼类的肾组织等[11-12]。龙宏争等[13]研究发现,盐度对星斑川鲽(Platichthysstellatus)幼鱼肾细胞结构有明显的影响;党云飞[14]研究发现,大鳞鲃(Barbuscapito)幼鱼的肾脏在不同浓度的盐碱水环境中显微结构发生了明显的变化;张莹莹[15]建立了金钱鱼(Scatophagusargus)肾细胞系(SK)并从细胞水平对金钱鱼肾细胞在渗透压应激作用下的调节机制做了进一步分析;肾细胞可用于研究盐碱度对鱼类的生存影响,同时肾组织细胞被建立并应用于各个方面,如徐进[16]建立了斑点叉尾鮰(Lctaluruspuncatatus)肾脏细胞系(CCK)并应用于病毒的分离鉴定;Guo等[17]建立了黑鲤鱼(Procyprisrabaudi)肾细胞系(MPK)并应用于病毒的敏感性试验;张晓雨等[18]建立了松江鲈(Trachidermusfasciatus)肾细胞系并应用于病毒和镉离子敏感性试验,得出松江鲈可作为鲤春病毒血症病毒和镉离子检测的生物学指标。上述研究为鱼类肾组织细胞的研究提供了积极的技术借鉴。
本试验进行塔里木裂腹鱼肾细胞系的建立并研究NaCl盐度和NaHCO3碱度对其增殖的影响。细胞系的建立将对其环境毒理学、病毒的分离、细胞遗传学的研究提供基础研究材料。
1 材料与方法
1.1 试验材料
试验动物塔里木裂腹鱼取自克孜勒河,饲养在新疆建设兵团塔里木畜牧科技重点试验室。
1.2 试验试剂
DME/F12、L-15、MEM、RPMI-1640、M199培养基购自Hyclone公司;胎牛血清(FBS)购自Gibco公司;磷酸缓冲液(PBS)、青霉素-链霉素双抗、二甲基亚砜(DMSO)购自Solarbio公司;台盼蓝和0.25%胰酶购自Biotopped公司;MS-222购自渔夫宝公司;基因组DNA提取试剂盒购自天根生化科技有限公司;其他化学试剂均为分析纯。
1.3 试验方法
1.3.1 原代培养与传代培养 取健康塔里木裂腹鱼,置于高锰酸钾(20 mg/L)溶液中浸泡30 min,加入0.1 μL/g的MS-222麻醉剂麻醉后,致死。用75%的酒精对鱼体进行消毒,然后置于超净台上的解剖盘中。再取4个培养皿,其中一个放75%的酒精,另外3个分别加入添加500 IU/mL青霉素、500 μg/mL链霉素、12.5 μg/mL两性霉素B的PBS。解剖取鱼的肾组织放入酒精中30 s,然后依次放入另外3个培养皿中浸泡,之后将其放入2 mL无菌离心管中,并用无菌眼科剪将其剪成大约1~2 mm3的组织碎块,向其中加入500 μL的DME/F12培养液,将组织碎块移到25 mm2培养瓶中正相放入25 ℃、5%的CO2培养箱中,观察贴壁情况,4 h后反相放置,反相放置培养2 h后再向其中加入含20%FBS、500 IU/mL青霉素、500 μg/mL链霉素、12.5 μg/mL两性霉素B的1 mL DME/F12培养液正相放入25 ℃、5%的CO2培养箱中继续培养,12 h后加入9 mL的培养液继续正相放置培养。每天观察组织块迁移情况。
在进行原代培养的过程中,更换一次培养液的时间为2~4 d。当组织碎块周围迁出细胞,细胞浓度达106个/mL时按1∶2的比例进行传代。直到第5代后,青霉素、链霉素降低到200 IU/mL和200 μg/mL,FBS的浓度也降低到15%。到第8代后,培养液用含10% FBS和1% P/S的DME/F12培养液。
1.3.2 细胞生长曲线 将一定浓度的细胞接种到24孔细胞培养板,分成8组,每组6孔,接种一定浓度的细胞进行连续7 d的常规培养,用血球计数板进行计数,每天记一组,分析数据并绘制细胞生长曲线。细胞生长曲线的纵坐标为每天计数的细胞平均个数,时间为横坐标。根据公式计算出细胞的群体倍增时间。
T=t×lg2/lg(Nt/N0)
式中:Nt为时间t后的细胞数,N0接种细胞数[19]。
1.3.3 最佳培养基 检测DME/F12、M199、L-15、MEM、RPMI-1640 5种不同培养基维持细胞生长的能力。每种培养基中均补充10% FBS和1% P/S。分别将一定浓度的细胞接种在不同的培养基中,在25 ℃、5%的CO2条件下培养96 h,在5个时间点即0、24、48、72及96 h利用血球计数板进行细胞计数,绘制细胞的生长曲线。
1.3.4 最适培养温度 检测20、25、30和37 ℃不同温度对细胞生长的影响。所用培养液为含10% FBS和1% P/S的DME/F12培养液。在25 ℃、5%的CO2条件下培养96 h,在5个时间点即0、24、48、72及96 h利用血球计数板进行细胞计数,绘制细胞的生长曲线。
1.3.5 最适血清浓度 在确定最适合的培养液及最适合的温度条件下,其他条件一致的条件下,设置不同的FBS浓度为0、5%、10%和20%,在25 ℃、5%的CO2条件下培养,在5个时间点即0、24、48、72及96 h利用血球计数板进行细胞计数,绘制细胞的生长曲线。
1.3.6 细胞冻存与复苏 冻存:配制含20% FBS、70% DME/F12和10%二甲基亚砜(DMSO)的细胞冻存液预冷以备用。取生长旺盛的细胞,细胞浓度2.0×106个/mL,冻存。
复苏:取冻存细胞快速解冻,细胞转移至15 mL离心管,逐滴加入5倍体积的预冷培养液,悬浮细胞,离心弃上清,加入PBS重悬,再次离心弃上清,重复3次。加入适当培养液,取适量细胞采用台盼蓝染色,进行细胞计数并计算存活率,置于25 ℃、5% CO2培养箱中培养,细胞复苏36 h后需首次换液。
1.3.7 细胞污染鉴定 体外组织细胞培养很容易受到真菌、细菌、支原体的污染。真菌的种类繁多,肉眼可见,漂浮于培养液面上。细菌增殖快,在短时间内即可大量扩增,并产生毒素杀死细胞。支原体无致死毒性,可与细胞长期共存,对细胞有潜在影响,但体积小,不易鉴别。选用观察法与PCR法检测细胞是否被细菌、真菌、支原体污染。所用引物见表1。
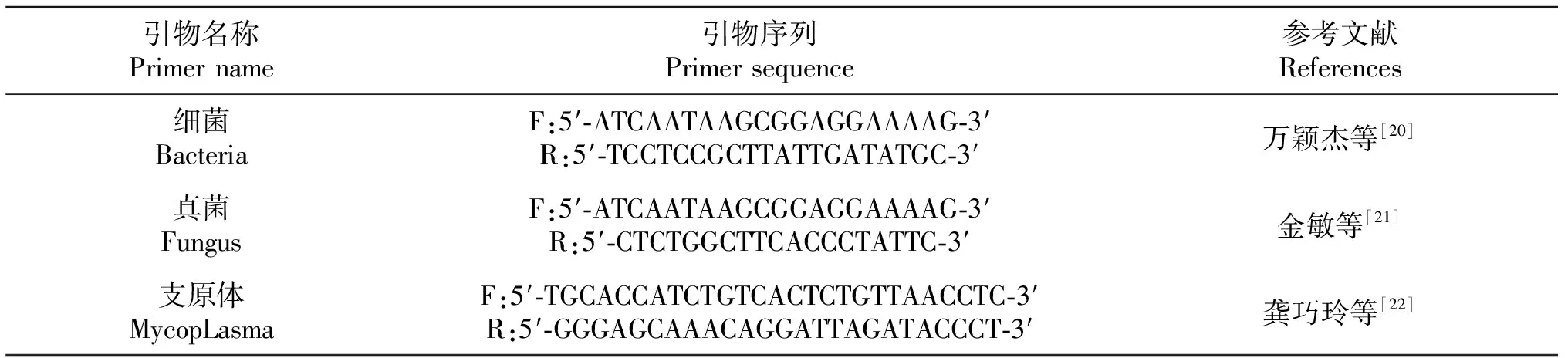
表1 通用引物序列
1.3.8 细胞来源鉴定 利用动物组织基因组DNA提取试剂盒(DP304)提取塔里木裂腹鱼肾组织细胞的基因组DNA。通过PCR(polymerase chain reaction)扩增提取DNA。根据塔里木裂腹鱼16srRNA设计引物,扩增引物为16sF和16sR(表2)。配置50 μL反应体系,其中含有25 μL 2×TaqPCR MasterMix,引物各2.5 μL,5 μL模板DNA,15 μL的灭菌超纯水。PCR反应条件为95 ℃预变性,3 min;循环反应35次,循环条件为94 ℃变性30 s,56.8 ℃退火30 s,72 ℃延伸40 s;72 ℃末轮延伸10 min。扩增反应结束后,取1 μL PCR产物在核酸蛋白检测仪上检测DNA的浓度;取8 μL PCR产物在1%琼脂糖凝胶中进行电泳检测。PCR产物测序,比较获得序列与GenBank已发表序列的一致率。
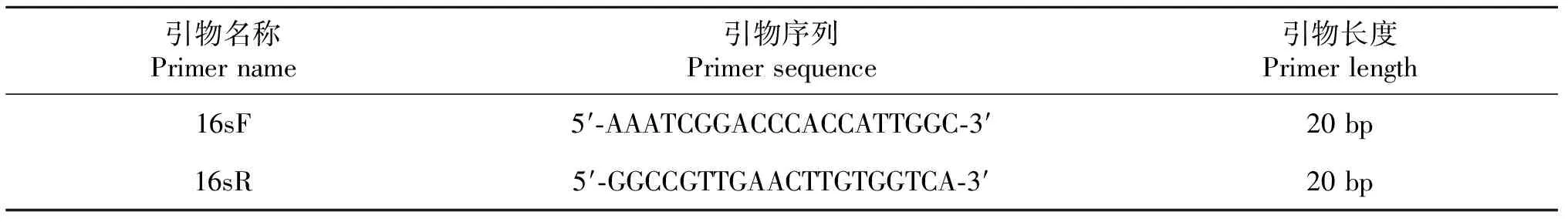
表2 16srRNA基因的PCR扩增和序列引物
1.3.9 塔里木裂腹鱼细胞系的应用(MTT细胞增殖试验) NaCl盐度设置1‰、2‰、4‰、6‰、8‰、10‰ 6个梯度。
NaHCO3碱度设置2、3、4、5、6、7、8、10 g/L 8个梯度。
细胞铺板:将对数生长期BIM14用含10%胎牛血清DME/F12培养液调整密度为1×104个/mL的细胞悬液,铺置于96孔细胞培养板上,每种材料铺6孔。每孔加入100 μL细胞悬液,25 ℃、5% CO2培养箱培养12 h后,按分组分别加入不同浓度盐碱,各孔20 μL,继续培养24、48、72 h。之后将每个含液体孔加入MTT 20 μL后继续培养4 h,小心吸出各孔内液体,后每孔加入150 μL二甲基亚砜。摇床摇培养板20 min,酶联免疫检测仪490 nm波长条件下测定各孔D值。通过计算得出细胞相对增殖率:

1.4 数据分析
2 结果与分析
2.1 塔里木裂腹鱼肾细胞原代培养与传代培养
观察塔里木裂腹鱼肾细胞每天的生长状态。1 d后的细胞贴壁,4 d后组织块周围逐渐有细胞迁出,9 d后细胞铺满细胞瓶70%,10 d后细胞出现悬浮现象,在13 d后进行传代(图1)。
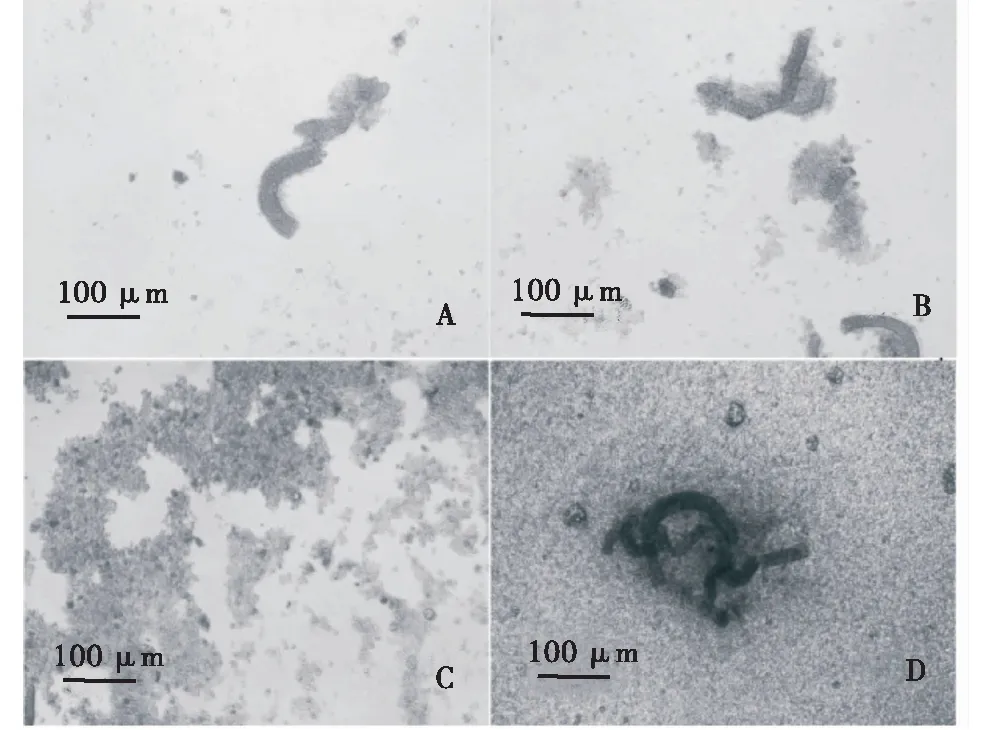
A、B、C、D分别为细胞原代培养1 d、4 d、9 d、10 d的细胞生长状态.
传代培养当细胞培养瓶中浓度达到106个/mL时,进行1∶2传代,每隔2~4 d传代1次。细胞呈悬浮生长,现已成功传至60代。
2.2 塔里木裂腹鱼肾细胞生长曲线
绘制塔里木裂腹鱼肾细胞系第10代细胞的生长曲线,细胞生长呈“S”型,0~1 d为潜伏期、1~2 d为指数生长期、2~5 d为平台期、5 d之后为衰退期(图2)。第10代肾细胞系细胞的群体倍增时间为16.80 h,细胞分裂旺盛。

图2 塔里木裂腹鱼肾组织细胞生长曲线
2.3 塔里木裂腹鱼肾细胞最佳培养基
塔里木裂腹鱼肾组织细胞在DME/F12、M199、L-15、MEM、RPMI-1640不同培养基中维持细胞生长的能力如图3所示,在M199、MEM及RPMI-1640培养基中细胞基本不生长,在L-15培养基中细胞生长缓慢,在DME/F12培养基中细胞生长最好,因此选择DME/F12培养基为最佳培养基。

图3 塔里木裂腹鱼肾组织细胞最佳培养基
2.4 塔里木裂腹鱼肾细胞最适培养温度
塔里木裂腹鱼肾细胞在37 ℃生长最慢,25 ℃生长最快,20 ℃生长较快,30 ℃生长较慢,在20~30 ℃范围内细胞皆能进行良性生长(图4),细胞生长的最适温度为25 ℃。
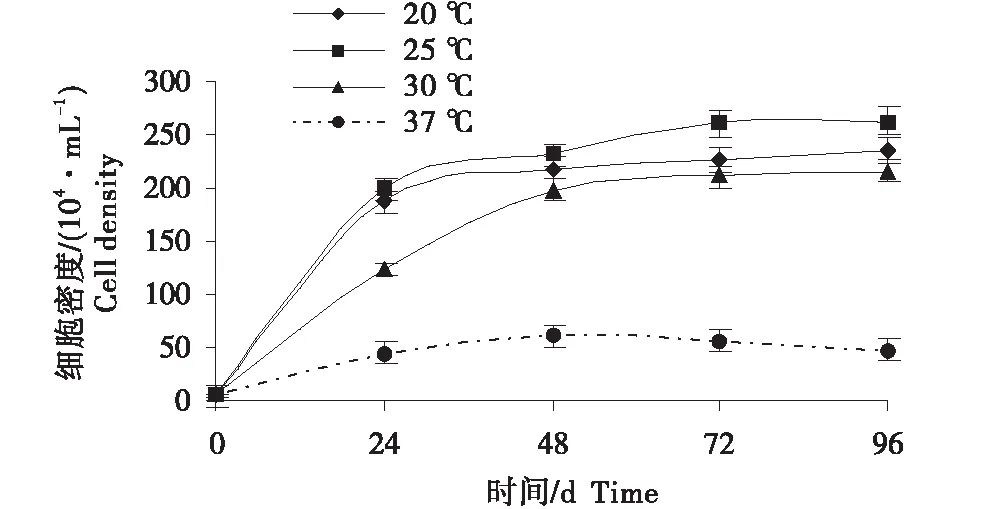
图4 塔里木裂腹鱼肾组织细胞最适培养温度
2.5 塔里木裂腹鱼肾细胞最适血清浓度
塔里木裂腹鱼肾细胞在未加血清的培养基中生长明显低于添加血清的细胞生长,随着血清浓度5%、10%、20%依次增大,细胞生长依次加快,当FBS浓度为20%时,细胞生长最快(图5)。

图5 塔里木裂腹鱼肾组织细胞最适血清浓度
2.6 塔里木裂腹鱼肾细胞冻存与复苏
塔里木裂腹鱼肾组织细胞对第6代细胞进行液氮冷冻保存40、90及180 d后复苏,经台盼蓝染色并计数统计,复苏存活率如表3所示,40 d后存活率为(96.01±0.74)%,90 d后存活率为(91.32±0.72)%,180 d后存活率为(91.13±0.72)%,90 d和180 d存活率差异不显著(P>0.05)(表3)。细胞具有活性,且复苏后增殖速度快(图6),可正常传代(图7)。

表3 冻存后复苏存活率

图6 MTT法测定复苏细胞增殖

A和B分别为细胞复苏后1 d和3 d的细胞生长状态.
2.7 塔里木裂腹鱼肾细胞污染与检测鉴定
塔里木裂腹鱼肾组织细胞中提取细菌、真菌、支原体,经过PCR法鉴定细菌、真菌、支原体污染。如图8所示,1、3、5泳道分别为细菌、真菌、支原体PCR产物阳性对照;2、4、6泳道分别为肾细胞中提取细菌、真菌、支原体PCR产物;样品均无与阳性对照组一致的条带,样品中无细菌、真菌、支原体,塔里木裂腹鱼肾组织细胞未被污染。

M泳道为2 000 bp Marker;1、3、5泳道分别为细菌、真菌、支原体PCR产物阳性对照;2、4、6泳道分别为肾细胞中提取细菌、真菌、支原体PCR产物.
2.8 塔里木裂腹鱼肾细胞来源鉴定
用基因组DNA试剂盒提取塔里木裂腹鱼肾组织细胞DNA,经PCR扩增,在琼脂糖凝胶中电泳检测,目的条带大小符合16srRNA的大小(图9)。经测序后的序列片段与数据库中的GenBank进行Blast比对。塔里木裂腹鱼肾组织细胞同源性与GenBank中发布的来源于塔里木裂腹鱼线粒体基因(JQ844133.1)的序列达到99.91%,序列在2606位有一个碱基缺失(图10),因此塔里木裂腹鱼肾组织细胞来自于塔里木裂腹鱼。

M泳道为2 000 bp Marker;1泳道为塔里木裂腹鱼肾组织细胞PCR产物.

灰色:不一致序列.
2.9 MTT法检测各组盐碱度对细胞增殖的影响
2.9.1 NaCl盐度对塔里木裂腹鱼肾细胞增殖的影响 相同NaCl浓度下,随时间的延长(24、48、72 h)BIM14相对增殖依次下降,NaCl盐度对BIM14的相对增殖的抑制可随时间延长而增强。在同一时间点上,NaCl盐度1‰、2‰、4‰、6‰依次使BIM14增殖上升,6‰、8‰、10‰依次使BIM14细胞增殖下降,6‰时BIM14增殖最高,BIM14增殖随NaCl盐度增加呈现先升高后下降的趋势(表4)。
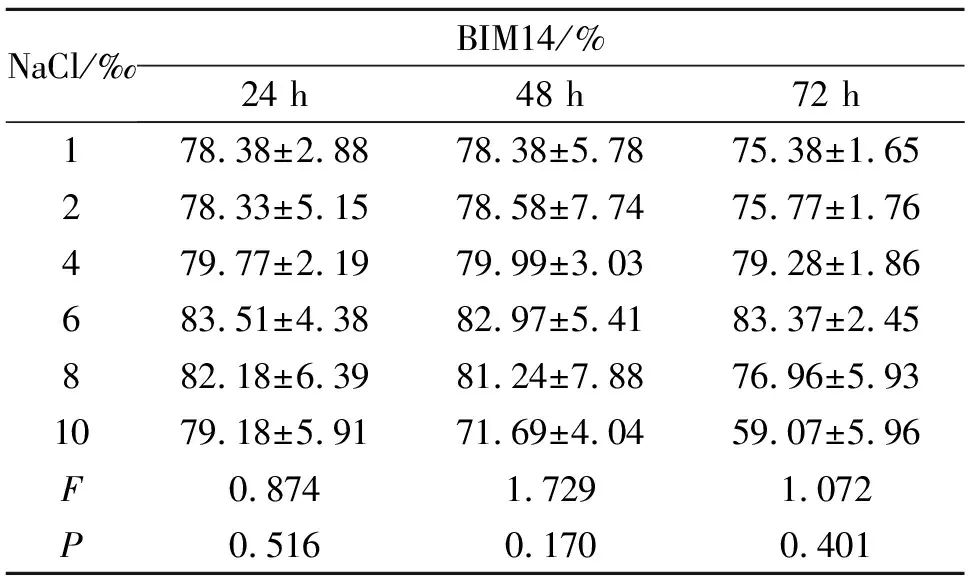
表4 NaCl盐度对BIM14细胞增殖的影响
2.9.2 NaHCO3碱度对塔里木裂腹鱼肾细胞增殖的影响 NaHCO3碱度对BIM14细胞的相对增殖在浓度一致情况下,BIM14细胞的增殖随时间的延长(24、48、72 h)依次下降,NaHCO3碱度对BIM14细胞的相对增殖的抑制可随时间延长而增强。在同一时间点上,NaHCO3碱度2、3、4、5、6 g/L依次使BICF1和BIM14细胞增殖上升,6、7、8、10 g/L依次使BICF1和BIM14细胞增殖下降,6 g/L使BICF1和BIM14细胞增殖最高,BICF1和BIM14细胞增殖随NaHCO3碱度增加呈现先升高后下降的趋势(表5)。

表5 NaHCO3碱度对BIM14细胞增殖的影响(M±SD)
3 讨论
本研究以塔里木裂腹鱼肾组织为材料,用组织块移植法成功启动了塔里木裂腹鱼肾组织细胞原代培养,命名为BIM14。BIM14在10% FBS的DME/F12培养液中生长良好。细胞培养常用的培养液有L-15、MEM、RPMI-1640和M199,但不同的鱼类对环境要求不尽相同,因此,不同鱼类的最适培养基亦不同。金鲳鱼(Trachinotusovatus)头肾细胞系(TOHK)[23]、大黄鱼(Pseudosciaenacrocea)头肾细胞系(LYCK)[24]、云纹石斑鱼(Epinephelusmoara)肾细胞系(EMK)[25]的最佳培养液均为L-15,而圆斑星鲽(Veraspervariegates)肾脏组织细胞系(SHK)的最佳培养液是MEM[26],罗非鱼(Oreochromisniloticus)肾脏组织细胞(TiK)最佳培养液是DMEM[27],本试验中使用DME/F12、L-15、MEM、RPMI-1640和M199培养基,得出DME/F12为最佳培养液。鱼类组织细胞生长温度范围和哺乳类组织细胞比较,范围比较广。BIM14在20~25 ℃均能正常生长,与已报道的鱼类细胞的温度适应范围是一致的[26],这与鱼类是变温动物有很大的关系。在0%、5%、10%、20%的FBS中生长时,未加FBS的细胞生长速度明显低于添加FBS的生长,在20%FBS时生长最快,FBS浓度对细胞生长有明显的影响,与已经报道的研究相似[23]。本研究测定了第10代BIM14生长曲线,呈“S”型生长曲线,1 d进入指数生长期,罗非鱼肾细胞(TiK)在2~5 d为指数生长期,5 d之后为平稳期,与罗非鱼肾细胞(TiK)[27]相比,BIM14进入指数生长期更快。
塔里木裂腹鱼BIM14呈悬浮生长。贴壁培养型的细胞,细胞膜表面含有大量黏附因子。这些黏附因子可激活不同的信号通路调节贴壁细胞的活性和增殖,如整合素(integrins)活化黏着斑激酶(focal adhesion kinase)激活信号通路抑制细胞内源性的凋亡[28]。悬浮培养的细胞一般为淋巴细胞等血液系统来源的细胞,这种细胞体积小,缺乏粘附分子的表达[29-30]。本课题组在对塔里木裂腹鱼BIM14染色体的制备中发现,用0.075 mol/L的KCl低渗时间达90 min。当其他条件一致,低渗时间是45 min时,染色体不分散,低渗时间达90 min时染色体才分散(图11)。有研究报道棕点石斑鱼(Epinephelusfuscoguttatus♀)×鞍带石斑鱼(Epinepheluslanceolatus♂)F1染色体制备中低渗时间25 min[31];鲤鱼染色体标本的制备中低渗的时间控制在35 min[32];黄颡(Pelteobagrusfulvidraco)染色体标本的制备中低渗的时间控制在40 min[33];灰海马(Hippocampuserectus)染色体标本的制备中低渗的时间为50 min[34];已报道的研究中低渗时间为25~50 min。因此,推测塔里木裂腹鱼BIM14细胞膜不易破裂,与BIM14细胞膜的坚韧程度有关。用物理方法进行贴壁型细胞的悬浮训化时使细胞产生失巢凋亡(Anoikis)[35],无血清与生物反应器训化使贴壁细胞产生失巢凋亡的拮抗。目前,MDCK[36],BHK-21[37],ST[38],PK15[39],Vero[40]等被训化。塔里木裂腹鱼BIM14培养中可能产生类似于失巢凋亡的调节。塔里木裂腹鱼肾细胞呈悬浮生长的状态,可能与其体积和细胞膜表面粘附分子的表达及细胞膜坚韧程度有关,也可能与类似于失巢凋亡的调节有关,具体原因有待于进一步研究。

A:KCl低渗45 min不分散染色体;B:KCl低渗90 min分散染色体.
细胞来源的鉴定通常采用16srRNA、12srRNA和Cytb等基因片段,其中16srRNA基因属于进化缓慢的保守序列,因此本试验选择16srRNA进行鉴定,序列分析结果与塔里木裂腹鱼基因序列一致性为99.91%,证明细胞系来自于塔里木裂腹鱼。
塔里木裂腹鱼曾是博斯腾湖主要经济鱼类,自20世纪70年代,由于开荒造田,农田盐碱水大量的排入湖水,盐碱度逐年升高[41]。水体中盐碱度水平对鱼类的存活有显著的影响,盐碱度过高或过低都会使鱼类的存活率显著的降低[42-43]。在尼罗罗非鱼盐碱度的耐受性研究中盐度为20时仅少数个体能存活到96 h,NaHCO3碱度为12 g/L时,96 h全部死亡[44];以缢蛏(Sinonovaculaconstricta)为研究对象,对其进行急性低盐胁迫,并检测当盐度由2到0时,其存活率随着盐度的下降而降低[45];当碳酸盐浓度为0~44.58 mmol/L、pH值为9.0~10.0时,随着碳酸盐浓度的上升,缢蛏的存活率明显下降[46]。本研究中NaCl盐度6‰使BIM14增殖率最高;NaHCO3碱度6 g/L使BIM14增殖率最高。本研究结果显示,盐碱度过高或过低都会使塔里木裂腹鱼肾细胞的存活率降低,可应用于塔里木裂腹鱼对盐碱胁迫适应性的研究。
