靛红亚胺衍生物抗癌活性研究进展
2022-07-04姜惠婷穆宏文沈光海
陈 哲,朱 林,姜惠婷,穆宏文,沈光海*,金 瑛
(1.延边大学:a.药学院,b.融合学院,吉林 延吉 133002;2.吉林医药学院药学院,吉林 吉林 132013)
癌症是全球第二大死亡原因,加剧了医疗健康管理系统负担[1]。在治疗癌症的过程中,现在开发了一百多种药物并且在临床用于治疗,然而这些药物不能区分正常细胞和癌细胞,导致了严重的副作用。此外,癌症对现有化疗药物具有耐药性较为常见[2]。因此,开发具有高特异性和高疗效的新型抗癌药物很有必要。
靛红亚胺是由靛红衍生而来的一种新型亚胺衍生物,其衍生物具有多种不同的药理活性[3]。靛红亚胺及其衍生物具有重要的研究价值和良好的发展前景[4]。在已经过去的十年中,许多化学家都关注靛红亚胺及其衍生物的药理活性,其在各种疾病的治疗中具有潜力[5]。靛红亚胺类化合物具有良好的抗癌活性[6],但其研究不如吲哚类、苯二氮平类、色胺类衍生物深入。本文综述了近十年来靛红亚胺及其衍生物的抗癌生物学活性的最新研究进展。
1 含肼结构的靛红亚胺
含有酰肼结构的靛红亚胺有良好的药理活性,通过靛红亚胺中的N-3位构建酰肼结构引起了许多科学家的关注[7]。
Elazab等报道了C-5位具有苯基或苯基喹啉-4(3H)-1取代基的靛红亚胺衍生物对人乳腺癌细胞选择性较好[8]。人乳腺癌细胞C-5位被氢取代与被甲基取代相比较,前者活性要好,结肠癌细胞则相反。与氟尿嘧啶相比,化合物1对人乳腺癌细胞和结肠细胞的抑制效果最好。分子对接实验证实化合物1中喹唑啉环N-1位可以通过氢键识别明显的Met769残基,增强识别能力,提高抑制活性(图1-1)。
Zhang等检测了6种靛红亚胺衍生物对肺癌细胞的凋亡作用[9]。对于化合物2,当R=6-Br和R=6-Cl时,具有一定的抗细胞增殖活性,但是当R=6-Br时活性最强,IC50为29.69 μmol/L,可以通过线粒体途径诱导肺癌细胞的凋亡,但是对细胞周期没有影响(图1-2)。
Kumar等报道化合物3(IC50:70.02~100 μmol/L)对人胚胎肾细胞和乳腺癌细胞有中度的药理活性[10]。结果表明,支链越长,对人胚胎肾细胞抗细胞增生的药理活性越好。C-3位置被酮羰基取代,C-5位置被卤素取代,都有助于提高药理活性(图1-3)。

图 1 含肼结构的靛红亚胺
2 靛红亚胺手性衍生物
Ke等对靛红亚胺-脱氢表雄甾酮杂交的抗肿瘤活性进行了研究,包括HepG2、Huh-7、BEL-7402和5-FU细胞[11]。化合物4对测试的癌细胞表现出良好的抑制作用,可用于进一步设计和合成潜在抗肿瘤药物(图2-4)。
Bu等评估了11种靛红亚胺衍生物在体外对HepG2、Hela和A549的抗繁殖活性[12]。将化合物5(IC50:7.30~32.16 μmol/L)与顺铂进行比较,前者对Hela和HepG2有中等的体外抗肿瘤活性。当R=5-Br时,化合物5成为抗癌药物的可能性极大(IC50:7.30 μmol/L)。大多数化合物对Hela和HepG2的抑制活性要比对A549细胞明显。另外还发现,靛红亚胺苯环上的吸电子取代基明显比供电子基团对衍生物活性的影响好(图2-5)。
根据药物设计中药效基团和骨架迁移的原理,螺环氧化吲哚骨架化合物和姜黄素具有一定的生物活性,将两者拼接,合成一系列功能性吲哚氧化物衍生物,为生物活性进行筛选提供物质基础。采取MTT法研究6a、6b、6c三个新化合物对K562、A549和PC-3的体外抗肿瘤活性。化合物6b(IC50:37.5 μmol/L)对K562接近对照药物顺铂的抑制活性[13]。大多数化合物显示中等抑制活性,而化合物6b在两种测试细胞上显示最高活性(图2-6)。
Zeinab等用同样的MTT方法在体外测试了15种螺环吲哚-4H-吡喃衍生物对A549和MCF-7细胞的作用[14]。大多数化合物7显示出中等抑制活性,当R1=CN、R2=3-Br-Bn(IC50:29.33~16.18 μmol/L)时化合物7在两种试验细胞上显示出最高活性(图2-7)。
Zhou等对具有代表性的外消旋和对映体(R或S构型)化合物8和化合物9进行了细胞毒性的生物学评价[15]。分别对肺癌A549、肾癌786-0、食管癌ECA109和乳腺癌BT474细胞进行体外细胞毒性试验,结果表明,化合物8能在一定程度上抑制ECA109和BT474细胞的增殖,化合物8的一对对映体表现出不同的细胞毒性。(R)-8对ECA109细胞的细胞毒性高于(S)-8。对于化合物9而言,(R)-9比(S)-9对A549、ECA109和BT474细胞表现出更高的细胞毒性(图2-8、2-9)。
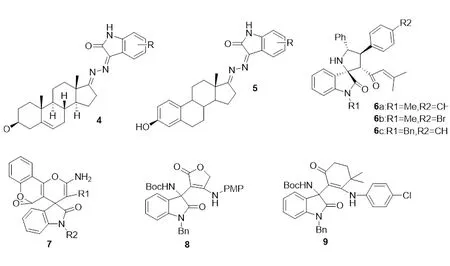
图 2 靛红亚胺手性衍生物
3 其他靛红亚胺替代品
Wang等研究了一系列1,2,3-三氮唑-四乙二醇异核双席夫亚胺(化合物10)的抗肿瘤活性[16]。构效关系表明靛红亚胺的C-3位置优化氢键供体将增强化合物的抗癌活性,而在C-5位置引入氟原子将降低其活性。因此,化合物10(IC50:9.79~26.94 μmol/L)具有进一步优化的最大潜力,对HepG2、Hela、HCT-116、A549和MCF-7细胞表现出较好的抗肿瘤活性(图3-10)。
Li等还对化合物11的抗癌活性进行了相关研究[17]。令人惊讶的是,除了取代基对药物活性的影响较小之外,Li等的构效关系分析结果与Wang等的几乎相同。因此,当R1=H、R2=OH时化合物11(IC50:6.23~19.95 μmol/L)对所有受试细胞都表现出极高的活性,其中对Hela、HCT-116、A549和MCF-7细胞的效力是依托泊苷的2.5倍,与依托泊苷对DU145、SKOV3和MCF-7细胞的效力相当。此外,当R1=H、R2=OH和R1=H,R2=NHCONH2时,化合物11对微管蛋白聚合具有强抑制作用,结果显示可以通过抑制微管蛋白来发挥抗癌作用(图3-11)。
Tian等合成了20种1,3,4-噻二唑硫酰胺-1,3-二取代吲哚酮(化合物12),并进行HepG2、AsPc-1和Hela肿瘤细胞体外抑制活性测定[18]。大多数化合物对HepG2、AsPc-1和Hela癌细胞具有良好的抑制活性。当R1=4-CH3、R2=2-F和R1=4-CH3、R2=2-CH3时化合物12对HepG2、AsPc-1和Hela细胞优于对照药物吉非替尼(IC50分别:16.41、5.19、7.89 μmol/L)。构效关系表明苯环上取代基的类型和位置会影响对肿瘤细胞的抑制活性,苄基苯环上的取代基为吸电子基F和Cl时,对三种癌细胞表现出的抑制活性高于供电子基。当甲基在苯环的邻位时,其对三种细胞的抑制活性均优于甲基在对位时的抑制活性(如图3-12)。
Huong团队通过不同的连接单元测试了苯异羟肟酸和羟基伊马替尼的组蛋白去乙酰化酶抑制作用和抗肿瘤细胞毒性[19]。化合物13的细胞毒性低于化合物14。构效关系表明C-5或C-7位引入吸电子或供电子取代基,组蛋白去乙酰化酶的抑制作用增强,但是C-5位的取代似乎比C-7位更有利于细胞毒性(图3-13、3-14)。
Xu等[20]和Diao等[21]研究了化合物15和化合物16通过不同连接单元连接的4-甲基香豆素和靛红亚胺对其抗癌活性的影响。构效关系证实C-3位取代基和C-5位取代基对活性的影响更大。对于通过二甘醇连接的化合物在C-3位置的影响顺序是肟>酮>甲基肟,而对于通过四乙二醇连接的化合物,顺序是甲基肟>酮>肟>乙基肟。对于C-5取代基,二甘醇连接的化合物的抗癌活性可以通过引入供电子基团(如甲基)来增强,而四乙醇连接的化合物则相反(图3-15、3-16)。
Rajesh等测试了化合物17的抗癌活性[22]。在测试化合物中,当R1=吲哚酮基、R2=H时,化合物17对乳腺癌(MCF-7)细胞具有最佳抗癌活性(IC50:1.98 μmol/L±0.18 μmol/L,抑制率78.98%),同时,对磷酸肌苷3-激酶的抑制率为73.06%,IC50:(1.972±0.44)μmol/L(图3-17)。

图 3 其他靛红亚胺替代品
4 小 结
近年来,已经开发了许多靛红亚胺衍生物并测试它们的抗癌性能。构效关系表明,靛红亚胺的N-1、C-3、C-5、C-7位可以修饰,N-1位可以引入各种抗癌(如苯并呋喃化合物或三唑化合物)的药效团。对于C-3位,肼化合物和螺环是最常见的,表现出良好的作用。苯环上C-5和C-7位的取代基,一般会引入供电子或吸电子基团以增加其抗癌活性。本文对结构与活性之间的关系及作用机理进行探讨,为合理设计更有效的靛红亚胺衍生物提供依据。
