薏苡仁脂肪酸的α-葡萄糖苷酶抑制活性
2022-07-04周丽琬李颖陈惠琴杨小雨徐幸莲戴好富
周丽琬,李颖,陈惠琴,杨小雨,徐幸莲*,戴好富,*
1. 南京农业大学食品科技学院(南京 210095);2. 中国热带农业科学院热带生物技术研究所,海南省黎药资源天然产物研究与利用重点实验室(海口 571101);3. 贵州省农业科学院亚热带作物研究所(兴义 562400)
薏苡(Coix lacryma-jobiL. var. ma-yuen Stapf)为禾本科(Gramineae)薏苡属(CoixL.)一年生或多年生草本植物[1]。将壳及种皮从种子中剥离后的部分为薏仁,也被称作薏仁米、薏珠子等[2-3]。薏苡是一种药食两用的栽培作物,有丰富的营养价值以及多样的保健功能,享有“世界禾本科植物之王”的美誉[4-5]。在中国、印度、日本及越南等东南亚国家均有广泛种植[6]。
薏苡历史悠久,可作为保健品以及中成药,其味甘、淡,性凉,归脾、胃、肺经,有利水渗湿、健脾止泻、除痹、排脓、解毒散结的功效[7-9]。有关薏苡仁降血糖的功效自古即有迹可寻,《神农本草经》记载薏苡能够清热除湿、健脾润肺,因此对于消渴(糖尿病)的三多症状均有功效;《本草拾遗》中称薏苡仁可“温气、主消渴”;《本草纲目》中也有记载其可“治消渴饮水”[10]。薏苡仁作为薏苡可直接食用的一部分,国内外对其活性方面已有了较多的研究,已有研究表明薏苡仁多糖具有降血糖活性[11-13],但对于薏苡仁的其他成分是否参与降血糖作用的研究较少。因此,研究旨在探究薏苡仁脂肪酸的降血糖活性,并以作为治疗II型糖尿病的重要靶点之一α-葡萄糖苷酶为活性筛选模型[14],利用优化后的pNPG法对各提取物及其中的主要脂肪酸成分进行α-葡萄糖苷酶抑制活性的筛选及酶动力学测试,为薏苡仁降血糖活性的研究开阔思路与方向,同时为相关产品的开发提供科学指导。
1 材料与方法
1.1 样品
薏苡仁采集于中国贵州省兴仁市潘家庄实验基地,经刘凡值研究员(单位:贵州省农业科学院亚热带作物研究所)鉴定其为禾本科(Gramineae)薏苡(Coix lacryma-jobiL. var. ma-yuen Stapf)。
1.2 标准品
顺式-油酸甲酯(纯度95%)和反式-油酸(纯度95%),购自北京百灵威科技有限公司;棕榈酸(纯度97%)和顺式-亚油酸甲酯(纯度99%),购自梯希爱(上海)化成工业发展有限公司;顺式-亚油酸(纯度99%)。购自北京曼哈格生物科技有限公司。
1.3 仪器与设备
HP6890/5975C型 GC/MS联用仪(美国安捷伦科技有限公司);RODI-50-RE超纯水系统(北京华力航科技公司);SynergyH1全波长多功能酶标仪(海南隽誉科技有限公司);Delta 320-S型 pH计(梅特勒-托利多仪器有限公司);EN 2062电子秤(海南隽誉科技有限公司);1~1 000 μL移液枪(德国Eppendorf)。
1.4 试剂
阿卡波糖(Sigma Chemical);α-葡萄糖苷酶(50 U/mg,Sigma Chemical);对硝基苯基-α-D-吡喃葡萄糖苷(pNPG,上海源叶生物科技公司);磷酸氢二钠(Na2HPO4·12H2O,国药集团化学试剂有限公司);磷酸二氢钠(NaH2PO4·2H2O,国药集团化学试剂有限公司)。
1.5 方法
1.5.1 薏苡仁粗提物的气相色谱-质谱联用(GCMS)分析
1.5.1.1 样品前处理
利用常温浸提法对薏苡仁(27.7 kg)进行提取。按料液比1∶3(kg/L)用工业乙醇浸提三次,每次浸泡一周,收集滤液并浓缩得到乙醇提取物(405.1 g)。乙醇提取物用水充分溶解,依次用同等体积的石油醚、乙酸乙酯各萃取三次,浓缩后得到薏苡仁石油醚相(194.2 g)和乙酸乙酯相(15.0 g)。将乙醇粗提物、石油醚相及乙酸乙酯相用色谱甲醇溶解,经0.22 μm滤膜过滤后待测。
1.5.1.2 GC-MS分析
气相色谱条件:色谱柱为弹性石英毛细管柱-HP-5MS 5% Phenyl Methyl Siloxane(30 m×0.25 mm×0.25 μm);载气为He,载气流量1.0 mL/min,分流比40∶1;初始柱温为50 ℃,以5 ℃/min的速度升温到310℃,恒温时间为10 min,汽化室的温度均为250 ℃;溶剂延迟时间为3.0 min。质谱条件:电子轰击(EI)离子源;电子能量为70 eV;离子源温度为230 ℃;四极杆温度为150 ℃;接口温度为280 ℃;发射电流为34.6 μA;倍增器电压为1 434 V;质量扫描范围为20~550m/z。质谱检索采用Wiley 275标准谱库检索(要求相似度90%以上),各组分的相对百分含量采用峰面积归一化法计算,推测出薏苡仁中主要成分。
1.5.2α-葡萄糖苷酶抑制活性测定
α-葡萄糖苷酶抑制活性测定方法在Liu等[15]的基础上加以改进。
1.5.2.1 所需试剂的配制
(1)α-葡萄糖苷酶溶液的配制:准确称取2.0 mgα-葡萄糖苷酶固体(50 U/mg)溶解到1.0 mL PBS缓冲液(0.1 mol/L,pH 6.8)中得到100 U/mLα-葡萄糖苷酶溶液,再用PBS缓冲液稀释至0.2 U/mL。(2)pNPG的配制:准确称取7.5 mgpNPG溶解至10 mL PBS缓冲液中得到2.5 mmol/LpNPG溶液。(3)样品、阳性对照溶于DMSO中配制成相应浓度。
1.5.2.2 化合物对α-葡萄糖苷酶的抑制率测定
将适宜浓度的样品与α-葡萄糖苷酶溶液混匀后加入96孔酶标板中,每孔中含有10 μL样品及100 μL酶溶液,若样品颜色较深,则需要设置一组样品的本底对照以减去样品在405 nm处的本底吸收值。以等量的DMSO代替样品加入酶溶液中作为阴性对照和空白对照,以阿卡波糖为阳性对照,将96孔板于37 ℃下温育15 min。然后,向空白对照及本底对照组中加入40 μL PBS(0.1 mol/L,pH 6.8),试验组、阴性对照及阳性对照组均加40 μL底物,并于37 ℃下温育15 min。最后用酶标仪测定在405 nm处的吸光度,记录每孔的吸光度,重复3次取平均值。
化合物对α-葡萄糖苷酶抑制活性的计算公式:抑制率=(A2-A1)/(A2-A0)×100%;样品颜色较深时的计算公式:抑制率=[A2-(A1-A1′)]/(A2-A0)×100%。
式中:A0、A1、A1′、A2分别为405 nm下测得的空白对照组、试验组、本底对照组、阴性对照组的吸光度。
1.5.2.3 化合物对α-葡萄糖苷酶的IC50值测定
按照2.2.2方法,将每个样品按梯度稀释配制成5个浓度进行α-葡萄糖苷酶抑制活性测试,计算各浓度下的抑制率并绘制化合物浓度-抑制率曲线图,计算得到样品对α-葡萄糖苷酶的半抑制浓度(IC50值)。
1.5.2.4 化合物对α-葡萄糖苷酶的酶动力学测试
按照2.2.2方法,将稀释的样品溶液(稀释3或4个浓度,通常选择在样品IC50值附近的浓度开始稀释)与酶溶液混匀后,分别与浓度为2.5,1.25,0.625,0 mmol/L的底物反应,在37 ℃下温育,每隔1 min测定一次其在405 nm处的吸光度,共测定15 min,重复三次试验求平均值。按Lineweaver-Burk方程作图,绘制酶抑制作用的动力学曲线,确定其抑制类型。竞争性抑制动力学方程如式(1)所示。

式中:[S]为底物质量浓度,mg/mL;[I]为抑制剂质量浓度,mg/mL;Vmax为最大速度,mL/min;Km为米氏常数,mg/mL;Ki为[EI]的解离常数,mg/mL。
2 结果与分析
2.1 GC-MS结果分析
薏苡仁乙醇粗提物、石油醚相及乙酸乙酯相粗提物均为油状物,其GC-MS离子流图和鉴定的化学成分见图1和表1。棕榈酸在乙醇粗提物、石油醚相及乙酸乙酯相中的峰面积占比分别为17.00%,21.88%和19.66%;顺式-油酸甲酯在这3个提取物中的峰面积占比分别为10.16%,50.79%和4.17%;顺式-亚油酸甲酯在这3个提取物中的峰面积占比分别为6.63%,11.36%和26.46%;顺式-亚油酸在乙醇粗提物和乙酸乙酯相中的峰面积占比为29.39%和27.40%;反式-油酸在乙醇粗提物和石油醚相中的峰面积占比分别为15.27%和9.4%。这5个化合物在乙醇粗提物、石油醚相及乙酸乙酯相中的总占比分别为78.45%,93.43%和77.69%。另外,石油醚相中还含有少量酸、酯类化合物,乙酸乙酯相中还含有少量酯、醇、烯酸以及甾醇类化合物。因此推测棕榈酸、反式-油酸、顺式-亚油酸、顺式-油酸甲酯、顺式-亚油酸甲酯为薏苡仁中主要成分。
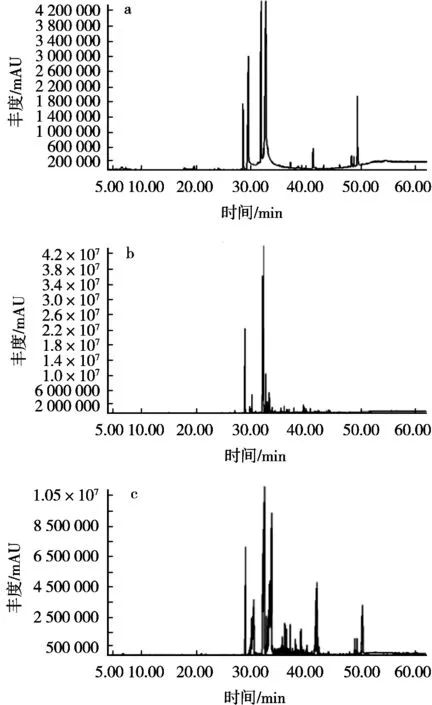
图1 薏苡仁乙醇粗提物(a)、石油醚相(b)及乙酸乙酯相(c)的GC-MS离子流图
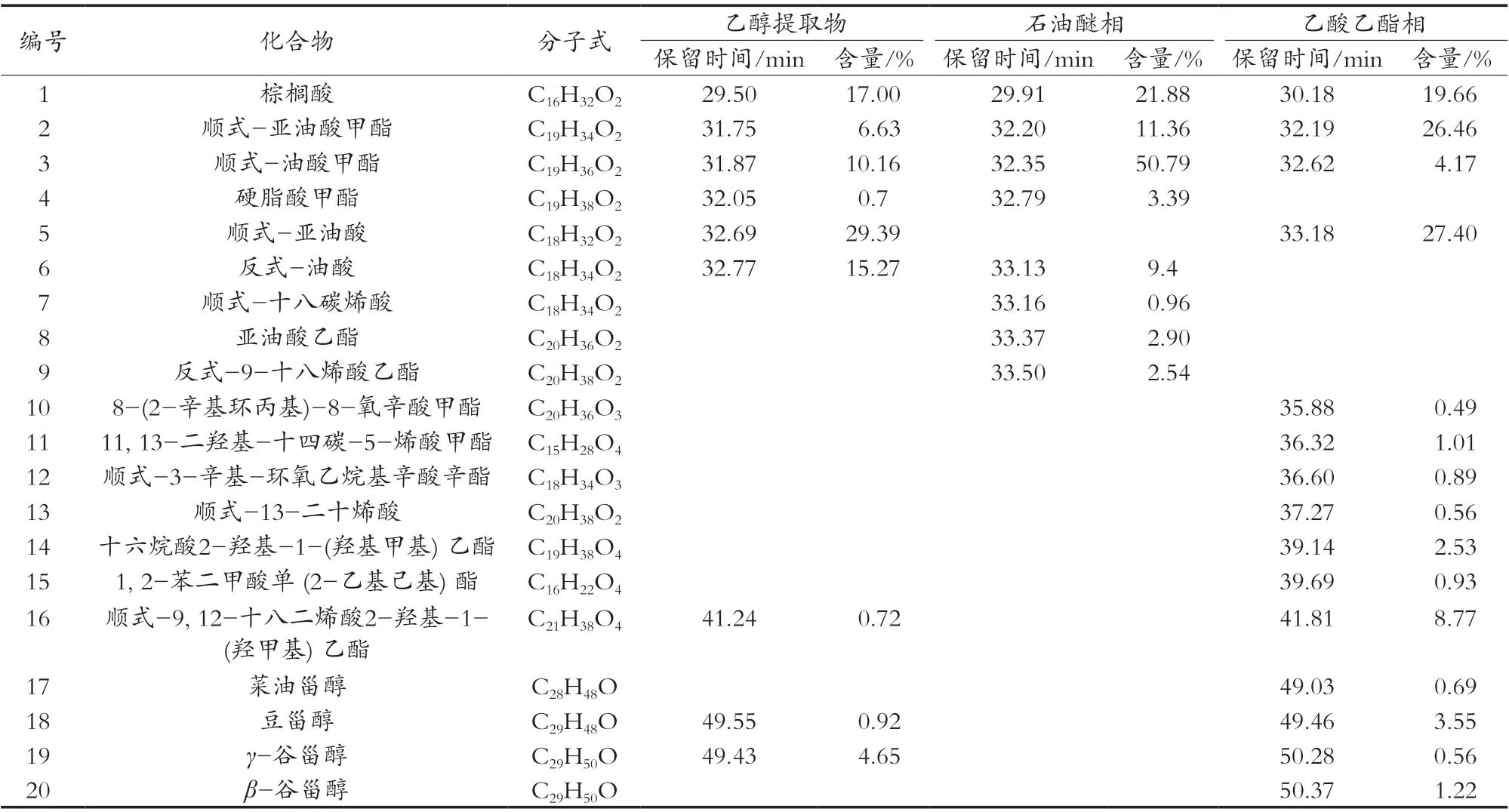
表1 薏苡仁乙醇粗提物、石油醚相及乙酸乙酯相中的主要成分
2.2 薏苡仁粗提物的α-葡萄糖苷酶抑制活性
薏苡仁乙醇粗提物、石油醚相及乙酸乙酯相均有一定的α-葡萄糖苷酶抑制活性(表2)。
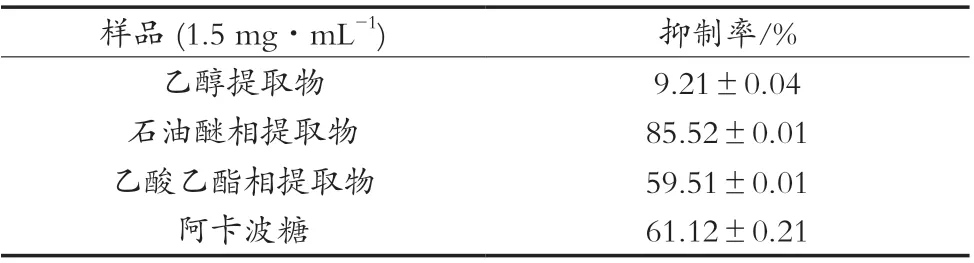
表2 薏苡仁乙醇粗提物、石油醚相和乙酸乙酯相的α-葡萄糖苷酶抑制活性(n=3,x±s)
2.3 薏苡仁中主要成分的α-葡萄糖苷酶抑制活性
对薏苡仁中5种主要成分的α-葡萄糖苷酶抑制活性作进一步探索。5个化合物对α-葡萄糖苷酶抑制作用的IC50值见表3,对α-葡萄糖苷酶的酶动力学结果见图2。
2.3.1 主要成分的α-葡萄糖苷酶IC50值测定结果
化合物的IC50值见表3。这5个化合物对α-葡萄糖苷酶均有抑制作用,且都明显强于阳性对照阿卡波糖(IC50=581.94±0.26 μmol/L)。

表3 薏苡仁中主要成分的α-葡萄糖苷酶抑制活性(n=3,x±s)
2.3.2 主要成分对α-葡萄糖苷酶的酶动力学测试结果
以底物质量浓度(S)的倒数与反应速率(V)的倒数作双倒数曲线图(图2)。从双倒数曲线图中可以判断化合物的抑制类型:若所有曲线(不同的抑制剂浓度)的交点在y轴上,则表明化合物为竞争性抑制剂;若在x轴上则表明化合物为非竞争性抑制剂;若交点不在坐标轴上则表明化合物为混合性抑制剂[16]。由图2可知,化合物2(图2-b)、化合物4(图2-d)和化合物5(图2-e)的双倒数图有良好的线性关系,所有曲线均相交于y轴,即随着抑制剂的质量浓度增大,Vmax不变,Km增大,说明抑制剂和pNPG在该酶(E)上的结合位点一致,因此化合物2,4和5对葡萄糖苷酶有竞争性抑制作用;而化合物1(图2-a)和3(图2-c)的双倒数曲线显示,所有曲线的交点不在坐标轴上,即随着抑制剂质量浓度的增大,Vmax减小,Km增大,说明这两个抑制剂不仅与酶结合发挥抑制作用,还会与酶-底物复合物结合抑制α-葡萄糖苷酶活性,因此这两个抑制剂对α-葡萄糖苷酶的抑制类型为混合性抑制。表4为各抑制剂的酶抑制常数Ki(双曲线倒数图中各曲线斜率值-抑制剂质量浓度所作曲线的x轴截距)和酶-底物络合物抑制常数Kis(双曲线倒数图中各曲线的y轴截距-抑制剂质量浓度所作曲线的x轴截距),根据这两个抑制常数可以推断出抑制剂对酶的亲和力,数值越小,抑制剂对酶的亲和力越好,结合更紧密,抑制能力越强[17-18]。由这5个化合物的Ki值可以判断它们的抑制能力由强到弱依次为反式-油酸>亚油酸甲酯>顺式-亚油酸>棕榈酸>油酸甲酯。另外,根据混合型抑制剂的Ki和Kis值可以判断抑制剂分别与酶、酶-底物复合物的亲和程度,其中化合物1表现出与酶的亲和力更好,说明抑制剂主要通过与酶结合发挥抑制作用;而化合物3则与酶-底物复合物的亲和力更好,说明化合物3主要是通过与酶-底物复合物结合发挥抑制效果。

表4 主要成分对α-葡萄糖苷酶的抑制类型及抑制常数
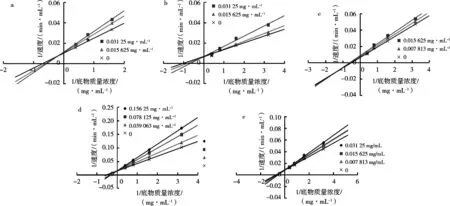
图2 化合物1~5对α-葡萄糖苷酶抑制活性的双倒数曲线图(a-e)
3 结论
已有文献报道薏苡仁多糖的降血糖活性,而对于薏苡仁其他成分的降血糖活性少见报道,因此本文利用pNPG法对薏苡仁进行了α-葡萄糖苷酶抑制活性测试以探究其降血糖活性。经GC-MS分析发现其中的主要成分为棕榈酸、反式-油酸、顺式-亚油酸、顺式-油酸甲酯、顺式-亚油酸甲酯,对上述的5个化合物进行α-葡萄糖苷酶抑制活性测试及酶动力学探究发现它们对α-葡萄糖苷酶的抑制作用均明显强于阳性对照阿卡波糖。酶动力学结果显示:反式-油酸、顺式-油酸甲酯和顺式-亚油酸甲酯对α-葡萄糖苷酶的抑制类型为竞争性抑制,棕榈酸和顺式-亚油酸对α-葡萄糖苷酶的抑制类型为混合性抑制;这5个化合物的抑制能力由强到弱依次为反式-油酸>亚油酸甲酯>顺式-亚油酸>棕榈酸>油酸甲酯。
薏苡仁中脂肪酸含量较高,且具有较强的α-葡萄糖苷酶抑制活性,为了进一步证明脂肪酸的降血糖活性,后期还需通过大量严格的体内试验、临床试验等的验证,为薏苡仁的降血糖相关产品的开发提供一定的科学依据。
