木枣汁发酵中酶、代谢产物以及味觉的变化
2022-07-04张玲韩基明张江宁丁卫英杨春
张玲,韩基明,张江宁,丁卫英,杨春*
山西农业大学,山西功能食品研究院(太原 030031)
红枣为鼠李科(Rhamnaceae)枣属(Ziziphus MIll)植物的果实,含有丰富的营养成分,也是常用的中药材[1]。现代研究表明,红枣中的多糖、三萜类物质、环磷腺苷和黄酮苷等都是很强的抗氧化剂,其有清除自由基的功能,对提高机体免疫力和抗氧化作用的效果显著[2-5]。我国枣的品种繁多,不同品种的枣中各营养和活性成分含量有一定的差异[6]。木枣主要分布在山西省吕梁地区和陕西省榆林地区黄河沿岸,为当地主栽品种,也是全国仅次于金丝小枣栽培面积的品种[7],且木枣中的营养物质和生物活性成分含量较高[8-9]。研究以山西临县木枣为原料,同时利用益生菌的作用对枣汁进行发酵,并进一步分析发酵过程中主要功效酶活性、相关代谢产物以及味觉的变化规律,可为红枣发酵功能制品的开发提供一定的理论基础和技术依据。
1 材料与方法
1.1 材料与试剂
木枣(山西临县);果蔬酵素益生菌发酵剂(安琪);果胶酶(北京索莱宝);纤维素酶(北京索莱宝);芦丁(北京索莱宝);没食子酸(北京索莱宝);葡萄糖(北京索莱宝);乳酸试剂盒(北京索莱宝);SOD酶试剂盒(南京建成);多酚氧化酶试剂盒(南京建成);其他试剂均为分析纯。
1.2 仪器与设备
WAY-2S蔗糖仪(上海卓光仪器科技有限公司);Multiskan Go酶标仪(Thermo Scientific);SC-3610离心机(安徽中科中佳科学仪器有限公司);SPX-100B-Z培养箱(上海博讯医疗生物仪器股份有限公司)。
1.3 试验方法
1.3.1 木枣汁的发酵
称取400 g鲜木枣,加入1 200 mL水,打浆后加入0.4 g果胶酶、0.1 g纤维素酶后置于60 ℃水浴锅中酶解1 h,按3 500 r/min离心10 min,取上清液,备用。将制备好的木枣汁高温瞬时灭菌,冷却后按1∶2 000 g/mL枣汁的比例加入益生菌,置培养箱发酵,每隔1 d取样测试,连续7 d。
1.3.2 总糖的测定
参考文献[10],采用DNS法,略有改动。发酵枣汁稀释10倍,取100 μL的样品稀释液,按照葡萄糖标准曲线制作方法测定其吸光度,并计算样品中还原糖的含量。
1.3.3 黄酮的测定
参考文献[11]。发酵枣汁稀释10倍,取1 mL的样品稀释液,按照芦丁标准曲线制作方法测定其吸光度,并计算样品中黄酮的含量。
1.3.4 总酚的测定
标准曲线的绘制:精确称取5 mg没食子酸标准样品,用蒸馏水定容至50 mL,分别准确量取0.2,0.4,0.6,0.8,1.0和1.2 mL标准液于10 mL比色管中,分别加入6 mL蒸馏水,摇匀后加0.5 mL Folin酚试剂摇匀,1 min后加入1.5 mL 20%的碳酸钠溶液,混匀定容。75℃下恒温水浴反应10 min,取出冷却后在760 nm波长下测定吸光度,作标准曲线。
样品的测定:发酵枣汁稀释10倍,量取100 μL的样品稀释液,按照没食子酸标准曲线制作方法测定其吸光度,并计算样品中总酚的含量。
1.3.5 乳酸的测定
按照试剂盒说明书测定,原理:乳酸是生物体代谢过程中重要的中间产物,乳酸含量是评估糖原代谢和有氧代谢的重要指标。乳酸在乳酸脱氢酶的作用下生成丙酮酸,同时使NAD+还原生成NADH和H+,H+传递给PMS生成的PMSH2还原MTT生成紫色物质,在570 nm处有特征吸收峰。
1.3.6 超氧化物歧化酶(SOD)酶活的测定
根据超氧化物歧化酶(SOD)活性检测试剂盒说明书进行操作。
SOD活性(U/mL)=[抑制百分率/(1-抑制百分率)×V反总]/V样×F(1)式中:V反总为反应液总体积,mL;V样为样液体积,mL;F为稀释倍数。
1.3.7 多酚氧化酶(PPO)的测定
根据多酚氧化酶(PPO)活性检测试剂盒说明书进行操作。果汁PPO活性单位定义:每分钟每毫升果汁在酶反应体系中使在420 nm处吸光度变化0.01为一个酶活力单位。

式中:ΔA为测定管吸光度与对照管吸光度之差。
1.3.8 味觉分析
将红枣发酵汁倒入电子舌专用烧杯至刻度线。按照设置的序列放置在电子舌自动进样器上。试验采用蒸馏水清洗和枣汁样本交替检测序列进行检测。
2 结果与分析
2.1 发酵过程中总糖含量的变化
由图1可知,发酵第2天,木枣汁中糖含量增加,可能是因为微生物前期对枣汁中的多糖进行分解,导致枣汁中可溶性多糖溶于发酵的枣汁中,从而使发酵枣汁中总糖含量上升。发酵第3天总糖含量下降,之后趋于平稳,这是由于乳酸菌大量繁殖将枣汁中的糖代谢成乳酸等物质的结果。
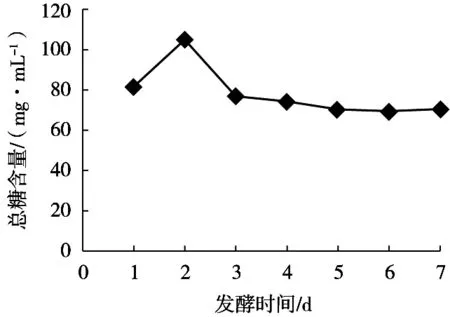
图1 不同发酵时间枣汁中总糖含量变化
2.2 发酵过程中乳酸含量的变化
由图2可知,发酵前2 d,木枣汁中乳酸含量缓慢上升,到第3天枣汁中乳酸含量显著上升,这是由于乳酸菌开始大量繁殖将枣汁中的糖代谢成乳酸,之后乳酸含量又显著降低,这是由于随着发酵的进行,酸度和糖等条件发生改变,不利于乳酸菌的生长和产酸,并且在乳酸菌合成乳酸的同时,乳酸同样作为碳源被微生物利用,进而造成乳酸含量逐步降低。
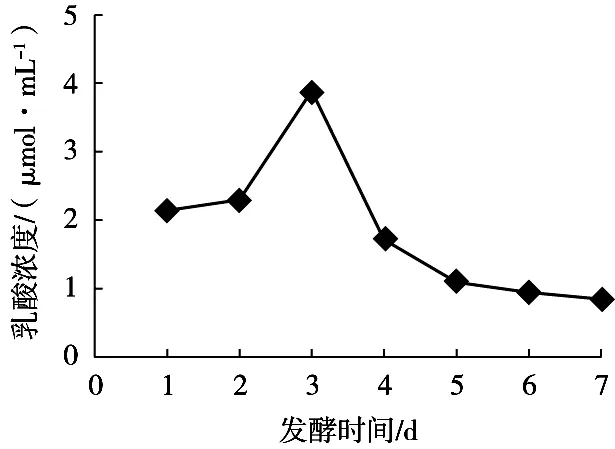
图2 不同发酵时间枣汁中乳酸含量变化
2.3 发酵过程中总黄酮含量的变化
由图3可知,木枣汁发酵过程中总黄酮含量呈下降趋势,其原因可能是乳酸菌可分泌糖苷酶[12]:一方面将不溶性膳食纤维结合的黄酮释放形成水溶性黄酮;另一方面又可能将水溶性黄酮苷水解成不溶性黄酮苷元。在发酵后期,发酵产酸导致强酸环境,黄酮在强酸环境中不稳定也会被分解[13]。
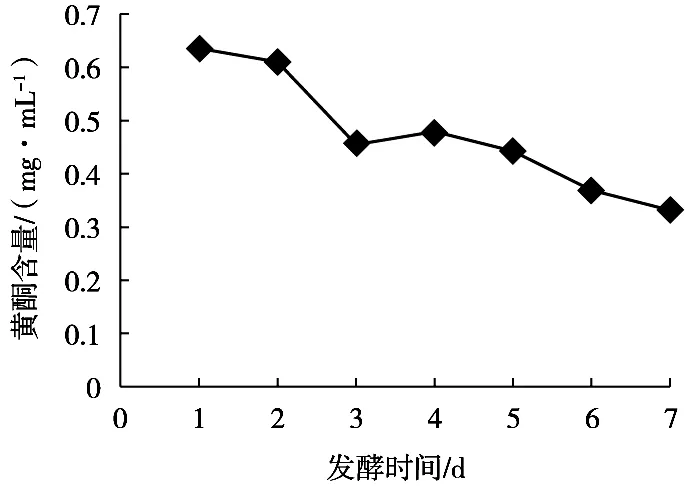
图3 不同发酵时间枣汁中黄酮含量变化
2.4 发酵过程中总酚含量的变化
由图4可知,木枣汁发酵前2 d,总酚含量呈下降趋势,可能是因为枣汁中酚类物质被多酚氧化酶氧化成了醌类物质[14],随着乳酸菌的大量繁殖,乳酸菌产生糖苷酶和酚酸酯酶[15],将不溶性膳食纤维结合的酚类物质释放为可溶的游离态酚[16-17],此外,枣汁pH发生下降,低酸环境也有利于保护酚羟基不发生氧化,因此发酵中期总酚含量呈上升趋势。随着发酵的继续进行,总酚含量下降,可能是因为枣汁中环境改变,酚类物质被氧化分解。
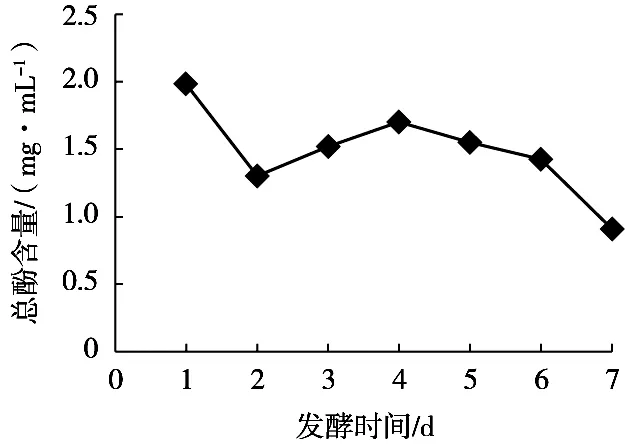
图4 不同发酵时间枣汁中总酚含量变化
2.5 发酵过程中SOD酶的变化
由图5可知,发酵前2 d,SOD酶活呈上升趋势,随着发酵的进行,SOD酶活逐渐下降,可能是因为随着乳酸菌发酵的进行,枣汁体系中成分和pH的改变,使得SOD酶活性下降。
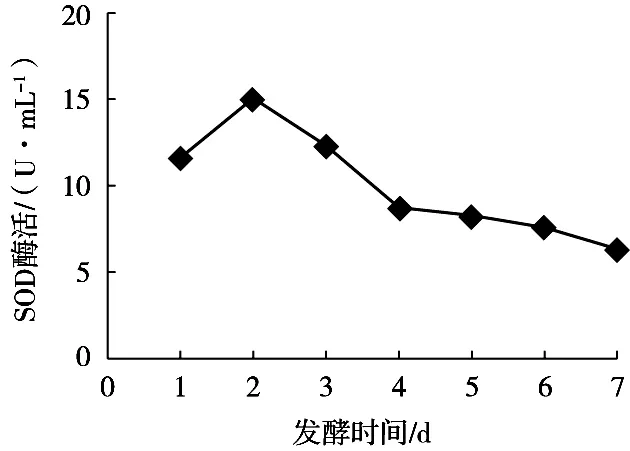
图5 不同发酵时间枣汁中SOD酶含量变化
2.6 发酵过程中多酚氧化酶活性变化
由图6可知,随着发酵的进行,多酚氧化酶的酶活逐渐升高,第4天达到最高,之后随着发酵时间的延长,其酶活又逐渐下降,可能是因为发酵枣汁体系中成分和pH的改变,使得酶活性下降。

图6 不同发酵时间枣汁中多酚氧化酶酶含量变化
2.7 发酵枣汁的电子舌主成分分析
图7为不同发酵时间的枣汁主成分PCA分析图。第一主成分和第二主成分的总贡献率达到了97.2%,识别指数是90,足以收集特征信息。发酵3 d和发酵4 d的枣汁分布区域较近,其他发酵时间的枣汁分别聚类在PCA图中的不同区域,相互之间能够较好地被区分。
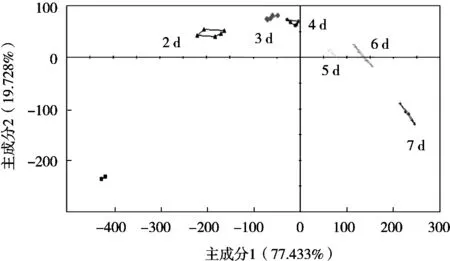
图7 发酵枣汁主成分分析
2.8 发酵枣汁的相似性分析
表1是7个不同发酵天数木枣汁电子舌相似性分析结果。发酵3 d和4 d的木枣汁两者之间的距离值最小,可知两者味觉的相似性较大。其次为发酵5 d和发酵6 d的枣汁,它们之间的距离为69.88,两者之间的味觉相似性也较大。发酵1 d和发酵7 d的木枣汁之间的距离值最大,可知两者的相似性最小。
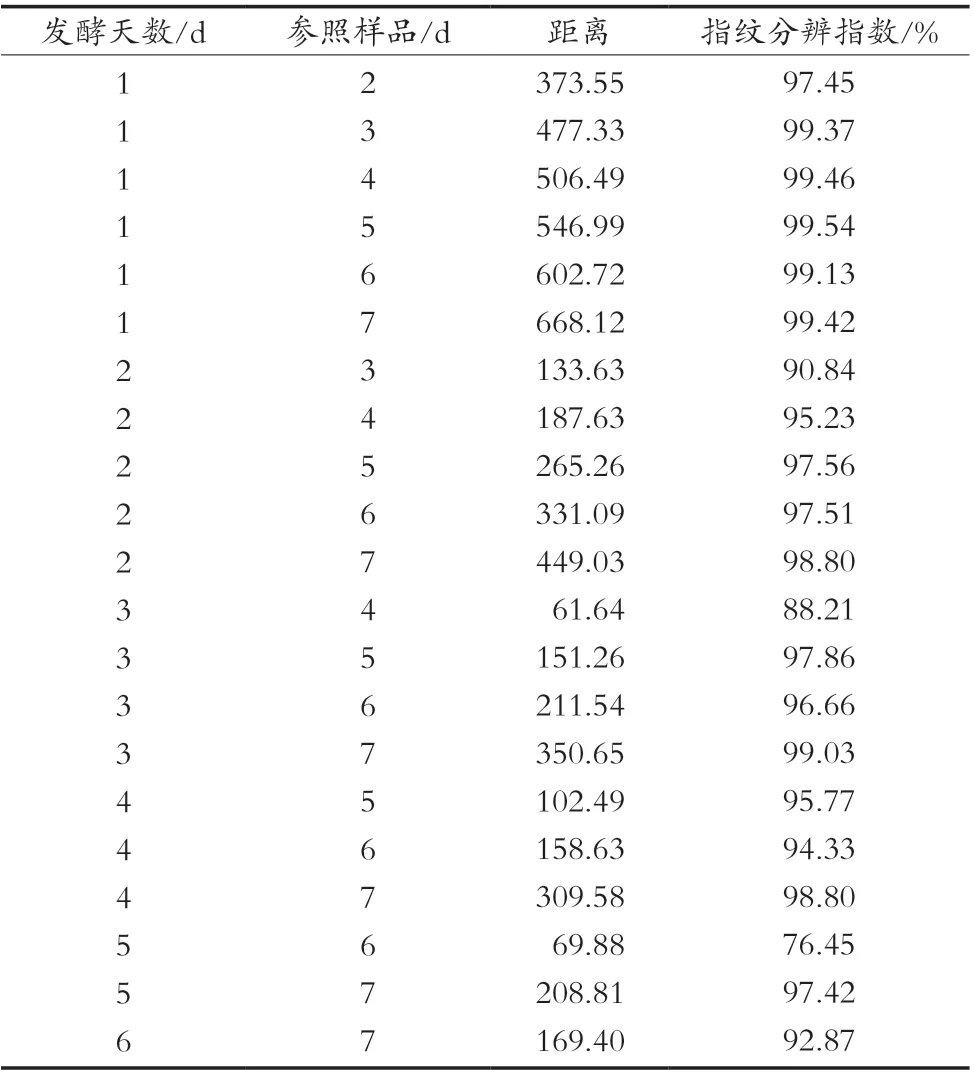
表1 不同发酵天数的枣汁相似性分析
2.9 发酵枣汁的味觉分析
从表2可得知7个不同发酵天数木枣汁的酸、甜、苦、咸、鲜味的相对值。发酵3 d的木枣汁的酸味值较大,且苦味值较小。随着发酵时间的延长,枣汁的苦味值逐渐增加,发酵7 d时,其木枣汁的苦味值最大。

表2 不同发酵天数的枣汁味觉分析
3 结论
研究表明,枣汁益生菌发酵过程中,发酵前2 d因为乳酸菌对枣汁中的多糖进行分解,木枣汁中糖含量增加,随着发酵的进行,乳酸菌利用糖大量繁殖,使总糖含量下降,且乳酸含量逐渐增加,第3天达到最高。随着发酵时间的延长,枣汁中黄酮含量呈下降趋势,总酚发酵第2天含量下降,之后又呈上升趋势,发酵4 d后总酚含量又逐渐下降。枣汁发酵前2 d SOD酶活呈上升趋势,之后SOD酶活逐渐下降。发酵枣汁中多酚氧化酶的酶活逐渐升高,第4天达到最高,之后随着发酵时间的延长,其酶活又逐渐下降。同时,试验利用电子舌对不同发酵时间的木枣汁进行了味觉分析,综合其乳酸含量以及酸、甜、苦、鲜、咸味觉变化,其木枣汁益生菌发酵适宜的时间为3 d。
