TAP和Hsp90ɑ检测在肺癌恶性胸腔积液诊断及预后评估的价值
2022-07-04苏世红尹永杰张玉徐爱晖
苏世红 尹永杰 张玉 徐爱晖
恶性胸腔积液(MPE)是肿瘤细胞播散至胸膜导致淋巴回流受阻引起的。MPE是中晚期肺癌最常见合并症[1],中位生存期仅4~12个月[2]。胸水脱落细胞学或胸膜活检是诊断MPE主要方法[3],但阳性率较低。因此,肿瘤标志物诊断MPE的功效受到了更多关注。
临床常用的肺癌三项包括癌胚抗原(CEA)、细胞角蛋白可溶性片段211(CYFRA211)和神经元特异性烯醇化酶(NSE),因不稳定性及多样表达对MPE诊断存在局限性[4-5]。异常糖链糖蛋白(TAP)是细胞癌变后基因表达的特异性物质。热休克蛋白90α(Hsp90ɑ)为可提示肿瘤增殖及侵袭转移的细胞质蛋白质[6]。目前,关于TAP和Hsp90ɑ对MPE诊断评估的研究甚少。本研究通过TAP和Hsp90ɑ在外周血和胸腔积液中差异表达,评价其在肺癌恶性胸腔积液诊断及预后预测中的临床价值。
资料与方法
一、研究对象
本研究为前瞻性研究,该研究经我院论理委员会批准(批号:PJ2022-06-35),所有患者均被告知研究目的及程序,签署书面知情同意书。收治2019年2月-2020年12月安徽医科大学第一附属医院呼吸与危重症医学科67例胸腔积液和肺部占位患者,随访1年至2021年12月,期间中途退出6例,失访7例,最终入组54例患者。男性39例(72.22%),女性15例(27.78%),年龄23~91岁。分为良性胸腔积液组19例,肺癌恶性胸腔积液组18例,Ⅲ期~Ⅳ期肺癌(不伴有胸腔积液)组即中晚期肺癌组17例,在性别、年龄构成比上,各组研究对象差异无统计学意义(P>0.05)(见表1)。纳入标准:(1)分组:肺癌恶性胸腔积液组和中晚期肺癌组:依据《恶性胸腔积液诊断与治疗专家共识》[7]、《中华医学会肿瘤学分会肺癌临床诊疗指南(2021版)》[8]和《国际肺癌TNM分期标准(第八版)》[9],经胸腔积液脱落细胞学、经皮肺穿刺活检和支气管镜证实查见癌细胞;进行头颅MRI、骨ECT或PET-CT等检查综合评估;良性胸腔积液组:依据临床表现、上述病理检查及治疗后效果等综合为良性胸腔积液(结核性胸膜炎、肺部感染、低蛋白血症等);(2)入院前未接受针对性治疗;(3)精神状态良好,临床资料完整。排除标准:(1)合并其他脏器恶性肿瘤;(2)存在手术禁忌或麻醉药物过敏者;(3)依从性差,中途退出或失访者。
二、试剂与仪器
CEA、CYFRA21-1和NSE检测由瑞士罗氏公司的酶联免疫(ELISA法)试剂盒和电化学发光分析仪完成。TAP检测由瑞生医疗科技有限公司TAP(凝聚法)试剂盒和瑞生TAP医学显微图像分析仪完成。Hsp90ɑ检测由普罗吉生物科技发展有限公司Hsp90ɑ试剂盒和DIATEK DR-200B系列酶标仪分析仪完成。
三、研究方法
1 标本的收集及处理
(1)外周血:清晨、空腹,采集静脉血(EDTA抗凝管)2mL,4 ℃, 1500 r/min, 离心15 min,分离血浆用于Hsp90ɑ检测;另采集3~5mL无添加剂的非抗凝血标本,分离血清,用于TAP、CEA、CYFRA21-1和NSE检测。
(2)胸腔积液:常规消毒行胸腔穿刺抽液术,抽取100mL胸腔积液,3000r/min,离心5min,弃上清,加入适量细胞清洗液,重复上述操作,取上清液和红细胞中间的细胞层作涂片,固定、HE染色后显微镜下观察;考虑为可疑肿瘤细胞或肿瘤细胞,进一步做石蜡包埋切片,行免疫组化。
(3)肿瘤组织:电子支气管镜或经皮肺穿刺活检、超声支气管镜(EBUS)刷检细胞学涂片,HE染色后观察细胞形态,考虑为可疑癌细胞或癌细胞,行免疫组化。
2 测定方法
(1)肺癌三项:用电化学发光免疫测定法,按罗氏试剂盒操作,电化学发光分析仪检测含量。
(2)Hsp90ɑ:用ELISA法按PROTGEN试剂盒步骤检测,酶免疫分析仪进行检测。
(3)TAP:取30μl全血,滴2滴血液涂血片,静置晾干,间隔均匀滴加凝聚助剂,自然干燥2小时后将其放置显微镜下,找TAP凝聚颗粒测定面积。TAP凝聚颗粒呈淡黄色、棕黄色或淡绿色,周围呈棕墨绿色或黑色,呈不规则类圆形。单颗凝聚颗粒面积>81 μm2的特异凝集物为有效凝集颗粒。若单颗颗凝聚颗粒面积≥225μm2,则结果为“该颗粒面积”;如果有效凝聚颗粒≥2,为所有颗粒实测面积之和×0.62为特异凝集物的最终数值。
四、判读标准
CEA正常参考值<5.0 ng/mL。NSE正常参考值<3.3ng/mL。CYFRA21-1正常参考值<16.3ng/mL。Hsp90ɑ正常参考值范围0~82ng/mL。TAP正常参考值:阴性:无明显凝聚物(面积0~121μm2);阳性:凝聚物较小(面积121~225μm2)/较大(面积≥225μm2)。
五、随访
电话或门诊随访,随访时间截止于2021年12月31日,期间退出6例(0.09%),失访7例(0.1%)。
六、统计学方法

结 果
一、外周血中肺癌三项、TAP和Hsp90a的表达水平。
与良性胸腔积液组比较,肺癌恶性胸腔积液组和中晚期肺癌组外周血中CEA、CYFRA21-1、NSE、TAP和Hsp90a的表达水平显著升高,且肺癌恶性胸腔积液组升高更明显(见表1)。
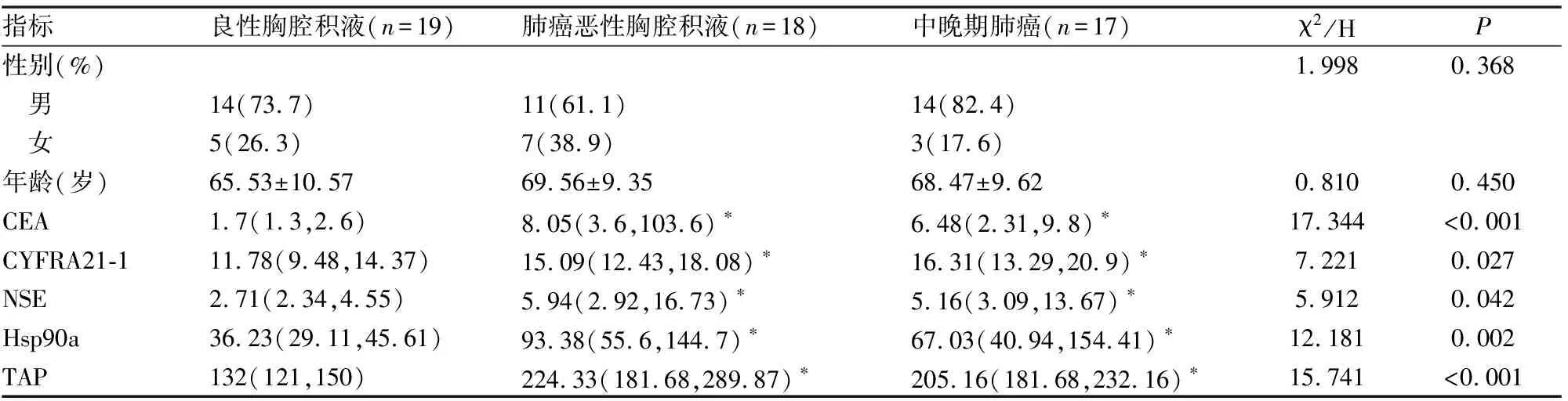
表1 三组患者外周血中CEA、CYFRA21-1、NSE、TAP和Hsp90ɑ的表达
二、外周血中肺癌三项、TAP和Hsp90a在肺癌恶性胸腔积液患者中的诊断价值
ROC曲线分析结果显示,外周血中CEA、CYFRA21-1、NSE、TAP和Hsp90a均具有诊断价值(P<0.05)(图1A)。进一步研究发现TAP和Hsp90a联合检测诊断价值更高,不仅高于单项指标的诊断价值,且TAP和Hsp90a联合检测AUC值(AUC=0.915)高于肺癌三项的AUC值(AUC=0.904)(P<0.05)(图1B)。
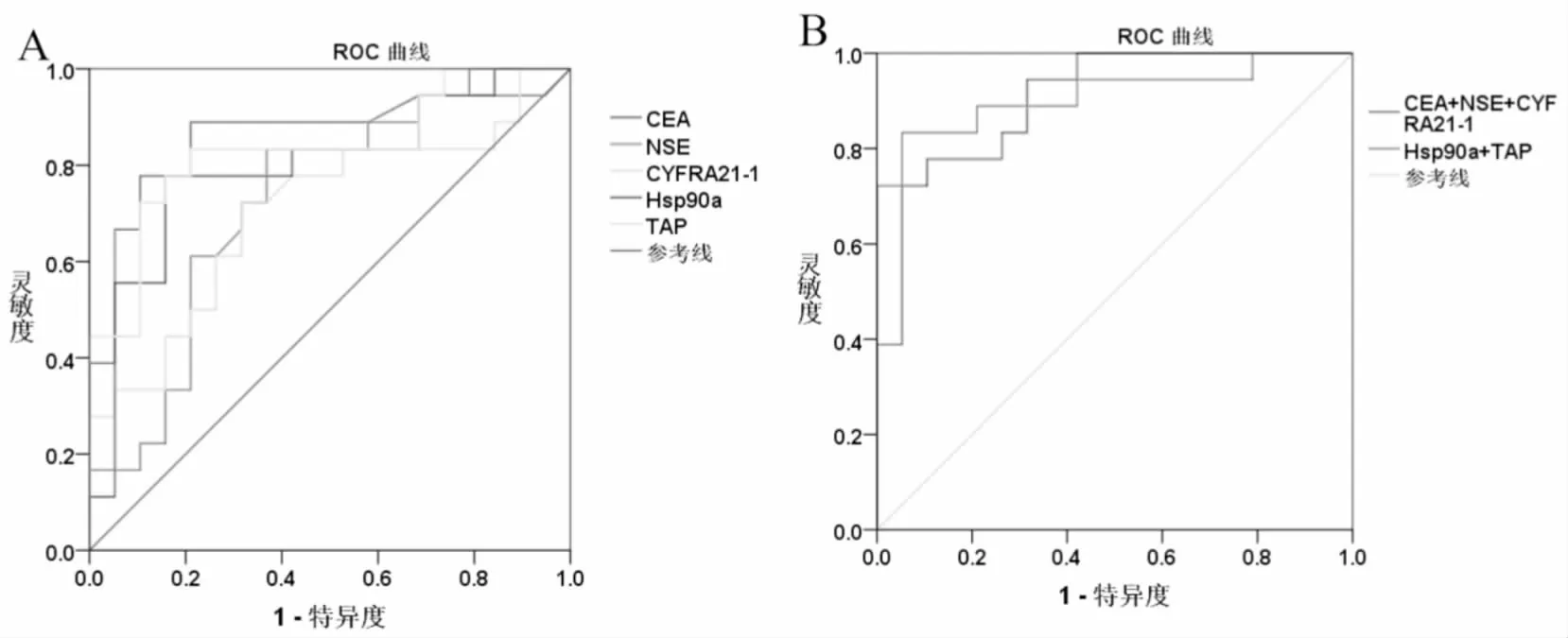
图1 A ROC曲线示外周血中肺癌三项、TAP和Hsp90a在肺癌恶性胸腔积液中的诊断价值.B ROC曲线示外周血中TAP和Hsp90a联合检测与肺癌三项在肺癌恶性胸腔积液中的诊断价值。
三、外周血中肺癌三项、TAP和Hsp90a在中晚期肺癌患者中的诊断价值
ROC曲线分析结果显示,外周血中CEA、CYFRA21-1、NSE、TAP和Hsp90a对中晚期肺癌患者均具有诊断价值(P<0.05)(图2A);联合检测较单项检测诊断价值更高,TAP和Hsp90a联合检测AUC值(AUC=0.892)高于肺癌三项的AUC值(AUC=0.879),TAP和Hsp90a联合检测对于中晚期肺癌患者的诊断价值高于肺癌三项(P<0.05)(图2B)。
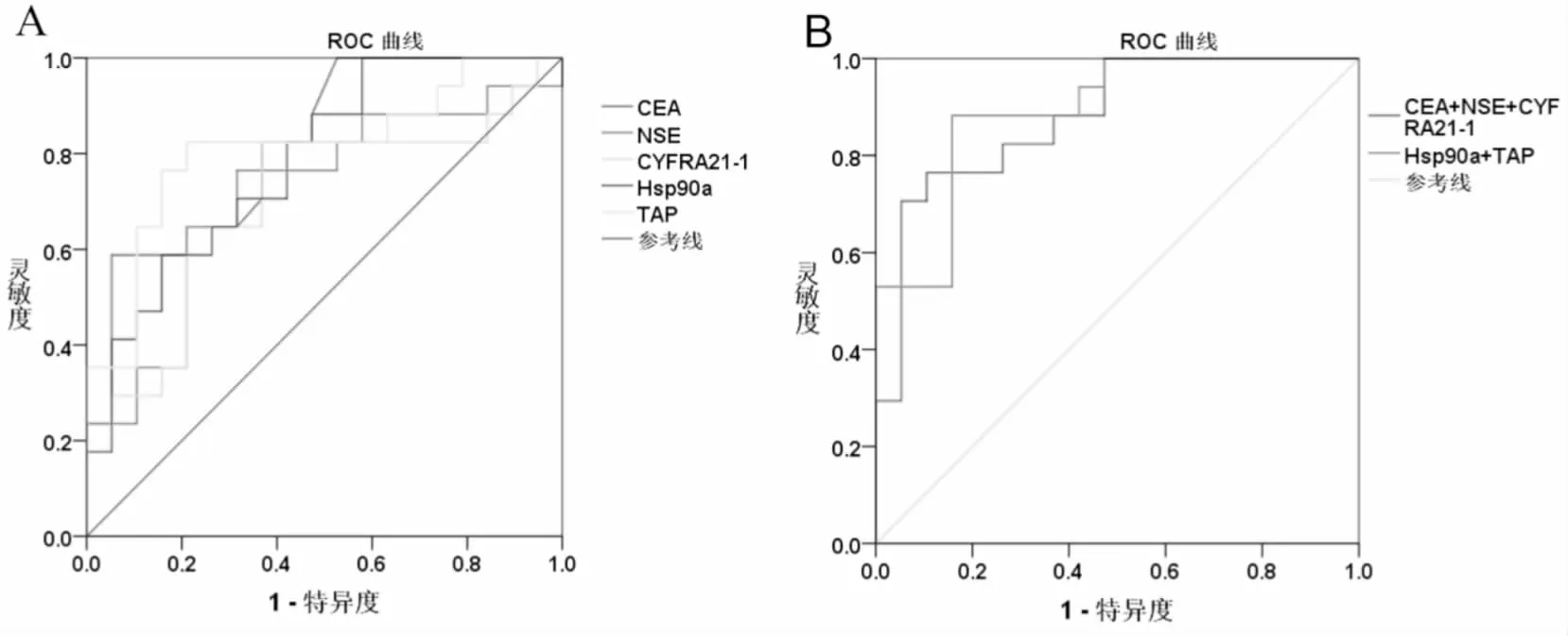
图2 A ROC曲线示外周血中肺癌三项、TAP和Hsp90a在中晚期肺癌中的诊断价值。B ROC曲线示外周血中TAP和Hsp90a联合检测与肺癌三项在中晚期肺癌中的诊断价值。
四、胸腔积液中肺癌三项、TAP和Hsp90a在肺癌恶性胸腔积液患者中的诊断价值
ROC曲线分析结果显示,胸腔积液中CEA、CYFRA21-1、NSE、TAP和Hsp90a对肺癌恶性胸腔积液患者均具有诊断价值(P<0.05)(表2、图3A);胸腔积液中TAP和Hsp90a联合检测AUC值(AUC=0.974)高于肺癌三项的AUC值(AUC=0.921),胸腔积液中TAP和Hsp90a联合检测对于肺癌恶性胸腔积液患者的诊断价值比肺癌三项更有意义(P<0.05)(图3B)。
图3 A ROC曲线示胸腔积液中肺癌三项、TAP和Hsp90a在肺癌恶性胸腔积液中的诊断价值。B ROC曲线示胸腔积液中TAP和Hsp90a联合检测与肺癌三项在肺癌恶性胸腔积液中的诊断价值。
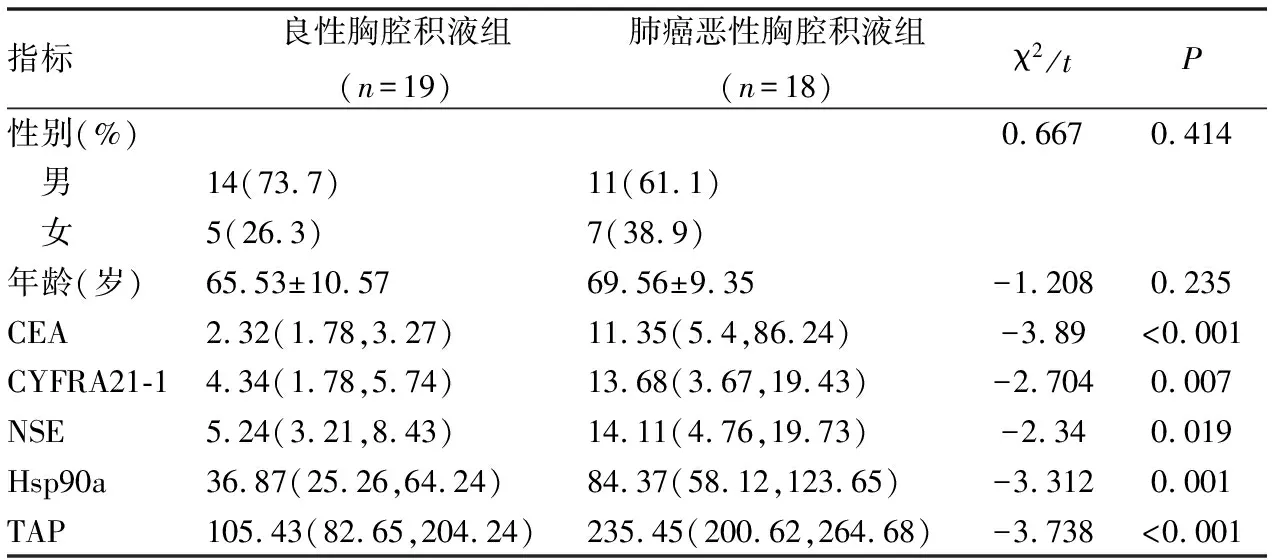
表2 两组患者胸腔积液中CEA、CYFRA21-1、NSE、TAP和Hsp90ɑ的比较
五、肺癌恶性胸积液患者生存期分析
单因素COX回归分析结果显示(表3),胸腔积液中的TAP和Hsp90ɑ与肺癌恶性胸腔积液患者生存期相关(P<0.05),将其分析结果中有统计学意义的指标进行多因素COX风险比例回归分析(表4),结果显示胸腔积液中TAP和Hsp90ɑ均为独立影响因素和危险因素(P<0.05),TAP和Hsp90ɑ表达量越高,生存期越短(图4A、图4B)。
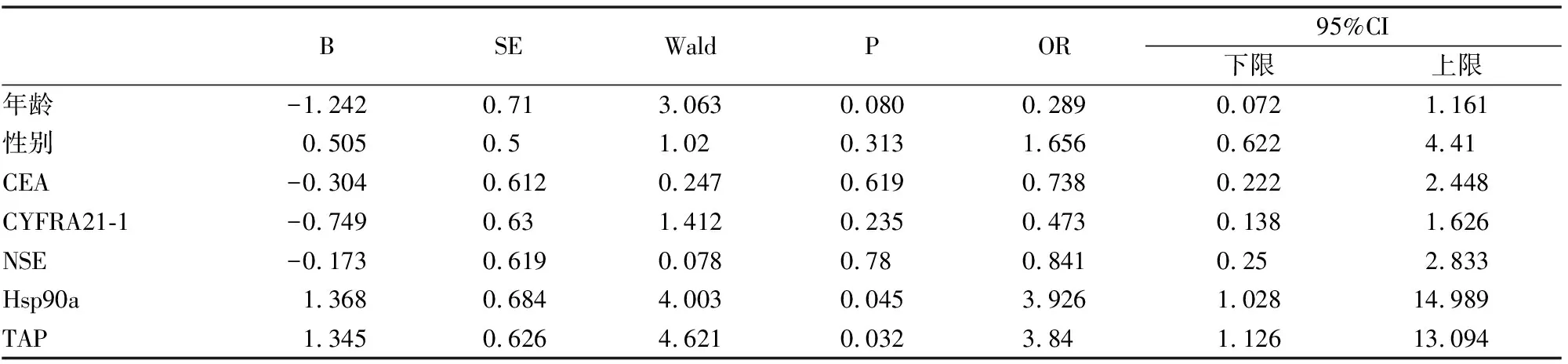
表3 单因素COX回归分析
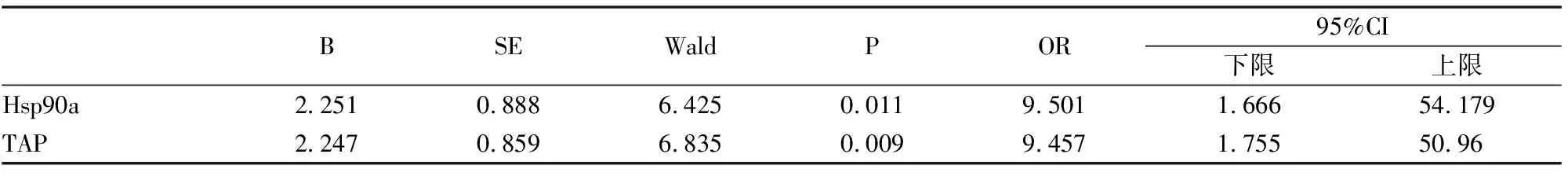
表4 多因素COX回归分析
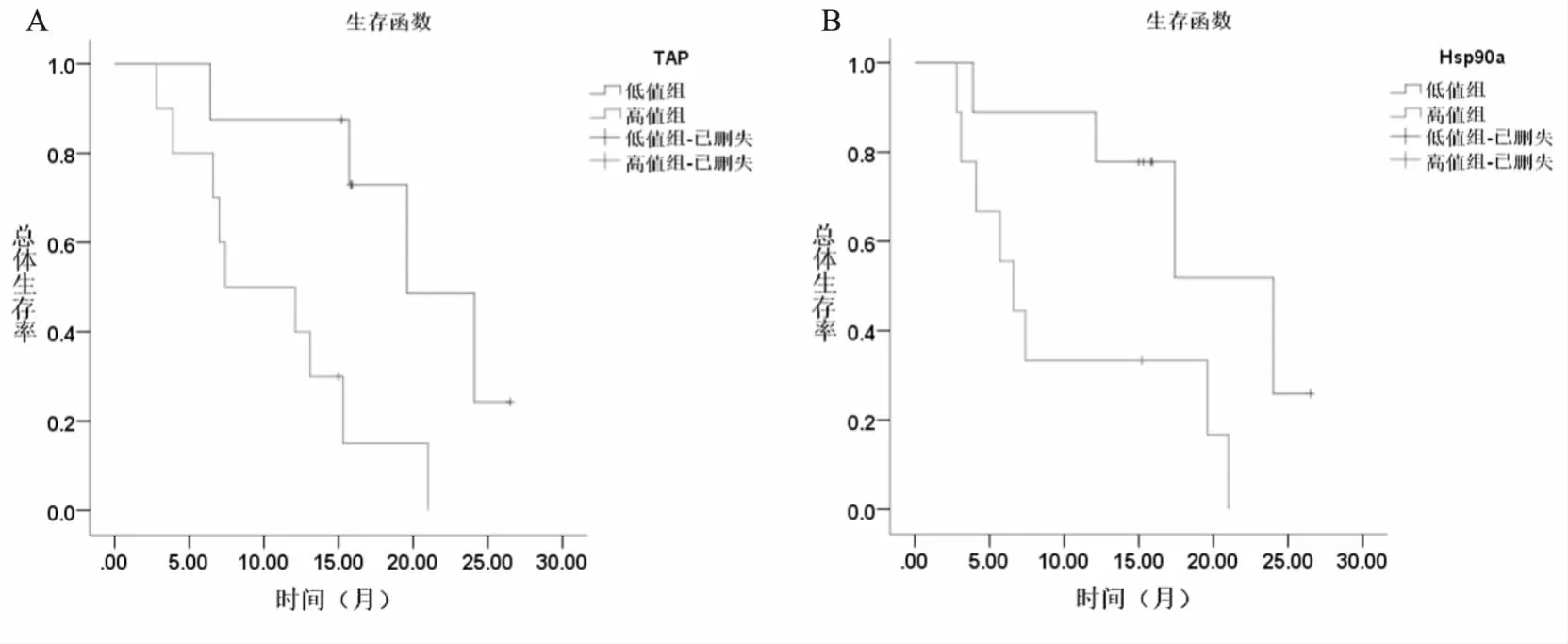
图4 A TAP作为独立影响因素的生存曲线图。B Hsp90a作为独立影响因素的生存曲线图。
讨 论
我国每年约有100万MPE患者,肺癌占MPE病因的1/3[10]。因MPE诊断阳性率差异大,阳性率偏低,受肿瘤负荷、病理诊断医师经验、肿瘤类型等多种因素影响[11],导致近40%MPE患者无法明确诊断。在过去的几十年中,肺癌恶性胸腔积液的5年生存率无显著提升。因此,寻找直接或间接反应恶性病变的肿瘤标志物,探讨其诊断价值及评估预后,是现今临床医学研究的热点。
肿瘤标志物在组织里的浓度较高,需要达到一定浓度才可以检测出,因此对检测技术的要求、组织取材量以及患者配合度,都有一定的要求,对诊断造成了一定的局限性,因此临床上多同时采用易获取的外周血用于协助诊断。TAP位于肿瘤细胞表面和细胞外基质中,糖链的分子小,易于定量测量,在疾病状态下改变较为显著,可间接反应细胞癌变的发生和发展情况。TAP可将几十种异常糖链糖蛋白高度聚集,极大地放大了肿瘤信号,从而在一定程度上提升了肿瘤检测灵敏度和准确性,有效地减少漏诊率。有研究证实,癌细胞表面异常化糖基、糖链的差异表达与其侵袭、发生、发展存在密切关联[12]。Hsp90α是存在真核细胞中的分子伴侣蛋白,参与细胞活化、凋亡、增殖、侵袭、转移。有报道称,肺癌患者癌组织中Hsp90α表达水平与临床分期、淋巴结转移呈正相关,恶性胸腔积液中Hsp90α表达明显升高,提示Hsp90α可能与肺癌恶性胸腔积液有关[13]。这与我们的研究结果一致,我们发现肺癌恶性胸腔积液组患者,无论是外周血还是胸腔积液中TAP和Hsp90α的表达水平,较良性胸腔积液组和中晚期肺癌组均明显升高,中晚期肺癌组外周血中TAP和Hsp90α表达,较良性胸腔积液组表达增高,差异均具有统计学意义。由此可见,TAP和Hsp90α对肺癌恶性胸腔积液具有潜在的诊断效能。
目前肿瘤标志物种类较多,由于单一指标检测对恶性肿瘤诊断的灵敏度与特异度均不高,故多采用联合检测。目前临床上广泛使用的肺癌三项可有效判断肺癌,但在肺癌恶性胸腔积液的诊断中,既往的研究结果提示其灵敏度和特异度相对较低。TAP和Hsp90α在肺癌恶性胸腔积液的研究甚少,二者联合检测目前尚未见相关报道。本研究中ROC曲线分析结果显示肺癌恶性胸腔积液组患者外周血和胸腔积液中TAP和Hsp90α联合检测的AUC值不仅高于良性胸腔积液组和中晚期肺癌组AUC值,还明显高于各组中肺癌三项的AUC值,提示TAP和Hsp90a联合检测对于肺癌恶性胸腔积液的诊断效能更优。进一步分析我们发现,肺癌恶性胸腔积液患者在胸腔积液中联合检测TAP和Hsp90α的AUC值高于外周血中的AUC值,说明胸腔积液中TAP和Hsp90α的联合检测在肺癌恶性胸腔积液中的诊断价值比外周血中联合检测更有意义;若胸腔积液和外周血同时检测,可能更有助于肺癌恶性胸腔积液的诊断。肺癌恶性胸腔积液患者胸腔积液中TAP和Hsp90α表达水平明显高于外周血中的表达,考虑与肺癌胸膜转移导致的恶性胸腔积液中肿瘤标志物的浓度增加有关,也意味着病情进展到终末期,预后可能也较差。为进一步验证,我们进行了维持1年的随访,经COX回归分析结果显示,胸腔积液中TAP、Hsp90a的表达水平与肺癌恶性胸腔积液患者预后密切相关,是影响生存期的独立危险因素。依据研究的预测模型,TAP和Hsp90a可指导疑似肺癌恶性胸腔积液患者进一步行病理检测确诊;并且联合患者临床相关资料、TAP和Hsp90a检测结果等可有效预测患者预后。
综上所述,TAP和Hsp90α在肺癌恶性胸腔积液患者胸腔积液和外周血中表达量均较高,二者联合检测可提升其诊断的特异度和灵敏度,对肺癌恶性胸腔积液的筛查、诊断及其预后,可能具有一定的临床应用价值。TAP和Hsp90α联合检测能否用于肺癌恶性胸腔积液风险评估模式,仍需要更多的临床数据进一步验证。
