上调的miR-452-5p抑制RORα的表达并促进肝癌细胞的增殖和迁移
2022-07-02史政科陈佩佩张怡轩杜亚楠柳晓泉
史政科,陈佩佩,张怡轩,魏 杰,杜亚楠,柳晓泉
(中国药科大学药物代谢动力学研究中心,南京 211198)
根据2018 年全球癌症统计数据显示,肝癌已经成为世界第二大癌症死亡原因[1]。肝细胞癌(hepatocellular carcinoma,HCC)是原发性肝癌的一种,其占比超过80%[2]。在不同风险诱因下,肝细胞癌的病因也不尽相同,其中HBV、HCV 感染仍是主要诱因[3-6],非酒精性脂肪肝病占比呈增加趋势[7]。肝细胞癌在分子水平具有高度异质性,其发病机制尚不明晰,且缺乏临床广泛认可的生物标志物[8],这造成了肝细胞癌早期诊断难,晚期治疗手段有限的困境。因此,研究HCC 在分子水平上影响疾病发生、发展的机制,对寻找临床诊断相关的标志物、提供新的治疗方法具有重要意义。
miRNA 是 非 编 码RNA(non-coding RNA,ncRNA)家族的成员之一,通常由19 ~25个左右的核苷酸组成,其主要通过调节基因转录后水平的表达,进而广泛参与到细胞各个生命过程中[9-10]。在哺乳动物中,miRNA 控制着50%的蛋白编码基因的表达[11],这表明miRNA 的表达水平会影响人类代谢与疾病的相关通路,同时与肿瘤发生、发展和转移显著相关[12]。现如今,诸多研究表明miR-452-5p 的异常表达影响到多种肿瘤的生物学进程。Lin等[13]研究表明,miR-452-5p通过调控ERK/MAPK 通 路 促 进 结 直 肠 癌 进 展。Zhai[14]等 报 道miR-452-5p 在肾细胞癌中的过表达通过抑制SMAD4/SMAD7 通路,加剧肾癌细胞的迁移和侵袭。在HCC 相关研究中,Zheng等[15]报道miR-452-5p 在肝细胞癌细胞中通过靶向CDKN1B,改变了细胞周期,进而促进肿瘤的发生。目前,在HCC 中miR-452-5p 的异常表达与HCC 患者预后生存的关系,及其对肿瘤进展、预后相关的调控机制还有待进一步研究。
本研究将结合靶基因预测数据库Targetscan-Human 和miRDB,组学数据库Gene Expression Omnibus(GEO)、肿瘤基因组图谱(The Cancer Genome Atlas,TCGA)和The Genotype-Tissue Expression(GTEx),运用miRNA 靶基因预测、基因差异表达分析、加权基因共表达网络分析(weight gene coexpression net analysis,WGCNA)等生物信息学方法,分析miR-452-5p 在HCC 中的差异表达对患者预后生存的影响,进一步筛选出miR-452-5p 影响患者预后总生存(overall survival,OS)的靶标基因。并在肝癌细胞中探究miR-452-5p 对该靶基因的调控,及其过表达对肝癌细胞增殖、迁移的影响。
1 材 料
1.1 数 据
GEO 数据库(http://www. ncbi. nlm. nih. gov/GEO/)中筛选并下载带有HCC 患者临床信息的数据集GSE14520。GSE14520 数据集包括美国国家癌症研究所的445个样本的基因表达数据谱,样本包含225 例肝癌组织和220 例正常肝组织。在TCGA 数据库(http://portal.gdc.cancer.gov/)中,获取肝癌患者转录组测序(第3级)的表达谱数据集,包括373 例肝癌组织和50 例正常组织样本。226个健康肝组织样本的mRNA 表达数据均来自GTEx V8版本(http://gtexportal.org/home/datasets)。
1.2 试 剂
DMEM 高糖培养基和胎牛血清(美国Gibco 公司);青霉素-链霉素双抗、Trizol RNA 提取试剂、逆转录试剂盒、Hieff®qPCR SYBR Green Master Mix(low Rox)、β-actin 抗体、过氧化物酶标记山羊抗兔IgG 二抗(上海翌圣生物科技有限公司);胰蛋白酶(江苏凯基生物技术公司);miR-452-5p 模拟物(miR-452-5p mimics)、miR-452-5p 抑 制剂(miR-452-5p inhibitor)、模拟物阴性对照(mimics negative control,mimics NC)、抑制剂阴性对照(inhibitor negative control,inhibitor NC)(广州锐博生物技术公司);Lipofectmine-2000转染试剂(美国Thermo公司);miR-452-5p 特异性逆转录引物、miR-452-5p、U6、RORα 和GAPDH 的扩增前引物及后引物(北京擎科生物公司);RIPA细胞裂解液、一抗稀释液、封闭液、双荧光素酶报告基因试剂盒(江苏碧云天生物科技有限公司);RORα 抗体(中国Proteintech公司);RORα 野生型(Wt)和突变型(Mut)荧光质粒,分别向GP-pmirGLO 克隆载体的SacI/XhoI 克隆位点插入RORα-hsa-miR-452-5p wt 和RORα-hsamiR-452-5p mut 基因序列得到,质粒抗性是Ampicillin(上海吉玛基因有限公司);其他试剂均为市售分析纯。
1.3 仪 器
二氧化碳培养箱、QuantStudio3 实时荧光定量PCR 系统(美国Thermo 公司);VersaMax(美国Molecular Devices公司);电泳仪、转膜仪(美国Bio-Rad公司);多功能凝胶成像系统(中国Tanon公司);倒置荧光显微镜(日本Olympus 公司);SynergyTMH1全功能微孔板检测仪(美国伯腾有限公司)。
1.4 细 胞
人肝细胞癌细胞Huh7 细胞株购自中国科学院细胞库。
2 方 法
2.1 miR-452-5p的生存分析和临床样本验证
在TCGA 肝细胞肝癌(liver hepatocellular carcinoma,LIHC)患者数据中剔除miR-452-5p 缺失的样本,进行差异表达分析。根据miR-452-5p 的表达水平,将具有完整临床信息的HCC 患者以三分位点划分为高表达组(前33%)和低表达组(后33%),运用R 语言中的Survminer 和Survival 包,对两组患者的OS 进行Kaplan-Meier 生存分析(显著标准为P <0.05)。基于TCGA 第三级转录组表达谱数据,纳入具有完整miRNA 表达数据的371 例肝癌组织样本和50例正常肝组织样本作为分析对象,通过R 包ggplot2 和ggsignif 对miR-452-5p 在肝癌组织和正常组织进行差异表达验证分析。
2.2 miR-452-5p靶基因预测
从TargetscanHuman[16]和miRDB数据库[17]获取miR-452-5p的预测靶基因集,将miRBD数据库中靶向得分(Target Score)前50%的基因与Targetscan-Human 数据库所预测的miR-452-5p 靶基因进行交集运算,得到miR-452-5p的交集靶基因集合。
2.3 GSE14520 差异表达分析和加权基因共表达网络分析
利 用R 语言 中 的edgeR 和limma 包 对GSE14520 数据集的基因表达矩阵进行标准化后再进行差异分析。筛选差异表达基因的标准为|log2(fold change)|>1且P <0.05,在此标准下得到差异表达基因(Differentially Expressed Genes,DEGs)集合。
GSE14520 数据集中全部225 个肿瘤患者样本,以聚类树上限高度120,下限高度20 的标准剔除离群样本后,得到209个具有完整临床信息的肝细胞癌患者样本,以209个患者样本中变异系数前5 000 的基因组成新的基因表达矩阵,进行WGCNA 分析。运用R 语言中WGCNA 包[18],使用一步法进行共表达网络的构建,并设定单个模块最低基因数为30。计算构建网络的软阈值β,再根据设定的软阈值得到邻接矩阵。邻接矩阵被转化为一个拓扑重叠(topological overlap matrix,TOM)矩阵,利用该矩阵进一步计算表达模式相近的基因,进而组合成表达模式不同的模块。计算出代表整个模块表达模式的模块特征基因(module eigengene,ME)。将患者的临床表征信息和ME 进行相关性计算,找出对临床表征有显著影响的关键模块,并提取出关键模块中的ME以待后续分析。
2.4 确定临床相关的miR-452-5p 的异常靶基因并验证
运用R 语言中intersect 函数对上述差异表达基因集合、交集靶基因集合、关键模块基因集合进行交集运算,筛选出异常表达且显著影响临床表征的miR-452-5p 靶标基因。通过整合TCGA 中LIHC数据集和GTEx 中正常肝组织转录组数据,得到具有完整mRNA 表达数据的371 例肝癌组织与276例正常组织组成的counts 矩阵样本,再根据RNAseqDB 包的流程计算得到特征counts 矩阵,使用combat 函数进一步校正批次效应,在校正后的矩阵中对筛选出的关键靶基因进行差异表达验证分析。根据TGCA 中LIHC 数据集中的关键基因的表达水平,以三分位点为分割点将患者分成高、低表达组进行生存分析。
2.5 细胞培养及转染
用含有10%胎牛血清和1%的青霉素和链霉素的DMEM 高糖培养基培养Huh7 细胞,并置于5% CO2且37 ℃恒温的孵箱中。选择生长对数期细胞进行转染,按照Lipofectmine-2000转染试剂的说明,将miR-452-5p 模拟物阴性对照、miR-452-5p模拟物、miR-452-5p 抑制剂阴性对照、miR-452-5p抑制剂分别转染Huh7 细胞,得到相应的4 组转染细胞,以不同的转入物质分组、命名。
2.6 miR-452-5p对靶基因调控的实验验证
收取培养48 h后的4组转染细胞,分别进行实时荧光定量PCR(RT-qPCR)和免疫蛋白印迹(Western blot)实验,验证miR-452-5p 的转染效率并分析4 组转染细胞中靶基因在mRNA 水平和蛋白水平表达量的变化。用Trizol试剂提取4组细胞中 的 总RNA,将 总RNA 1 μg 逆 转 录 为cDNA,cDNA 经过QuantStudio3 系统扩增为目的基因片段,分别以U6 和GAPDH 作为内参,采用2-ΔΔCt法计算miR-452-5p和靶基因的相对表达量。
用含有1%PMSF 的蛋白裂解液(RIPA)裂解培养48 h 后的4 组转染细胞,经BCA 法蛋白定量后,取蛋白20 μg 在10% SDS-PAGE 胶上进行分离,湿转法将胶上的蛋白转移到PVDF 膜上,封闭液封闭2.5 h,分别用兔抗RORα(1∶3 000 稀释)和兔抗β-actin(1∶2 000 稀释)一抗4 ℃孵育过夜。次日经TBST 洗膜3 次,每次10 min,室温孵育二抗(1∶4 000 稀释)1 h,再经TBST 洗膜3 次,每次5 min,使用ECL 发光液显色,用Tannon Image J 软件对蛋白灰度进行半定量分析。
2.7 CCK-8和Transwell实验
利用CCK-8 法检测4 组转染Huh7 细胞的增殖能力,将转染后的4组细胞按照每孔3×103个接种于96孔板中。在培养0,24,48,72,96 h后,向每孔加入含有CCK-8试剂10 μL的反应体系,37 ℃孵育2 h,在450 nm处测定反应后体系的吸收度。
Transwell 实验中,将4 组转染细胞以每孔1 ×105个细胞的数量分别接种到含有聚碳酸酯膜且孔径为8 μm,直径约6.5 mm 的转染小室的上层,向上层加入无血清培养基200 μL,将小室置于24 孔细胞培养板中,小室下层每孔加入含有10%胎牛血清的培养基650 μL。培养48 h 后,小室上下层的细胞经90%甲醇固定15 min,再用0.1%的结晶紫溶液染色20 min,棉签擦去上层细胞,用相差显微镜观察并拍照记录穿膜并附于下层的细胞,ImageJ软件用于细胞计数。
2.8 双荧光素酶报告基因实验
将miR-452-5p 模拟物阴性对照、miR-452-5p模拟物、miR-452-5p 抑制剂阴性对照、miR-452-5p抑制剂分别和RORα Wt荧光质粒、RORα Mut荧光质粒共转染到Huh7 细胞中,共转染48 h 后,按照双荧光素酶报告基因试剂盒的说明书测定荧光强度。
2.9 数据统计分析
生物信息学分析部分的数据处理由R 语言完成。实验部分的数据均在GraphPad Prism 8.0 进行统计分析,结果以xˉ± s 表示,P <0.05 被认为有显著性差异,P <0.01被认为有极显著差异。
3 结 果
3.1 miR-452-5p 差异表达的分析及其对肝细胞癌预后总生存期的影响
结合TCGA 中肝癌患者转录组数据,剔除一例miR-452-5p 缺失样本后,观察到miR-452-5p 在372例肝癌组织中表达量显著高于50 例正常肝组织(图1-A)。根据miR-452-5p 的表达水平,将具有完整生存信息的361 例肝癌患者以三分位点划分成上三分位的高表达组(119 例)和后三分位的低表达组(119例),如图1-B所示,miR-452-5p的表达量与肝细胞癌患者预后总生存时间显著相关(P =0.012),说明miR-452-5p 的过表达预示着患者存在较短的预后生存时间。
3.2 确定miR-452-5p的预测靶基因集合
基于miRDB 数据库中预测的靶标得分,取排名前50%(得分大于75)的miR-452-5p 预测靶基因,得到一个包括299 个基因的集合。从TargetscanHuman 数据库,得到包含342 个基因标签的miR-452-5p 预测靶基因集合。将两个预测靶基因集进行交集运算,最终得到一个含有99 个基因标签的靶基因交集。
3.3 从GSE14520 中寻找DEGs 和临床相关的基因共表达模块(module)

Figure 1 Expression level of miR-452-5p in The Cancer Genome Atlas-Liver Hepatocellular Carcinoma (TCGA-LIHC) dataset and Kaplan-Meier survival analysisA:Boxplot showed the expression level of miR-452-5p in TCGA-LIHC dataset(***P <0.001);B:Survival plot of miR-452-5p between high expressed group and low expressed group
通过对比12 399 个基因在肝细胞癌组织和正常肝组织中的表达,在|log2(fold change)| >1 且P <0.05 的标准下,共找到916 个异常表达的基因,其中有573个基因表达高于正常组织,343个基因表达低于正常水平(图2)。
从GSE14520数据集中225例肝细胞癌患者样本中,经筛选纳入209 例患者的变异系数前5 000的基因组成新的表达矩阵,进行WGCNA 分析,确定与患者临床表征相关的基因共表达模块。当无尺度拟合指数R2定为0.9时,通过计算得到最佳软阈值β=6,并得到邻接矩阵和TOM 矩阵。通过R语言中WGCNA 包,运用一步法建立基因共表达网络,并确定13 个不同的基因共表达模块(图3-A)。然后,计算每个模块的特征基因与不同的临床表征之间的相关性。通过模块-特征热图(图3-B),看到MEtuquoise 模块与肿瘤大小、TNM 分期、BCLC 分期、甲胎蛋白含量、生存时间、复发状态等临床表征都有较强的相关性。这预示着MEturquoise 模块基因的表达模式对肝细胞癌的进展和预后状态的影响权重最高。
3.4 确定影响肿瘤进展及预后的miR-452-5p 靶基因

Figure 2 Volcano plot of differentially expressed genes (DEGs) in GSE14520
图4 中,miR-452-5p_target、GSE14520_DEGs、Turquoise 分别代表了含有99 个基因标签的miR-452-5p 预测靶基因集、GSE14520 差异表达基因集和肝细胞癌预后相关的共表达模块基因集,三者交集运算后得到两个关键靶基因LAMC1 和RORα。图5 验 证 了LAMC1 和RORα 在TCGAGTEx 数据集中的异常表达。根据LAMC1 和RORα 的表达量将肝癌患者以三分位点各自划分成高表达组118例和低表达组118例,经过Kaplan-Meier生存分析,发现LAMC1的表达量与患者预后生存时间没有显著性关联,而RORα过低的表达则显著影响了HCC 患者的预后总生存,RORα 表达量低的患者通常预后较差(图6)。据以上结果推断,与肝细胞癌患者预后生存显著相关的miR-452-5p,在肝癌组织的过表达可能通过靶向RORα,降低其表达,从而加剧肝癌进展和患者的预后不良。

Figure 3 Weight gene co-expression net analysis(WGCNA)of GSE14520A:Cluster dendrogram confirmed 13 different co-expression modules;B:Heatmap of correlation between 13 modules and clinical traits
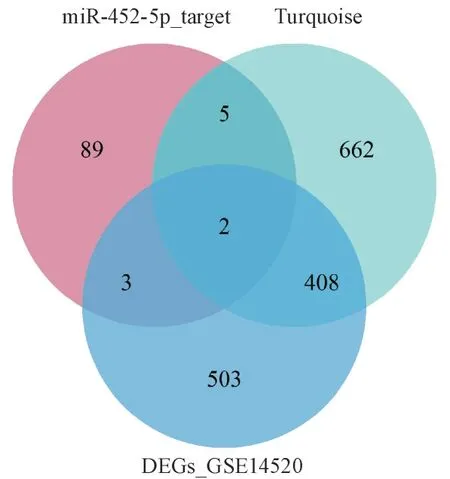
Figure 4 Identification of dysregulated and clinical-related miR-452-5p target genes from three gene sets
3.5 确定miR-452-5p对RORα的调控关系
分别将miR-452-5p 模拟物阴性对照、miR-452-5p 模拟物、miR-452-5p 抑制剂阴性对照、miR-452-5p 抑制剂分别转入Huh7 细胞中,根据转染物质将4 组转染后Huh7 细胞分别命名为mimics NC、mimics-452-5p、inhibitor NC 和inhibitor-452-5p。RT-qPCR 结果 如 图7 所示,在图7-A 中,mimics-452-5p 组中miR-452-5p 的相对表达量远高于其阴性对照组,而inhibitor-452-5p组中miR-452-5p的表达量显著低于inhibitor NC 组,该结果验证了miR-452-5p在Huh7细胞中良好的转染效率。根据图7-B 显示,在miR-452-5p 过表达 的Huh7 细胞 中,RORα 的mRNA 水平显著降低,而在有着miR-452-5p 沉默效果的inhibitor-452-5p 组中,RORα 的表达量有所上升。以上实验结果表明,在肝癌细胞内RORα的表达与miR-452-5p的表达水平呈负相关。图8的结果表明,过表达的miR-452-5p显著降低了Huh7 细胞中RORα 的蛋白水平,而抑制miR-452-5p 后,RORα 的蛋白水平相应的上升。综合RTqPCR 和WB 的实验结果可知,miR-452-5p 在转录后水平抑制了RORα的翻译,降低了其mRNA和蛋白的表达水平。
3.6 miR-452-5p 对Huh7 细胞增殖能力和迁移能力的影响
当miR-452-5p 过表达或者被沉默后,利用CCK-8 法检测Huh7 细胞96 h 内增殖情况。图9 的增殖曲线显示,mimics-452-5p组和inhibitor-452-5p组与其各自的阴性对照组相比,细胞数量都在48 h开始出现显著性差异,mimics-452-5p 组的细胞数量显著升高,而inhibitor-452-5p组则显著低于其对照组。以上结果表明,过表达的miR-452-5p 加速了Huh7 细胞的增殖;而miR-452-5p 沉默的Huh7细胞增殖能力相对降低。
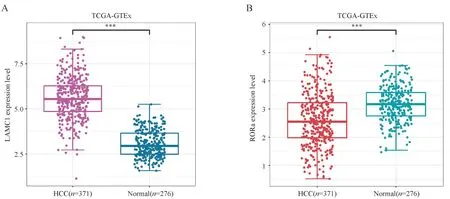
Figure 5 Validation of abnormally expressed LAMC1 and RORαA:Boxplot of LAMC1 expression in The Cancer Genome Atlas-The Genotype-Tissue Expression(TCGA-GTEx)dataset;B:Expression of RORα in TCGA-GTEx dataset***P <0.001

Figure 6 Overall survival analysis of LAMC1 and RORαA:Survival analysis of LAMC1 in TCGA-LIHC dataset;B:Survival analysis of RORα in TCGA-LIHC dataset

Figure 7 RT-qPCR tested the expression level of miR-452-5p and RORα in 4 transfected Huh7 cells(xˉ± s,n = 3)A:Relative expression level of miR-452-5p in 4 transfected Huh7 cells;B:Relative expression level of RORα in 4 transfected Huh7 cells***P <0.001
Transwell 实验结果(图10)表明,miR-452-5p过表达组发生迁移的细胞数,相对于其阴性对照组显著增加;而inhibitor-452-5p组平均细胞迁移数也明显低于阴性对照组。4 种转染后的Huh7 细胞迁移实验结果显示,miR-452-5p 的确增强了肝癌细胞Huh7 的迁移能力,而inhibitor-452-5p 沉默组Huh7 细胞的迁移能力下降。以上增殖、迁移实验的结果表明,过表达的miR-452-5p 会加剧肝癌细胞的恶性行为,这从细胞层面揭示了过表达的miR-452-5p可能是加剧肝癌患者预后不良的原因。
3.7 双荧光素酶报告基因实验验证miR-452-5p与RORα靶向结合关系
为验证miR-452-5p 与RORα 的靶向结合关系,通过TargetscanHuman 和miRDB 数据获得两者结合位点的序列。图11A 显示了miR-452-5p 与RORα 3′UTR 区6 402 ~6 408 和8 692 ~8 698 两段序列位点的结合情况,Wt 质粒包含原始结合序列,Mut 质粒则将结合位点序列进行替换。图11B中显示了模拟物阴性对照、miR-452-5p 模拟物、抑制剂阴性对照、miR-452-5p 抑制剂与RORα 的Wt、Mut 质粒共转染的Huh7 细胞,以及单独转染Wt 质粒或Mut质粒的空白质粒组细胞的相对荧光活性。从相对荧光强度来看,RORα 的Wt 质粒与miR-452-5p 模拟物、miR-452-5p 抑制剂共转染组分别低于或高于各自的阴性对照组和Wt 空白对照组;而所有Mut 共转染组没有显著变化。以上结果说明,miR-452-5p 能够靶向结合于RORα 的3′UTR区,进而抑制RORα转录后水平的表达。
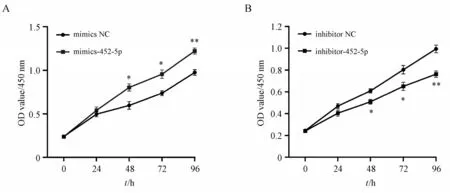
Figure 9 CCK-8 assay testified the viability of transfected Huh7 cells(xˉ± s,n = 3)A:Cell viability of mimics-452-5p and mimics negative control(NC)groups;B:Cell viability of inhibitor-452-5p and inhibitor NC groups*P <0.05,**P <0.01
4 讨 论
miRNA 在癌症中的异常表达会起到促癌或抑癌的作用,其通过调控相关癌基因或通路影响着癌症的发生、进展、预后和耐药。最新研究表明miRNA 在肿瘤免疫逃逸过程中发挥着重要作用,也有研究探讨了miRNA 作为癌症治疗新靶标的可能[19-20]。miR-452-5p 已经被证实在多种癌症组织中存在异常表达,其作为促癌或抑癌因子作用于肿瘤进展相关基因和通路具有组织特异性[21-22]。在肝癌组织中,miR-452-5p 的表达高于正常组织,但其对肿瘤进展和临床预后的影响机制的研究目前较少。为探索miR-452-5p在HCC 中可能的作用机制,本研究基于GEO、TCGA 等数据库,运用生物信息学方法,筛选出miR-452-5p 影响患者预后的关键靶基因。在HCC 中,miR-452-5p 通过靶向抑制RORα转录后水平的表达,进而促进肝癌细胞的增殖和迁移。

Figure 10 Migration capacity were checked by the Transwell assay(xˉ± s,n = 5)***P <0.001
RORα 属于维甲酸受体相关孤儿受体家族(Retinoid-related-orphan receptors,RORs)的一员。过往研究表明,RORα在多种肿瘤中可作为肿瘤抑制因子,起到抗癌作用,其过低的表达量与肿瘤进展密切相关[23]。在本研究中,过表达的miR-452-5p 通过靶向结合RORα 的3′UTR 区进而抑制其表达,而RORα在肝癌中发挥着抑癌因子作用的研究已有文献报道。在Liu 等[24]的研究中,RORα 通过下调趋化因子CXCL5 抑制肝癌细胞的增殖、迁移和侵袭。根据Huang等[25]的研究,得知RORα会通过抑制wnt/β-cantine通路来抑制肝细胞癌的进展。Han 等[26]研究表明,SORBS2 与RORα 的结合起到稳定后者mRNA的作用,进而发挥RORα的抑癌作用。因此,当RORα 的表达量降低时,其抑癌作用减弱,从而间接促进肝癌细胞的增殖、迁移,加剧肝癌患者的预后不良。
本研究发现,miR-452-5p的过表达和RORα的表达量降低都会显著影响肝癌患者的OS;RORα所在的MEturquoise 基因共表达模块,与HCC 患者的复发状态、TNM 分期、BCLC 分期和OS 都相关;上调的miR-452-5p 在mRNA 水平和蛋白水平都抑制了RORα 的表达,降低了其抑癌作用,从而加剧了肝癌细胞的增殖和迁移。这一发现为HCC 中寻找预后标志物和潜在治疗靶点提供了新的视角。
