正交优化黄连多糖提取工艺及其对α-葡萄糖苷酶的作用研究
2022-07-01王长凤
王长凤
黄连为毛茛科黄连属植物黄连(CoptischinensisFranch)、三角叶黄连(CoptisdeltoidenC. Y. Cheng et Hsiao)或云南黄连(Coptisteetawall.)的干燥根茎,是临床治疗中常用的中药材。黄连味苦,性寒,具有清热祛湿、泻火解毒的功效[1-3]。黄连多糖是黄连的重要活性成分,现代药理学研究发现黄连多糖具有降血糖、抗氧化、抗病毒等生物活性作用[4-6]。
目前黄连多糖的提取方法多为水提取法,该方法简单、容易操作,但是其多糖提取率不高,容易造成多糖损失[7]。此研究利用超声辅助提取黄连多糖,并对提取工艺进行正交优化,同时就黄连多糖对α-葡萄糖苷酶活性的作用进行研究,以期为黄连的研究与开发提供理论基础。
1 仪器与试药
黄连购买于河南省辉县药材市场,经范胜莲副主任中药师鉴定为毛茛科植物黄连的根茎;α-葡萄糖苷酶(北京索莱宝科技有限公司);4-硝基苯-α-D葡萄糖苷(PNPG,美国Sigma公司);浓硫酸、苯酚等其它试剂为分析纯。WF-万能粉碎机(江阴市康和机械制造有限公司);CHG型超声提取器 (德阳四创科技有限公司);紫外分光光度计UV7(梅特勒-托利多国际贸易(上海)有限公司)。
2 方法
2.1 提取工艺流程采用超声辅助提取法进行黄连多糖的提取,并利用Sevage法除去蛋白质,得到黄连多糖提取物,具体流程为:黄连→粉碎→过筛→石油醚回流脱脂脱色 3 次(1.5 h /次) →烘干→超声辅助提取→抽滤→滤液减压浓缩→5 倍体积 95% 乙醇沉淀12 h→6000 r/min 离心20 min→沉淀物→无水乙醇洗涤→水溶→Sevage法脱蛋白5次→冷冻干燥→多糖粗品[8]。
2.2 多糖含量测定称取葡萄糖对照品 50 mg,加水溶解定容至100 ml容量瓶中,备用。精密移取 0、0.5、1.0、2.0、3.0、4.0、5.0 ml对照品溶液,定容于 50 ml容量瓶中。分别精密移取2 ml于试管中,分别加入1.0 ml 6%苯酚和5.0 ml浓硫酸混匀,静置 10 min,冷却至室温,于 490 nm 处测定吸光度。以多糖含量(mg)为横坐标,吸光度(A)为纵坐标,绘制标准曲线[9]。通过线性回归得出方程为Y=12.312X-0.0351,线性范围为0.005 ~0.05 mg/ml,相关系数为r=0.9998。
2.3 正交优化超声辅助提取工艺称取2.0 g黄连干粉若干份,分别选取液料比(15∶1、20∶1、25∶1、30∶1、35∶1 ml/g)、提取时间(20、30、40、50、60 min)、提取功率(60、70、80、90、100 W)进行单因素实验。在单因素试验基础上,采用正交试验优化黄连多糖提取工艺。见表1。

表1 正交试验因素水平表
2.4 黄连多糖对α-葡萄糖苷酶的抑制作用及抑制机制反应在96孔板上进行,每组设3个复孔,阿卡波糖为阳性对照药物[10]。测定组:112 μl磷酸缓冲液(pH=6.8),加入0.2 U/ml的α-葡萄糖苷酶20 μl,二甲基亚砜8 μl,加入50μl的待测提取物,37 ℃恒温孵育20 min后加入2 mmol/L PNPG 20 μl,37 ℃恒温反应15 min。再加入1 mol/L 碳酸钠溶液100 μl终止反应,于405 nm波长下测定吸光度。同时做相同体系下,空白组:不加抑制剂和α-葡萄糖苷酶,其它条件与测定组相同;未加抑制剂测试组:不加抑制剂,其它条件与测定组相同;未加酶空白组:不加α-葡萄糖苷酶,其它条件与测定组相同。均用蒸馏水作空白,于405 nm波长处分别测定吸光度值。样品对α-葡萄糖苷酶活性抑制率公式如下:抑制率(%)=(A对照-A样品)/(A对照-A空白)×100%。式中:A空白为空白对照组的吸光度值;A对照为未加样品的吸光度值;A样品为样品组的吸光度值。并用SPSS 19.0软件求出相对应半数抑制浓度IC50。
2.5 黄连多糖对α-葡萄糖苷酶抑制类型测定参照2.4项下方法,底物PNPG浓度依次为0.067,0.1,0.2,0.5和1.0 mmol/L。在多糖浓度分别为1 mg/ml和2 mg/ml时,记录每分钟PNP吸光度值,测定酶促反应速度V。采用Lineweave-Burk作图法,1/C为横坐标,1/V为纵坐标,确定抑制类型,式中C为底物PNPG浓度,V为酶促反应速度,根据米氏方程计算动力学常数[11]。
3 结果与讨论
3.1 单因素试验结果
3.1.1 液料比对多糖提取率的影响液料比对于多糖的提取具有十分关键的影响,液料比过大,可能造成多糖的提取率降低且其余杂质也容易一起提取出来,从而影响多糖纯度,加大后续纯化的难度。若液料比过小,容易出现多糖提取不充分的情况。因此此实验在超声功率90 W、提取时间30 min的条件下,考察液料比对黄连多糖提取率的影响。在料液比为15∶1~25∶1 ml/g时,黄连多糖提取率随提取溶剂体积的增加而增大,当液料比为25∶1 ml/g时,黄连多糖的提取率达到最大为5.31%;随着溶剂体积继续增加,多糖提取率降低。出现这种趋势的原因可能是提取溶剂体积增大,多糖质量浓度降低,传质推动动力变大,提取速度增加,提取率增大;当溶剂体积继续增加达到一定数值时,提取率缓慢降低,可能是因为有大量的杂质溶出,影响多糖浸出率[12]。见图1。

图1 液料比对多糖提取率的影响
3.1.2 提取时间对多糖提取率的影响提取时间是影响多糖提取率的重要因素之一。若提取时间过短,容易出现多糖提取不充分的情况,造成资源的浪费。若提取时间过长,可能会导致多糖的结构发生改变,影响多糖的提取率和稳定性。因此,在超声功率90 W、液料比30∶1 ml/g的条件下,观察提取时间对黄连多糖提取率的影响。在20~40 min内,多糖提取率随提取时间增加而增大,在提取时间为40 min时,提取率最大为5.56%。当提取时间超过40 min后,多糖提取率逐渐下降,这可能是因为超声辅助时间过长导致黄连多糖的结构受到破坏,进而导致多糖提取率降低。见图2。
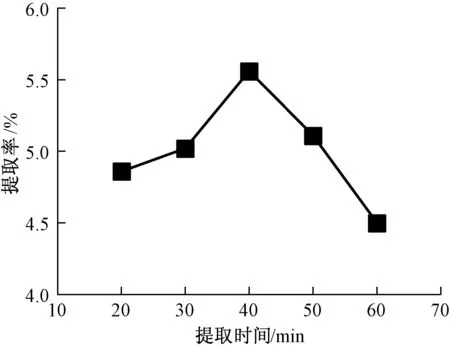
图2 提取时间对多糖提取率的影响
3.1.3 提取功率对提取率的影响超声辅助功率在多糖提取过程中起到十分关键的作用,超声辅助提取通过空穴效应、热效应和机械效应提高多糖的提取效率。若超声功率过高,容易破坏多糖的结构和性质。若超声功率过低,则起不到辅助提取的作用,进而导致多糖提取率偏低的情况出现。因此,在液料比30∶1 ml/g、提取时间30 min的条件下,观察提取功率对黄连多糖提取率的影响。在60~90 W内,多糖提取率逐渐增加。当功率大于90 W后由于超声功率过高,多糖结构受到破坏,不利于黄连多糖的提取[13]。见图3。

图3 提取功率对多糖提取率的影响
3.2 正交试验结果选取的3个单因素对于黄连多糖提取率的影响顺序为:B(提取时间)>C(提取功率)>A(料液比)。黄连多糖提取最优工艺参数为A2B3C3,即液料比40 ml/g,提取功率100 W,提取时间 30 min。采用优化提取条件进行工艺验证试验,测得多糖平均提取率为8.06%(n=3,相对标准偏差为0.89%,8.06%的提取率是根据最优工艺参数为A2B3C3,即液料比为40 ml/g,100 W提取功率,30 min提取时间,进行3次实验得到的平均值),高于正交试验各组,说明该工艺重复性较好。见表2。
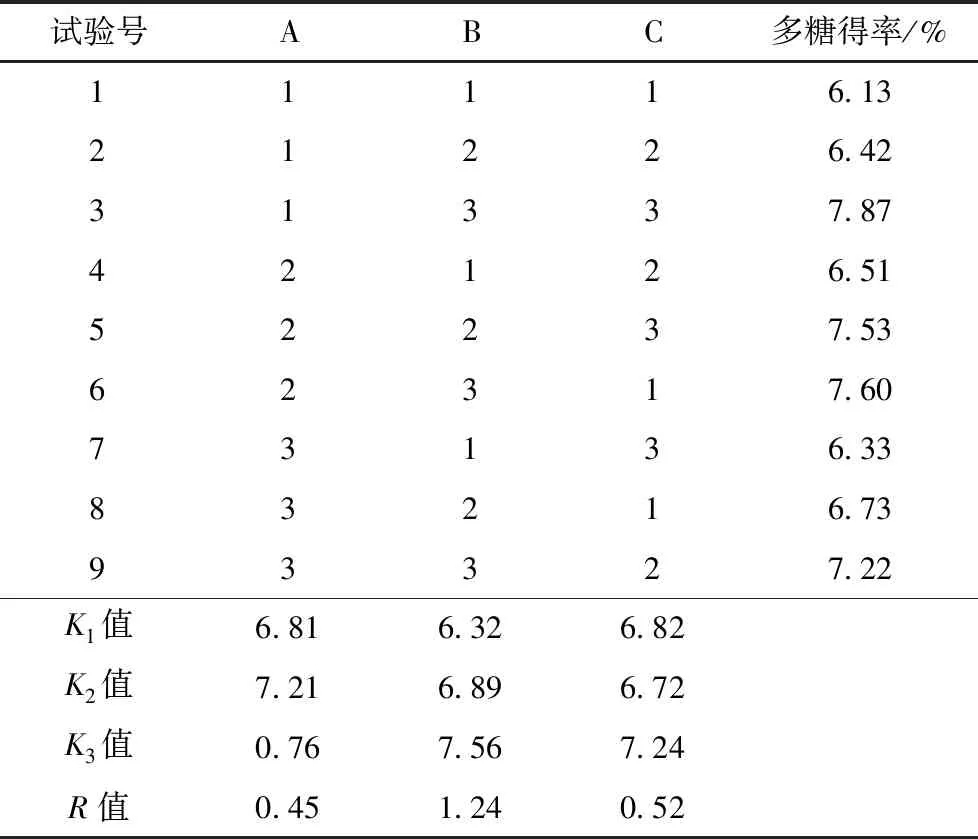
表2 正交试验方案与结果
3.3 抗氧化活性研究
3.3.1 阿卡波糖对α-葡萄糖苷酶的抑制作用阿卡波糖是目前已上市的α-葡萄糖苷酶特异性抑制剂[14]。在不同浓度阿卡波糖作用下,阿卡波糖对α-葡萄糖苷酶的抑制作用呈良好量效关系,说明此实验α-葡萄糖苷酶体外抑制模型符合实验需要。见图4。

图4 阿卡波糖对α-葡萄糖苷酶的抑制活性
3.3.2 黄连多糖对α-葡萄糖苷酶的抑制作用及抑制机制黄连多糖对α-葡萄糖苷酶有抑制作用,且在一定范围内随着浓度的增加,其对α-葡萄糖苷酶抑制作用也逐渐增强,黄连多糖的IC50为3.884 mg/ml。黄连多糖呈典型的竞争性抑制曲线,即随抑制剂浓度增加,反应速度保持不变,说明黄连多糖与α-葡萄糖苷酶底物在该酶上的结合部位是相同的[15]。见表3,图5、图6。

图5 黄连多糖对α-葡萄糖苷酶的抑制活性

图6 黄连多糖对α-葡萄糖苷酶抑制动力学

表3 黄连多糖对α-葡萄糖苷酶抑制拟合方程和动力学参数
4 结论
此实验在单因素实验基础上,合并正交试验优化黄连多糖的提取工艺,结果表明黄连多糖提取的最佳工艺条件为液料比40 ml/g,提取功率100 W,提取时间30 min。采用优化提取条件进行工艺验证试验,测得多糖平均提取率为8.06%。提取的黄连多糖对α-葡萄糖苷酶活性具有一定的抑制作用,且其抑制类型呈典型的竞争性抑制。此实验优化得出的黄连多糖提取工艺及其对α-葡萄糖苷酶的作用,具有开发为降糖药巨大的市场前景,可为黄连的开发与利用提供基础。
