核桃分离蛋白酶解产物结构与功能的变化
2022-07-01赵晓燕张晓伟刘红开虎海防
程 赞,赵晓燕,张晓伟,王 萌,刘红开,虎海防
(1.济南大学 食品科学与营养系,济南 250022; 2.新疆林业科学院,乌鲁木齐 830063)
核桃(JuglausregiaL.)又名万岁子,属于胡桃科核桃属植物,是一种重要的木本油料作物,其果实核桃与扁桃、腰果、榛子被并称为世界“四大干果”,也是人类目前所知的最古老的树生坚果之一[1]。核桃中含有丰富的蛋白质、脂肪、维生素及糖类等营养成分,具有保健、抗氧化等多种功能[2]。
我国是世界上核桃起源中心之一,也是世界核桃生产第一大国,拥有最大的种植面积,其核桃产量占世界核桃产量的46.30%,稳居世界第一[3]。虽然我国核桃的总产量近年来平稳增加,但加工技术仍滞留在初加工阶段,大部分核桃被直接食用或用来榨油,而榨油后产生的核桃饼粕多被用作饲料,造成资源的浪费。核桃饼粕中含有丰富的蛋白质(核桃中蛋白质的含量为15%~20%[4]),核桃蛋白中含有18种氨基酸,其中8种必需氨基酸的含量接近人体所需(FAO/WHO提出,人体所需的8种必需氨基酸异亮氨酸、亮氨酸、赖氨酸、蛋氨酸、苯丙氨酸、苏氨酸、色氨酸和缬氨酸的含量分别为4、7、5.5、3.5、6、4、1、5 g/100 g),是一种优质的植物蛋白资源,具有较好的开发前景[5-7]。
核桃蛋白相对分子质量较大,不利于人体的消化吸收[8-9]。然而,核桃蛋白经蛋白酶酶解后可以生成具有保护神经、抑制血管紧张素转化酶活性及改善学习记忆等多种生物功能的活性肽,且利于消化和吸收,可以有效提高其营养利用率[10-12]。目前研究重点多集中于核桃蛋白的提取及功能性,关于其酶解后的功能性研究相对较少[13-15]。本研究选取两种动物蛋白酶、两种微生物蛋白酶和一种植物蛋白酶分别对核桃分离蛋白进行酶解,测定酶解产物的水解度、溶解性、吸水性、吸油性、乳化特性以及起泡特性,分析不同种类蛋白酶对核桃分离蛋白酶解作用的差异,以期为提高核桃分离蛋白的有效利用率提供科学依据。
1 材料与方法
1.1 试验材料
脱脂核桃粕粉(新新2号),过0.15 mm(100目)筛,新疆林业科学院;BCA试剂盒,美国Pierce公司;胃蛋白酶(3 000~3 500 U/mg)、胰蛋白酶(250 U/mg)、碱性蛋白酶(2 400 U/mg)、中性蛋白酶(60 U/mg)、木瓜蛋白酶(0.5~2 U/mg)和丝氨酸标准品,Sigma公司;其他试剂均为分析纯。
V5000型紫外分光光度计;LXJ-IIB离心机;HH-4数显恒温水浴锅;FD-1A-50真空冷冻干燥机;KQ3200DB型数控超声波清洗器;FSH-2型可调高速匀浆机;Pekin-Elmer Model GX傅里叶红外光谱仪,美国Perkin Elmer Instrument Co., Ltd.。
1.2 试验方法
1.2.1 基本成分的测定
水分的测定,参照GB 5009.3—2016;灰分的测定,参照GB 5009.4—2016;粗脂肪的测定,参照GB 5009.6—2016;粗蛋白质的测定,参照GB/T 6432—2018。
1.2.2 核桃分离蛋白的制备
参照文献[16]的方法,略作修改。将0.05 mol/L Na2HPO4溶液用1 mol/L NaOH调节pH至11.0,以料液比1∶20加入核桃粕粉,调节温度为55℃,恒温水浴振荡提取2 h,然后在4 800 r/min下离心10 min,弃沉淀,将上清液用1 mol/L HCl调节至核桃分离蛋白等电点,使蛋白质酸沉,将沉淀液以4 000 r/min离心20 min,将上清液去掉只留沉淀层,用蒸馏水水洗5次至中性,用一定浓度的磷酸盐缓冲液溶解沉淀,置于截留分子质量7 000 Da的透析袋中,于4℃下透析后,在-50℃、10 Pa真空度下冷冻干燥,即得核桃分离蛋白。
1.2.3 核桃分离蛋白酶解物的制备
参照文献[17]的方法,略作修改。将核桃分离蛋白分散于蒸馏水中,制成质量浓度为5 g/100 mL的核桃蛋白溶液,调节其pH,并按酶用量5%(以底物质量计)的比例加入不同蛋白酶,置于一定温度的水浴锅中,在220 r/min下搅拌反应4 h,反应过程中用0.5 mol/L氢氧化钠或0.5 mol/L盐酸维持pH恒定(pH变化范围±0.1),然后在沸水浴中10 min灭酶活,冷却后将pH调节至4.5(蛋白质等电点),并于6 000 r/min下离心10 min,将所得上清液pH调节至7.0,即得核桃分离蛋白酶解液,冷冻干燥后得核桃分离蛋白酶解物。不同蛋白酶的最适反应条件如表1所示[1,5,17-20]。

表1 不同蛋白酶的最适反应条件
1.2.4 核桃分离蛋白酶解物水解度的测定
采用邻苯二甲醛(OPA)法[21]测定水解度。
OPA溶液的制备:称取7.62 g十水合四硼酸钠和200 mg十二烷基硫酸钠(SDS)于150 mL蒸馏水中溶解(必须在完全溶解后才可以与其他试剂混合),称取160 mg OPA(纯度97%)于4 mL乙醇中溶解,将上述两种溶液混合后加入176 mg 1,4-二巯基苏糖醇(DTT,纯度99%)并定容至200 mL,即得OPA溶液。由于该试剂对光敏感,应在配制当天使用,现配现用。
标准曲线的绘制:取0、100、200、300、400 μL丝氨酸标准液(浓度为0.8 mmol/L)于5 mL试管中,用蒸馏水依次补充体积至400 μL(即得浓度分别为0、0.2、0.4、0.6、0.8 mmol/L的丝氨酸溶液),加入3 mL OPA试剂,混匀,反应2 min,然后依次在340 nm波长处测定吸光度,以丝氨酸浓度(x)为横坐标,吸光度(y)为纵坐标绘制标准曲线,拟合得标准曲线方程y=0.492x+0.058(R2=0.999 0)。
样品水解度的测定:将3 mL OPA试剂与400 μL待测样品(将酶解物溶于水中)混合,反应2 min,在340 nm波长下测定吸光度(在同一条件下重复测定3次,取平均值),然后根据标准曲线方程计算水解度(DH)。
1.2.5 核桃分离蛋白酶解物二级结构的测定
使用傅里叶红外光谱仪(FTIR)采用KBr压片法测定样品的二级结构[22]。测定参数设置:测量温度20℃,检测器DTGS,分辨率4 cm-1,扫描次数32次,扫描范围4 000~400 cm-1,信噪比远大于500(有利于观测到蛋白质谱,通过应用二阶导数和傅里叶去卷积技术提高分辨率)。酶解物在酰胺Ⅰ带(1 600~ 1 700 cm-1)的二级结构通过Origin Pro 9.1软件制作二级卷积谱图分析。
1.2.6 核桃分离蛋白酶解物功能性的测定
1.2.6.1 不同pH下的溶解性
将50 mg样品置于10 mL离心管中,加入2 mL蒸馏水混匀,用1 mol/L HCl或1 mol/L NaOH调节溶液的pH分别为2、4、6、8、10、12,在室温下水浴振荡30 min,随后于4 000 r/min下离心15 min,除去沉淀,取上清液。采用BCA试剂盒分别检测[23]上清液和样品的蛋白质含量,样品重复测定3次,根据公式(1)计算溶解度(Y)[24]。
Y=m1/m0×100%
(1)
式中:m1、m0分别为上清液和样品中的蛋白质质量。
1.2.6.2 吸水性和吸油性
将0.500 0 g样品(干质量计为m2)置于5 mL离心管中,称质量(m3),再加入1 mL蒸馏水或大豆油,水浴振荡30 min,随后于8 000 r/min下离心10 min,保留沉淀,称质量(m4),每个样品重复测定3次,根据公式(2)计算吸水性/吸油性(Y0)[25]。
Y0=(m4-m3)/m2
(2)
1.2.6.3 乳化性及乳化稳定性
1.2.6.3.1 pH的影响
将0.08 g样品置于10 mL离心管中,加入2 mL蒸馏水,在10 000 r/min下均质1 min。用1 mol/L HCl或1 mol/L NaOH调节溶液的pH分别为2、4、6、8、10、12。随后加入2 mL植物油,记录试管中样品溶液的高度(H1)。再将混合物以10 000 r/min均质1 min,然后于1 200 r/min下离心10 min,记录试管中乳化层的高度(H2)。样品重复测定3次。
将上述第一次离心后的样品置于80℃水浴锅中,放置30 min取出,再次记录乳化层高度(H3),再于1 200 r/min下离心10 min,再次记录离心后乳化层的高度(H4)。每个样品重复测定3次。
分别按照公式(3)和公式(4)计算乳化性(IEA)和乳化稳定性(IES)[26]。
IEA=H2/H1×100%
(3)
IES=H4/H3×100%
(4)
1.2.6.3.2 NaCl的影响
将0.08 g样品置于10 mL离心管中,加入2 mL NaCl溶液,调节NaCl浓度分别为0、0.1、0.2、0.4、0.6、0.8、1.0 mol/L,随后加入2 mL植物油,然后按照1.2.6.3.1的方法测定不同NaCl浓度下的乳化性和乳化稳定性[26]。
1.2.6.4 起泡性及起泡稳定性
1.2.6.4.1 pH的影响
将25 mg样品置于10 mL离心管中,加入5 mL蒸馏水溶解,用1 mol/L HCl或1 mol/L NaOH调节溶液的pH分别为2、4、6、8、10、12,记录溶液的总高度(H0),然后在10 000 r/min下均质2 min,立即记录均质后溶液起泡层高度(H1)。静置30 min后,再次记录溶液起泡层高度(H2),每个样品重复测定3次。按公式(5)和公式(6)分别计算起泡性(CF)和起泡稳定性(SF)[26]。
CF=H1/H0×100%
(5)
SF=H2/H1×100%
(6)
1.2.6.4.2 NaCl的影响
将25 mg样品置于10 mL离心管中,加入5 mL NaCl溶液,调节NaCl浓度分别为0、0.1、0.2、0.4、0.6、0.8、1.0 mol/L,记录溶液的总高度(H0),然后在10 000 r/min下均质2 min,迅速记录均质后溶液的起泡层高度(H1)。静置30 min后,再次记录溶液起泡层高度(H2)。每个样品重复测定3次。按公式(5)和公式(6)分别计算起泡性和起泡稳定性[26]。
2 结果与讨论
2.1 核桃粕粉与核桃分离蛋白的基本成分(见表2)

表2 核桃粕粉与核桃分离蛋白的基本成分 %
由表2可以看出,与核桃粕粉相比,核桃分离蛋白中粗蛋白质含量变化较大,由19.13%提高到81.05%,水分含量和粗脂肪含量变化次之,分别从原来的5.71%、2.72%下降到2.33%和1.80%,灰分含量的变化最小。
2.2 核桃分离蛋白与核桃分离蛋白酶解物的蛋白质含量
核桃分离蛋白及其不同蛋白酶酶解产物的蛋白质含量如表3所示。

表3 不同蛋白酶酶解产物的蛋白质含量
由表3可以看出:碱提酸沉法制备的核桃分离蛋白的蛋白质含量为81.05%,与姜荣庆[27]、姜莉[28]等制备的核桃蛋白纯度(分别为82.46%和83%)相近;不同蛋白酶酶解产物中,碱性蛋白酶的蛋白质含量最高,其次是木瓜蛋白酶的,而胰蛋白酶的蛋白质含量最低。
2.3 核桃分离蛋白酶解物的水解度
不同蛋白酶酶解产物的水解度如表4所示。

表4 不同蛋白酶酶解产物的水解度
由表4可以看出,蛋白酶的种类不同,对同一底物的水解度也有所差异,其中碱性蛋白酶酶解产物的水解度最高,其次是木瓜蛋白酶的,水解度最低的是胃蛋白酶与胰蛋白酶的。
2.4 核桃分离蛋白酶解物的二级结构
不同蛋白酶酶解产物的二级结构含量如表5所示。

表5 不同蛋白酶酶解产物的二级结构含量 %
由表5可以看出,5种蛋白酶酶解产物的二级结构α-螺旋、β-折叠、无规则卷曲和β-转角的含量存在一定的差异,但均以β-折叠及β-转角结构为主。其中:胰蛋白酶、中性蛋白酶以及胃蛋白酶的β-转角含量最高,而无规则卷曲含量最低;碱性蛋白酶以及木瓜蛋白酶的β-折叠含量最高,β-转角含量其次,而无规则卷曲的含量也是最低的。4种蛋白二级结构中,胰蛋白酶的α-螺旋含量最高,碱性蛋白酶的β-折叠含量最高,胃蛋白酶的无规则卷曲含量最高,胰蛋白酶的β-转角含量最高。
2.5 核桃分离蛋白酶解物的功能性
2.5.1 溶解性
pH对不同蛋白酶酶解产物溶解度的影响如图1所示。
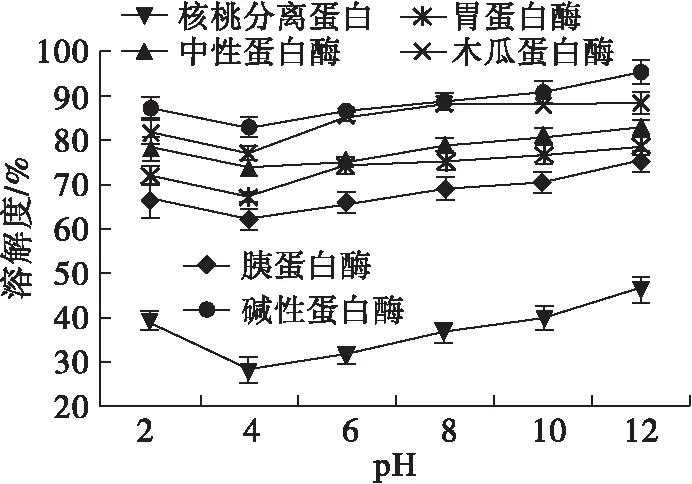
图1 pH对不同蛋白酶酶解产物溶解度的影响
由图1可以看出,在不同pH下,核桃分离蛋白的溶解度显著低于5种蛋白酶酶解产物的。此外,随着pH的升高,酶解产物溶解度先下降后升高,在pH 4时达到最低。这可能是因为pH 4在核桃蛋白的等电点(pH 4.5)附近,此时蛋白质自身的静电荷为零,蛋白质之间的静电排斥力较低,导致蛋白质相互聚集而产生沉淀,从而降低了溶解性[4];而在偏离等电点的酸性和碱性条件下,蛋白质带正电或负电,与水分子之间的相互作用增强,溶解性提高。本试验条件下,核桃分离蛋白酶解物的等电点在pH 4附近。在偏碱性条件下,5种核桃分离蛋白酶解物中,碱性蛋白酶酶解产物的溶解度最高,木瓜蛋白酶的次之,而胰蛋白酶的则最低。这可能是因为酶解会影响蛋白质相对分子质量大小和疏水基团数量,从而导致溶解性发生变化。综上,可以看出,酶解改性可以有效提高核桃分离蛋白的溶解性。
2.5.2 吸水性和吸油性
不同蛋白酶酶解产物的吸水性和吸油性如表6所示。
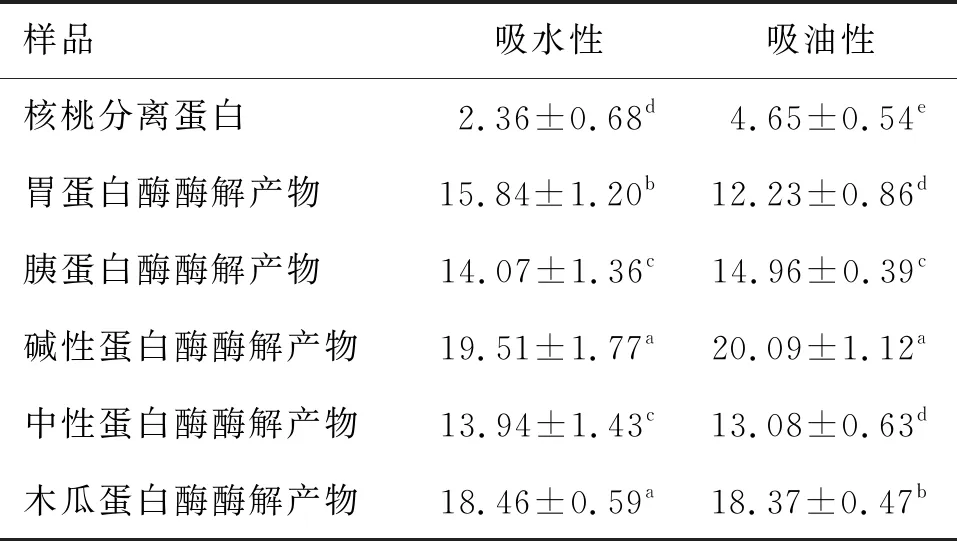
表6 不同蛋白酶酶解产物的吸水性和吸油性 g/g
由表6可以看出:5种蛋白酶酶解产物中碱性蛋白酶和木瓜蛋白酶的吸水性最高(二者没有显著差异),分别为19.51 g/g和18.46 g/g,而胰蛋白酶和中性蛋白酶的吸水性最低(二者没有显著差异),分别为14.07 g/g和13.94 g/g;碱性蛋白酶的吸油性最高,为20.09 g/g,中性蛋白酶和胃蛋白酶的吸油性最低(二者没有显著差异),分别为13.08 g/g和12.23 g/g。
2.5.3 乳化性及乳化稳定性
2.5.3.1 pH的影响
pH对不同蛋白酶酶解产物乳化性及乳化稳定性的影响如图2所示。
由图2可以看出,随着pH的升高,不同蛋白酶酶解产物的乳化性及乳化稳定性均先逐渐降低,在pH 4时达到最低,之后随着pH的升高而上升,在pH 8时到达峰值,之后又呈下降趋势。在不同蛋白酶酶解产物中,碱性蛋白酶的乳化性以及乳化稳定性最好。
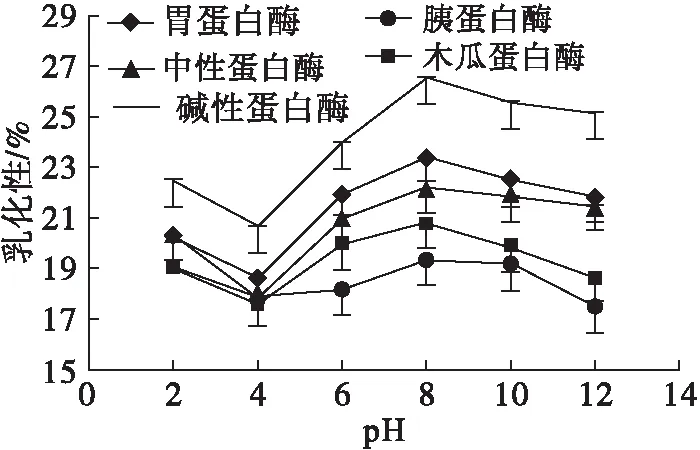
图2 pH对不同蛋白酶酶解产物乳化性与乳化稳定性的影响
2.5.3.2 NaCl的影响
NaCl对不同蛋白酶酶解产物乳化性及乳化稳定性的影响如图3所示。
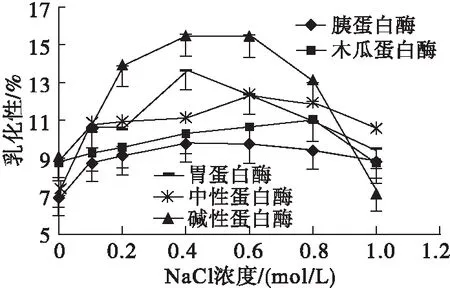
图3 NaCl对不同蛋白酶酶解产物乳化性与乳化稳定性的影响
由图3可以看出,在NaCl浓度为0~0.2 mol/L时,不同蛋白酶酶解产物的乳化性较低,但呈稳步上升趋势,随着NaCl浓度的继续上升,碱性蛋白酶、胃蛋白酶的乳化性增长明显,且在NaCl浓度为0.4 mol/L时达到最高,分别为15.53%和13.69%。在不同蛋白酶酶解产物中,碱性蛋白酶与胃蛋白酶的乳化性最好(最高值相比)。
由图3可以看出,在NaCl浓度为0.4 mol/L时,胃蛋白酶、碱性蛋白酶、中性蛋白酶和木瓜蛋白酶酶解产物的乳化稳定性均达到最大值,分别为67.00%、84.75%、78.16%和68.17%,而胰蛋白酶的在NaCl浓度为0.8 mol/L时达到最大值(69.30%)。可见,碱性蛋白酶酶解产物在NaCl浓度为0.4 mol/L时,乳化稳定性最好。
2.5.4 起泡性与起泡稳定性
2.5.4.1 pH的影响
pH对不同蛋白酶酶解产物起泡性和起泡稳定性的影响如图4所示。
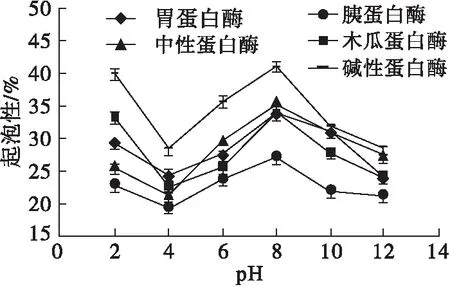
图4 pH对不同蛋白酶酶解产物起泡性与起泡稳定性的影响
由图4可以看出,不同蛋白酶酶解产物在pH 4左右的起泡性最差,远离pH 4的起泡性呈上升状态,在中性条件下起泡性呈明显升高趋势,在pH 8时达到最大值。这与图1中pH 2~8范围内不同蛋白酶酶解产物的溶解度曲线趋势相一致,这说明在该pH区间不同蛋白酶酶解产物的起泡性与溶解性呈正相关。
由图4可以看出:胃蛋白酶酶解产物的起泡稳定性随pH的增加呈先上升后下降趋势;胰蛋白酶的起泡稳定性随pH的变化整体变化趋势比较平缓;碱性蛋白酶的起泡稳定性随pH升高呈波动的变化趋势,但整体变化比较平缓,在pH为4时起泡稳定性最好;中性蛋白酶的起泡稳定性随着pH的升高呈先下降后上升再降低的趋势,在pH为6时起泡稳定性最好;木瓜蛋白酶的起泡稳定性随着pH的升高呈先下降后升高再总体降低的趋势,在pH 2时达到最大值。
2.5.4.2 NaCl的影响
NaCl对不同蛋白酶酶解产物起泡性和起泡稳定性的影响如图5所示。
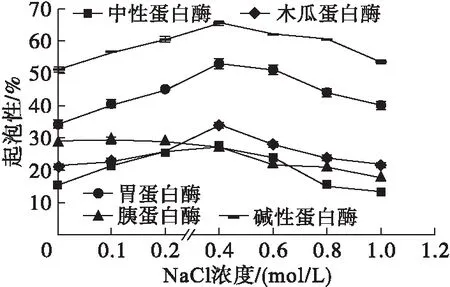
图5 NaCl对不同蛋白酶酶解产物起泡性与起泡稳定性的影响
由图5可以看出,在5种蛋白酶的酶解产物中,除胰蛋白酶外,均在NaCl浓度为0.4 mol/L左右时起泡性最大,其中碱性蛋白酶的起泡性最大,其次是胃蛋白酶的,中性蛋白酶的最低。另外,一定浓度的NaCl可以促进蛋白酶酶解产物起泡性的提高(除胰蛋白酶酶解产物外)。
由图5可以看出,胃蛋白酶酶解产物的起泡稳定性随着NaCl浓度的提高呈先上升后下降趋势,在NaCl浓度为0.4 mol/L时达到最高(43.88%)。胰蛋白酶酶解产物的起泡稳定性随着NaCl浓度的提高呈先下降后升高再下降的趋势,在NaCl浓度为0时达到最大值(37.79%)。碱性蛋白酶酶解产物的起泡稳定性随着NaCl浓度的增加而降低,在NaCl浓度为1.0 mol/L时达到最低(34.44%)。中性蛋白酶酶解产物的起泡稳定性随NaCl浓度的升高变化趋势较为平缓,在NaCl浓度为0.4 mol/L时达到最高(37.44%)。木瓜蛋白酶酶解产物的起泡稳定性随着NaCl浓度的升高呈先降低后升高再降低的变化趋势,在NaCl浓度为0.4 mol/L时达到最高(36.38%)。总体而言,NaCl浓度过大会导致蛋白酶解酶产物起泡稳定性下降。比较而言,在不同蛋白酶酶解产物中,碱性蛋白酶的起泡性和起泡稳定性最好。
3 结 论
本研究采用胃蛋白酶、胰蛋白酶、碱性蛋白酶、中性蛋白酶以及木瓜蛋白酶对核桃分离蛋白进行酶解,并对其酶解产物的蛋白质含量、二级结构以及功能性(溶解性、吸水性、吸油性、乳化特性和起泡特性)进行研究。结果发现,不同的蛋白酶对核桃分离蛋白酶解效率不同,造成二级结构的变化,从而影响其功能性。与核桃分离蛋白相比,其酶解产物的溶解性、吸水性与吸油性提高,且具备良好的乳化性、乳化稳定性、起泡性和起泡稳定性。但不同蛋白酶对核桃分离蛋白酶解产物功能性的影响具有一定的差异性,5种蛋白酶中以碱性蛋白酶为核桃分离蛋白的最佳酶解用酶。
