高产丁酸乳酸菌的筛选及调节免疫功能评价
2022-07-01张蕊张琪桑跃张永祥胡雅倩龄南
张蕊,张琪,桑跃,张永祥,胡雅倩,龄南
(1.中国农业大学营养与健康系,北京 100190;2.甘肃农业大学食品科学与工程学院,兰州730070;3.南京卫岗乳业有限公司,南京 211102)
产丁酸细菌作为一类重要的肠道细菌,近年来引起许多研究者的关注[1]。据研究,人体内超过95%的丁酸在结肠内产生和吸收[2],其能够使结肠细胞保持稳定[3],可以调节肠道菌群失调和治疗肠易激综合征、抗生素相关性肠炎、急慢性腹泻等疾病[4]。
乳酸菌(Lactic acid bacteria,LAB)是一类可利用碳水化合物发酵产酸的细菌的统称,其发酵可以产生乳酸、乙酸、双乙酰和丁酸等物质[5]。人体内的丁酸主要通过乳酸菌利用乳糖产生丙酮酸,在丁酰磷酸转移酶和丁酸激酶的作用下生成[6]。近年来研究表明,丁酸激酶可能是丁酸形成过程中的主要酶[7]。目前,多数研究都针对肠道菌群产丁酸的作用及机制[8],进行乳酸菌产丁酸机制的研究。
本文采用PCR扩增目的基因的方法,从40株乳酸菌中筛选具有丁酸激酶的乳酸菌,并检测其发酵液中丁酸产量,进一步利用动物实验探究其对小鼠免疫功能的影响,为菌株的产品开发和应用提供依据。
1 材料与方法
1.1 试验材料
40株实验菌株来自中国农业大学益生菌研究中心;健康的6~8周BALB/c雄性小鼠,18~22g:购自北京维通利华实验动物技术有限公司。
1.2 试验仪器
基因扩增仪(德国Eppendorf AG);HF90型CO2培养箱(美国NAPCO);GC-8860气相色谱仪(安捷伦科技有限公司);M 200 PRO多功能酶标仪(瑞士Tecan);DL-CJ-2ND1洁净工作台(北京东联哈尔仪器制造有限公司);HV-110高压灭菌锅(日本Hirayama)。
1.3 方法
1.3.1 乳酸菌菌种活化
无菌条件下,乳酸菌冻干粉菌种,接种于10mL脱脂乳中,充分振荡后,37℃静置培养,凝固后以5%的接种量接种于MRS培养基中继续培养传代。传代3次后,取第3代菌液4℃保存备用。
1.3.2 PCR扩增丁酸激酶
细菌试剂盒提取DNA,以引物F(5’-GCTCGCTCGTATCAGTGGTT-3’)、R(5’-CCATTTCTCCTGGTCGCACT-3’)进行PCR扩增。
PCR反应体系(25μL):模板DNA1μL、上下游引物各1μL、Taq Mix 12.5μL、无菌水9.5μL。PCR反应程序:94℃预变性3min、94℃变性30s、55℃退火30s、72℃延伸1min、72℃保持5min,30个循环。琼脂糖凝胶电泳验证PCR产物。
1.3.3 气相色谱测定丁酸产量
菌种活化完成后,在无菌条件下,按照5%的接种量接于MRS培养基中,在MRS培养基中培养12h、18h、24h,取发酵液20μL,用50%硫酸和乙醚提取丁酸,以2-乙基丁酸为内标,进行气相色谱仪测定。
色谱条件:柱流量为1mL/min,FID检测器,检测器温度为250℃,进样量为1μL;升温程序如下:60℃保持4min,以6℃/min的速度升温至180℃,再以20℃/min的速度升温至200℃,保持5min。
1.3.4 实验动物分组
小鼠适应性喂养一周后,随机分成3组,空白对照组、乳酸菌(L-113)低剂量组(1×107CFU/只)和乳酸菌(L-113)高剂量组(1×109CFU/只),每组8只。试验组以设定菌液浓度连续灌胃45d。
1.3.5 动物免疫功能测定
1.3.5.1 脾淋巴转化实验
颈椎脱臼法处死小鼠,无菌取脾,制成浓度为1×106个/mL的脾细胞悬液。进行MTT试剂盒测定,酶标仪于450nm处测定吸光值。脾淋巴转化能力以加ConA(刀豆蛋白)孔的光密度值减去不加ConA孔的光密度值表示。
1.3.5.2 迟发型变态反应(DHT)
灌胃结束后,用2%绵羊红细胞(Sheep red blood cell,SRBC)对小鼠进行腹腔免疫,每只鼠注射0.2mL(约1×108个SRBC),4d后,测量左后足跖部厚度,然后在测量部位皮下注射20%SRBC,每只鼠20μL(约1×108个SRBC),24h后用游标卡尺测量左后足跖部厚度或肿胀度,同一部位测量三次,取平均值。
1.3.5.3 抗体生成细胞检测
灌胃结束后,用2% SRBC对小鼠进行腹腔免疫,每只鼠注射0.2mL(约1×108个SRBC),4d后,无菌取脾,制成浓度为5×106个/mL的脾细胞悬液。在50℃恒温试管中加入0.5mL/管的Hank,SA液(含0.5%琼脂糖)备用。试管中加入25μL脾细胞悬液和50μL 10%SRBC,混匀,37℃ CO2培养箱中培养2h,用SA缓冲液稀释补体,室温孵育4h,统计软件统计每孔溶血空斑数,以空斑数/106脾细胞表示。
1.3.6 血清溶血素的测定
灌胃结束后,注射2% SRBC对小鼠进行免疫,0.2mL/只,4d后,眼眶采血制备血清,试管中加入1mL用SA缓冲液稀释200倍后的血清,依次加入SRBC和补体。对照组试管中的血清以SA液代替。37℃水浴20min,离心10min(2000r/min),取上清液加入都氏试剂,对照空白中加10% SRBC和都氏试剂,混匀后在540nm处测定吸光度值。
血清溶血素HC50=(样品吸光度/SRBC半数溶血时吸光度)×200
1.3.7 NK细胞活性测定
用含10%胎牛血清RPMI-1640完全培养液调整脾细胞浓度为1×106个/mL做效应细胞备用;以YAC-1细胞作为靶细胞,将已传代的靶细胞用含10%胎牛血清RPMI-1640完全培养液调整细胞浓度为1×104个/mL做靶细胞备用;效应细胞与靶细胞各100μL共同培养,WST-8试剂盒检测。
2 结果与讨论
2.1 丁酸激酶的PCR扩增
丁酸激酶目的片段在600bp左右,对40株乳酸菌进行PCR扩增,将扩增后的PCR产物进行琼脂糖凝胶电泳检测,得到一株含有目的基因的副干酪乳杆菌L-113。结果如图1所示。

图1 目的基因检测电泳图
2.2 丁酸产量的测定
将L-113接入MRS培养基中发酵,分别取12h、18h、24h发酵液用GC测定其丁酸产量,结果如图2所示,可以看出随着发酵时间的增加,丁酸产量呈上升趋势,发酵24h时,丁酸产量最高,可达5.8g/L。高文文等的研究发现一株高产丁酸的丁酸梭菌24h发酵液中丁酸含量为2.1g/L左右[9],L-113丁酸产量约是它的3倍。
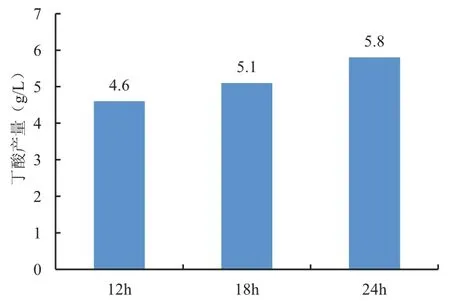
图2 L-113丁酸产量图
2.3 动物免疫功能测定
2.3.1 脾淋巴细胞转化
ConA刺激脾淋巴细胞中的T细胞增殖,增殖程度反映了T细胞的活性,是重要的细胞免疫指标。脾淋巴细胞转化结果见图3。灌胃低剂量与高剂量L-113的小鼠脾淋巴细胞增值能力均高于对照组,其中L-113高剂量组与对照组差异显著。而L-113低剂量组小鼠脾淋巴细胞增殖能力虽高于对照组,但无显著差异。
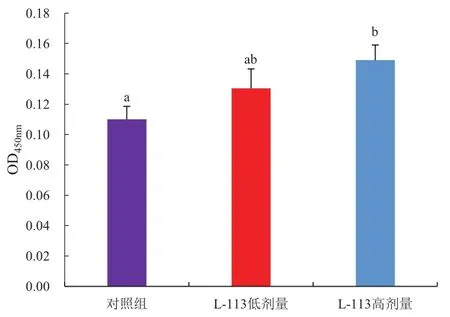
图3 小鼠脾淋巴细胞转化结果
2.3.2 迟发型变态反应
SRBC刺激T淋巴细胞成致敏淋巴细胞,4d后再以SRBC攻击时,攻击部位出现肿胀,肿胀程度反应迟发型变态反应程度,是细胞免疫功能的重要测定指标。经SRBC攻击前后小鼠足趾厚度差见图4。图中显示,两个剂量组小鼠足跖变态反应均高于对照组,L-113低剂量组、高剂量组与对照组之间均有显著差异。

图4 小鼠迟发型变态反应实验结果
2.3.3 抗体生成细胞检测
由B细胞介导的体液免疫是评价机体调节免疫能力的重要组成部分,抗体生成细胞是体液免疫能力检测重要的指标之一。用SRBC免疫动物后,产生抗SRBC抗体(溶血素),利用其凝集SRBC的程度来检测溶血素的水平。
如图5所示,L-113低剂量组与高剂量组的抗体生成细胞数显著高于对照组,说明L-113能增加抗体生成细胞数含量。
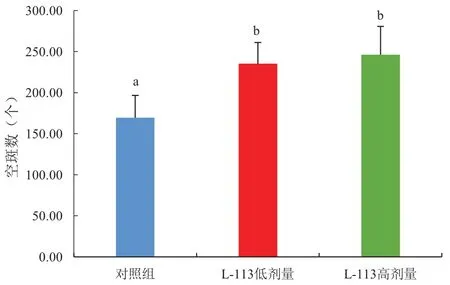
图5 抗体生成细胞检测
2.4 血清溶血素测定
用SRBC免疫动物后产生溶血素,其含量表示血清中产生抗体的能力,反映动物的免疫能力。如图6所示,与对照组相比,低、高剂量干预组小鼠的HC50值有上升趋势但无显著差异,表明灌胃L-113的小鼠产生抗体的能力没有显著升高。

图6 血清溶血素测定
2.5 NK细胞测定
NK细胞是没有T和B细胞表面标志的淋巴细胞,具有非特异性杀伤作用,其增殖情况能反映动物的免疫能力。由图7可知,灌胃L-113两个剂量组的小鼠NK细胞活性均高于对照组,且两个剂量组均与对照组有显著差异,表明L-113具有增强NK细胞活性的能力。
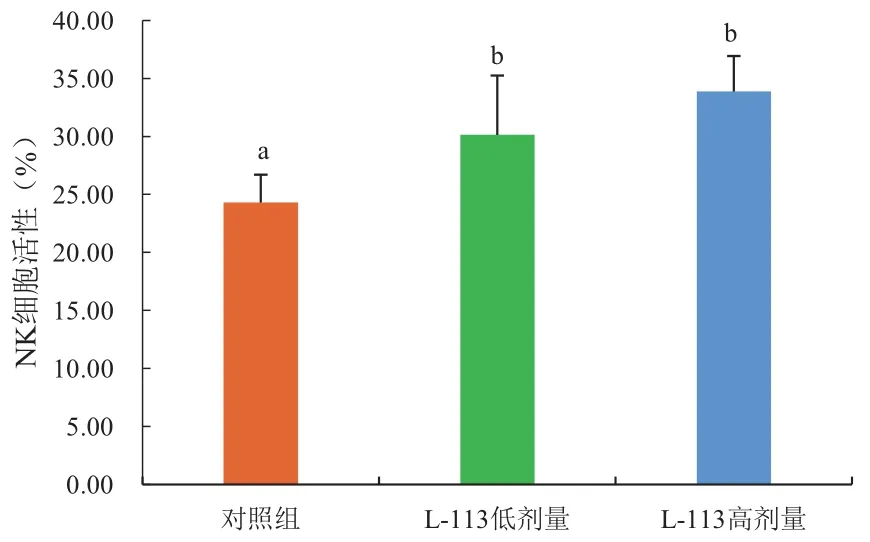
图7 NK细胞活性测定
3 结论
丁酸激酶作为丁酸产生过程中的关键酶,其调控基因起到了重要作用,因此本试验以PCR扩增丁酸激酶基因片段作为筛选高产丁酸的乳酸菌的方法,筛选的40株乳酸菌中有一株副干酪乳杆菌L-113在600pb左右得到特异性目的条带。L-113在MRS培养基中发酵24h后的丁酸产量为5.8g/L。动物实验结果显示,灌胃L-113能显著增强细胞免疫(包括脾淋巴细胞转化能力和迟发型变态反应)、体液免疫(包括抗体生成能力)、NK细胞活性等免疫功能。本研究可为菌株在功能性产品中的应用提供理论依据。
