两种自动勾画系统勾画头部小体积危及器官的对比
2022-07-01侯东梅赵永瑞殷旭君张秋杭徐建堃
侯东梅,赵永瑞,殷旭君,张秋杭,徐建堃
首都医科大学宣武医院放射治疗科,北京 100053
前言
随着医疗技术的不断发展,放射治疗成为治疗肿瘤常用的手段之一。目前,最常用的放射治疗方法是调强放射治疗[1]和容积旋转放射治疗[2]。两种方法通过射野内剂量的调强,使照射野内处方剂量分布与靶区适形。在提高靶区剂量的同时,尽可能减少危及器官(OAR)受照剂量,降低OAR 的受照风险。靶区和OAR 的勾画本质上是图像分割,通常由经验丰富的医生手动逐层完成[3]。目前多数医院放射治疗时头部影像扫描层厚为2 mm,一套完整的影像有上百张图片,医生手动勾画靶区和OAR需1~2 d,是一项非常耗时耗力的工作[4]。2016年国务院发布《国民经济和社会发展第十三个五年规划纲要(草案)》,将人工智能列入国家战略地位。放疗行业积极响应国家政策,人工智能应用到放射治疗的各个环节。自动勾画的理念在放射治疗行业普及,电子计算机断层扫描(CT)图像自动分割能显著减少医生工作量,不断提高感兴趣区域的分割准确性和一致性[5]。头部肿瘤在治疗过程中对剂量跌落梯度要求较高,OAR 种类多,结构复杂,体积较小,对辐射非常敏感,过多的辐射会造成OAR 不可逆的损伤[6],这就要求靶区和OAR 的勾画要尽可能精准。近年来,关于头颈部OAR 的自动勾画研究很多。杨鑫等[6]对脑干、脊髓、左腮腺、右腮腺、左眼、右眼、左颞叶、右颞叶、喉、左下颌腺、右下颌腺、甲状腺和小体积器官左侧视神经、右侧视神经和视交叉等自动勾画软件改进设计中发现,较大体积的OAR 自动勾画与手动勾画之间差异较小,较小体积OAR 在深度学习中特征值被丢失,信息获取不全面,勾画效果不理想。谢辉等[7]研究发现利用OIS 软件在头颈部肿瘤OAR 自动勾画时除了垂体、视交叉、视神经外,其余大部分器官的勾画完全可以替代医生达到较好的临床效果。彭应林等[8]认为不同中心临床医生对鼻咽癌放疗计划的计划靶区(PTV)和OAR 勾画可能存在较大差别,自动联合手工勾画可以减少医生间OAR 勾画差异,但小体积器官勾画差异仍达1.5 倍以上。田娟秀等[9]提出一种基于三维(3D)深度残差全卷积网络的OAR 分割方法能够更加准确地分割各个OAR,但视交叉的分割效果仍需进一步提升。谷姗姗等[10]对MIM 软件的研究发现,眼球、内耳、脊髓、视神经等OAR 宜选用病例数多的模板数据库进行自动勾画,模板数据库中包含的病例数对脑干、颞颌关节、晶体、口腔、腮腺等或组织的自动勾画无明显影响。葛迦等[11]研究发现对于体积较大的器官都有较好的勾画结果,器官的体积越小、边界越模糊,勾画结果越差。为了验证两套自动勾画软件勾画头部OAR的准确性,本研究以人工勾画的OAR 为准,一方面,对两套自动勾画软件在OAR 勾画精准程度进行分析;另一方面,基于这两套自动勾画系统勾画的OAR 进行计划设计,并对OAR的剂量受量进行分析,以此判断这两套软件直接应用在临床上的可行性。
1 资料与方法
1.1 一般资料
随机选取2020年8月至2021年3月于首都医科大学宣武医院收治的30例靶区相似的脑胶质瘤患者的影像资料。所有患者均为首次放射治疗,其中男16 例,女14 例,年龄27~66 岁,中位年龄47 岁。所有患者在CT 模拟机上定位时均采用仰卧位,双手自然放在身体两侧,同一款热塑膜固定头颈。扫描范围从头顶到锁骨下缘,层厚2 mm。所有CT影像通过数字成像和通信端口传输到计划系统医生工作站和自动勾画系统。同时,所有CT 影像均有对应的核磁影像,辅助医生准确勾画OAR。
1.2 软件资料
两种勾画软件分别为MANTEIA 和RT-Mind,均采用U-Net 卷积神经网络模型对图像特征进行自动提取,通过大量病例进行深度学习形成数据库和模板集,实现图像的自动勾画。
1.3 勾画及数据处理
根据脑胶质瘤的放射治疗要求,选取相对比较重要的OAR 进行勾画,分别为脑干、左右视神经、视交叉、左右晶体、左右内耳和垂体。该30例图像由同一位资深医生在未知该实验情况下在计划系统医生工作站上进行OAR 手动勾画。勾画时均参考RTOG OAR 勾画指南,所涉及的OAR 勾画范围均一致。该套手动勾画数据为本实验的参考标准,为对照组(M组)。本研究用MANTEIA 软件勾画的数据设为A组,RT-Mind勾画的数据设为B组。将该30例影像传输到两套自动勾画系统进行自动勾画,得到实验一组A1、B1。将实验组数据备份,备份影像请同一位资深医生再次修改OAR,得到实验二组A2、B2。为了排除人为误差,本实验的人工勾画工作均由同一位医生单独完成,另一位医生审核通过。
1.4 计划设计
将上述5 套勾画好的OAR 拷贝到同一套影像中,采用同一套靶区,同一计划系统Moanco 进行计算优化。以靶区中心为计划中心,双全弧照射,每个全弧180 个控制点,0.25 mm 网格,1%不确定度。照射能量采用临床常用的6 MV 进行计划设计。得到的计划满足以下条件:靶区覆盖率95%,适形度约0.7,OAR 受照剂量低于处方要求。每一次计划设计时优化的OAR为同一套勾画软件勾画得到的。得到计算结果后,将靶区的处方覆盖率统一到95%。统计对照组和各实验组影像对应的OAR受照剂量。
1.5 结果分析方法及评价标准
分别对对照组和实验组的OAR轮廓进行交叉指数系数(Overlap Index, OI)、形状相似性系数(Dice Similarity Coefficient, DSC)和杰卡德相似系数(J)[12]3个方面进行分析。公式如下所示:

其中,Vij∩VM表示两种勾画体积重叠部分体积。

OI、DSC 和J 的范围为0~1。OI 越接近1 说明两种勾画重叠的区域越接近对照组;DSC 越接近1说明两种勾画区域相似度越高;J 越接近1 说明两种勾画区域相似度越高[13]。对照组OIM=1,DSCM=1,JM=1。一般DSC>0.7 即认为人工与自动勾画两个结构相似度较好[14-15]。
治疗计划中OAR的受照剂量也是以手动勾画的影像中OAR 剂量为基准。评估实验组与对照组中OAR 受照的最大剂量Dmax、最小剂量Dmin和平均剂量Dmean的偏差。
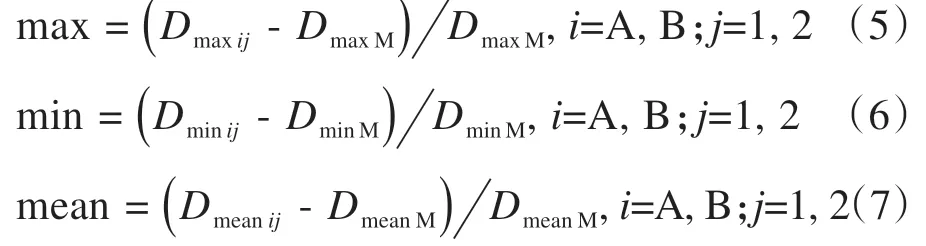
1.6 统计学方法
采用SPSS 23 软件进行数据处理。统计各OAR剂量偏差和各个样本量的OI、DSC 和J 值,符合正态性分布的计量资料用均数±标准差表示,采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 勾画影像分析
通过人工勾画和手动勾画组合影像对比发现,A、B 组与M 组存在显著差异,经过手动修改后,更接近手动勾画范围(图1)。
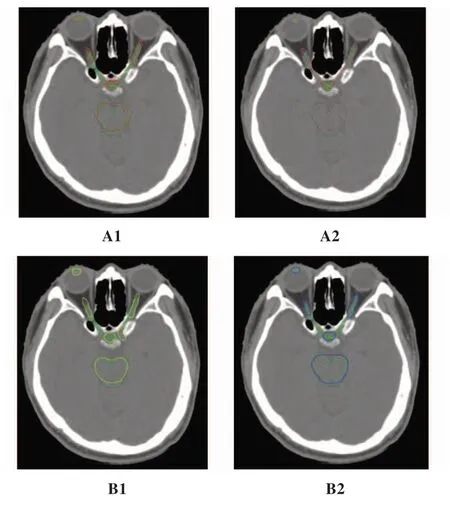
图1 人工勾画和手动勾画对比Figure 1 Comparison between automatic segmentation and manual delineation
2.2 勾画数据
2.2.1 勾画体积数据自动勾画系统A1(表1),OI 值最大的是左内耳0.96±0.00,最小的是左晶体0.55±0.05;DSC 值最大的是脑干0.90±0.00,最小的是右内耳0.41±0.01;J 值最大的是脑干0.83±0.01,最小的是右内耳0.27±0.01。A1 组自动勾画与M 组的OAR 比较差异均有统计学意义(P<0.05)。
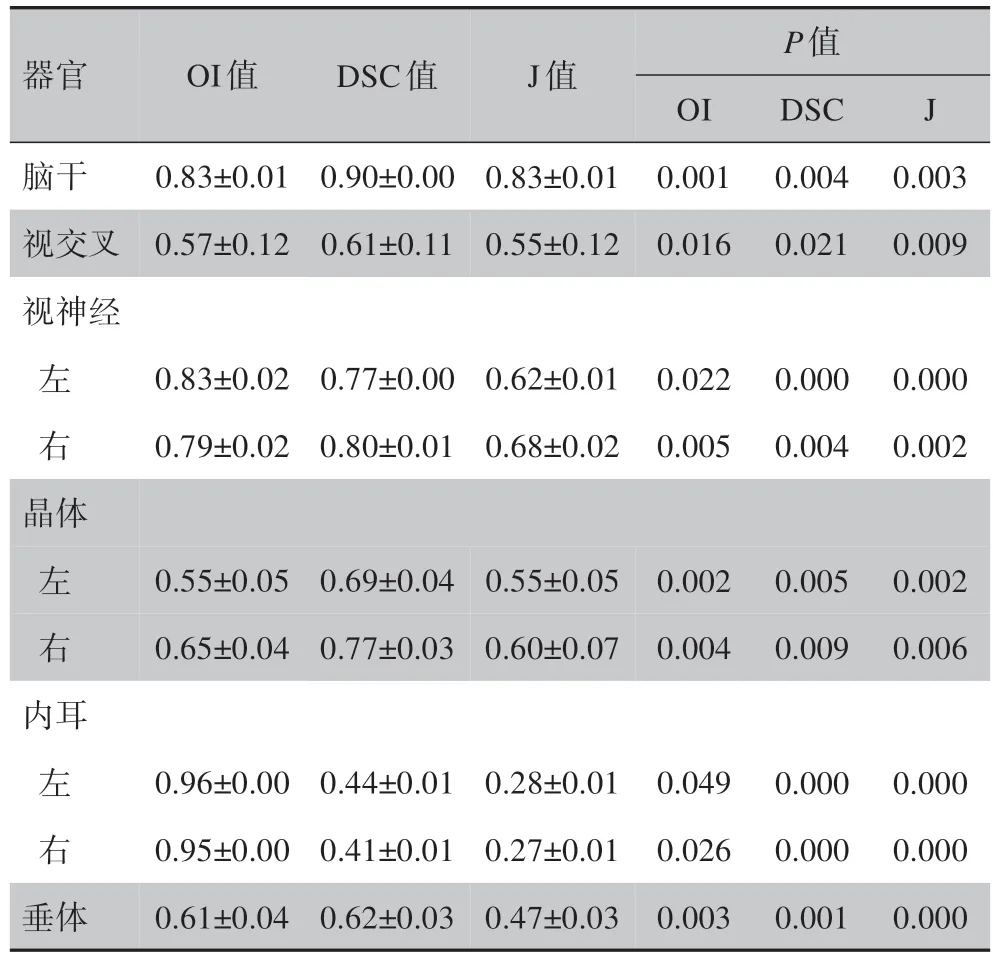
表1 自动勾画系统A1与M组的比较结果Table 1 Comparison between auto-segmentation(group A1)and manual delineation(group M)
在A1组勾画的基础上手动修改后得到A2组(表2),OI值最大的是右内耳0.97±0.00,最小的是视交叉0.67±0.05;DSC 值最大的是右视神经0.84±0.02,最小的是右内耳0.63±0.03;J值最大的是右晶体0.75±0.04,最小的是右内耳0.48±0.03。与对照组比较,除左视神经和左内耳OI 值外,其他数值比较均有统计学意义(P<0.05)。

表2 自动勾画系统A2与M组的比较结果Table 2 Comparison between auto-segmentation(group A2)and manual delineation(group M)
自动勾画系统B1(表3),OI 值最大的是左内耳0.97±0.00,最小的是视交叉0.66±0.07;DSC 值最大的是右晶体0.89±0.01,最小的是左内耳0.49±0.02;J 值最大的是右晶体0.80±0.02,最小的是左内耳0.33±0.01。B1 组自动勾画与M 组除晶体和内耳OI值外,其他数值比较均有统计学意义(P<0.05)。
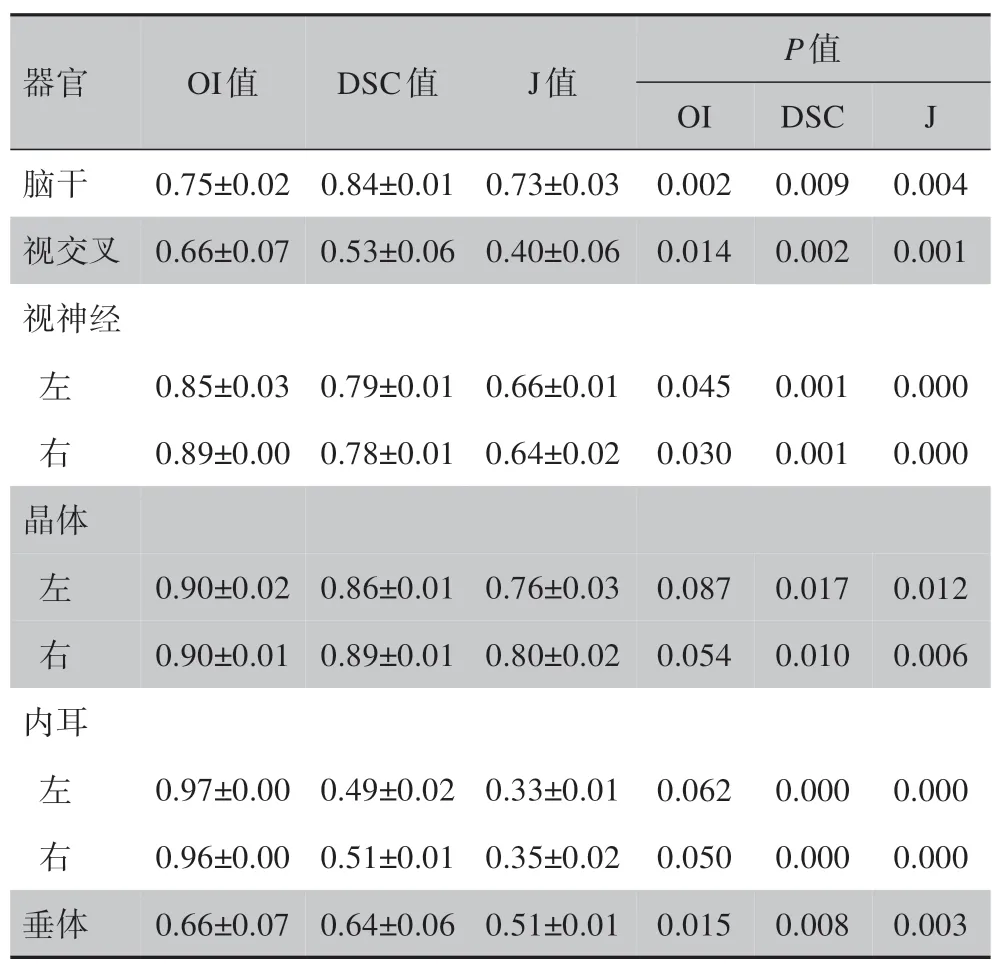
表3 自动勾画系统B1与M组的比较结果Table 3 Comparison between auto-segmentation(group B1)and manual delineation(group M)
在B1组勾画的基础上手动修改后得到B2组(表4),OI值最大的是右内耳0.97±0.00,最小的是视交叉0.70±0.05;DSC 值最大的是右晶体0.85±0.03,最小的是左内耳0.62±0.03;J 值最大的是右晶体0.76±0.04,最小的是左内耳0.47±0.03。B2 组自动勾画与M 组视神经、内耳和左晶体OI 值、右视神经和右晶体的DSC值和脑干J 值比较差异没有统计学意义(P>0.05),其他数值比较均有统计学意义(P<0.05)。

表4 自动勾画系统B2与M组的比较结果Table 4 Comparison between auto-segmentation(group B2)and manual delineation(group M)
2.2.2 剂量偏差数据对实验组和对照组计划中的OAR 剂量受量进行比较见表5。Dmax偏差统计结果显示:A 组视交叉、视神经和A2 组左晶体偏差>5%;B1组视交叉、左视神经和左内耳,B2组视交叉、视神经、右晶体剂量偏差>5%,其他数值均<5%。Dmin偏差显示:A 组中除视交叉、A1 组右视神经和A2 组左视神经外,其他OAR 剂量偏差<5%;B 组中右视神经,B1组右晶体,B2组左晶体和右内耳的剂量偏差>5%,其他偏差<5%。Dmean统计显示:A 组除视交叉和A1组脑干外,其他OAR 剂量偏差均<5%;B 组除视交叉,B1组晶体和左内耳,B2组右内耳外,其他OAR剂量偏差<5%。
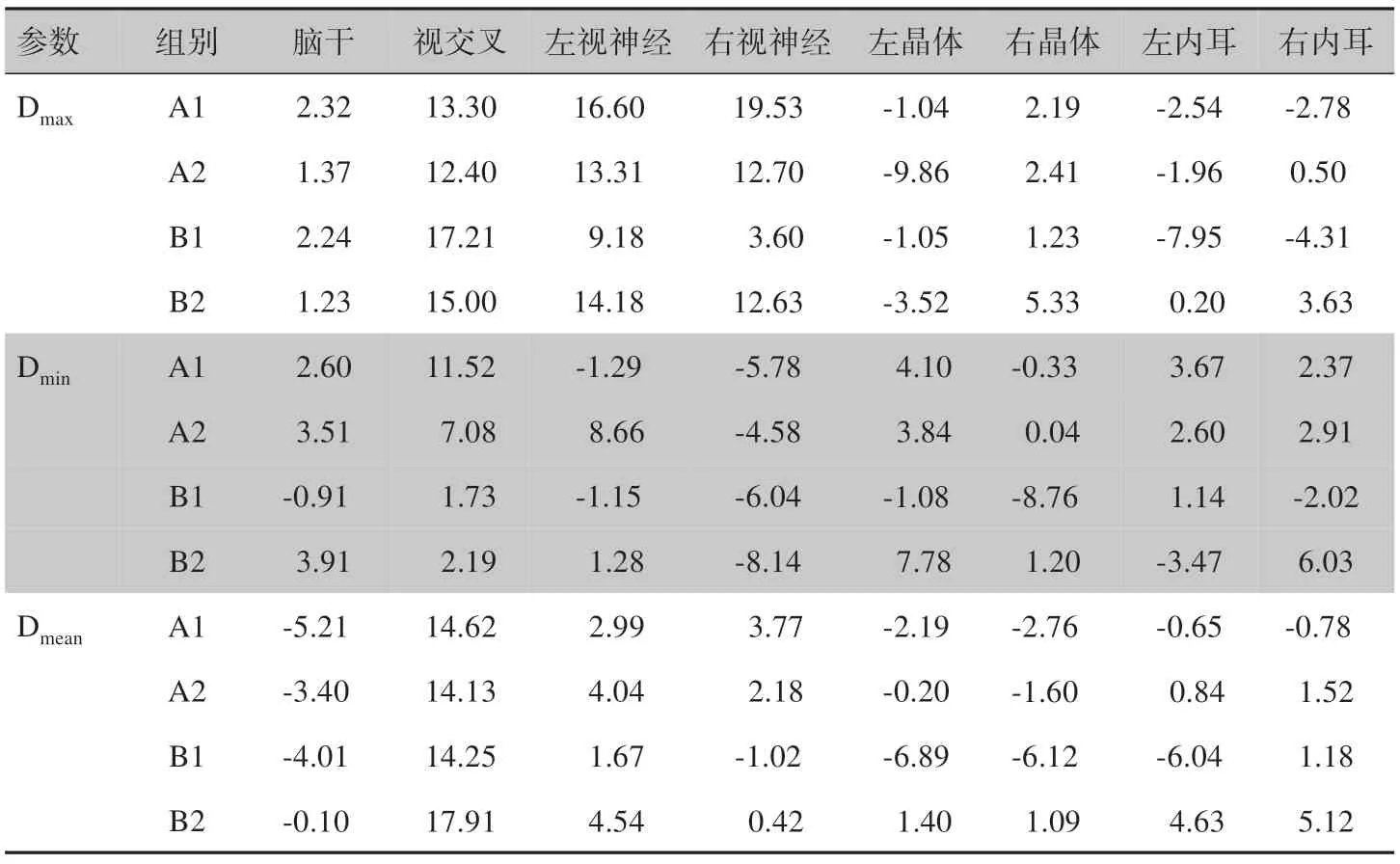
表5 剂量偏差比较(%)Table 5 Comparison of dose deviations(%)
3 讨论
本研究主要分析头部OAR中较小体积勾画的差异性,结果显示两种勾画软件分析结果与文献[16-23]的报道相似。体积较大的脑干和边界清晰的晶体勾画效果比较理想,其他体积较小的OAR 仍有很大的改进空间[24]。这些OAR自动勾画与手动勾画在覆盖率、相似性和适形度上均存在显著差异。在自动勾画的基础上手动修改,虽然可以明显提高OAR 的覆盖率、相似度和适形度,但仍有相当一部分存在差异性。这些差异体现到受照剂量上也非常明显,手动修改可以降低剂量偏差。分析原因主要存在以下几个方面:(1)实验分析的大部分OAR 体积很小,在CT影像上只有2~3层分布,自动勾画系统分析学习具有一定难度;(2)视交叉、视神经、垂体等器官和周围组织的CT 值比较接近,自动勾画系统识别存在一定困难,晶体勾画相对较好的原因也是因为晶体和周围组织CT 值差异明显,更容易识别;(3)内耳的勾画范围没有明确,自动勾画系统勾画范围明显较大,而医生手动勾画不包括内耳道等组织;(4)自动勾画系统需要更多的临床数据进行再学习。
