皮肤鳞状细胞癌患者病变组织中Nodal和TIF1-γ表达与机制研究
2022-07-01李永熙孟安锋魏亚峰
李永熙,孟安锋,魏亚峰
(宝鸡市人民医院,陕西 宝鸡 721000)
皮肤鳞状细胞癌(Cutaneous squamous cell carcinomad,cSCC)在皮肤肿瘤中的患病率仅次于基底细胞癌之后,可严重影响患者的身体质量[1-2]。转化生长因子-β(TGF-β)超家族成员在cSCC患者的病理、生理过程中均发挥着一定的调节作用,可起到促使机体胚胎发育、促进伤口愈合、调节血管产生及肿瘤增殖等作用[3]。其中胚胎成形素(Nodal)作为TGF-β超家族的主要成员之一,其表达水平会随着组织分化程度的加重而减少,在成年正常组织中的表达较低甚至不表达[4-5]。转录中介因子1-γ(TIF1-γ)是TGF-β信号通路的重要辅助因子之一,其在机体不同生理过程中起到重要的调控作用[6-7]。曾红[8]的研究表明Nodal和TIF1-γ的异常高表达可能与cSCC分化程度及临床分期有关,随着病理分级的增加,Nodal和TIF1-γ的阳性表达率呈现负相关关系。但是当前临床上对Nodal和TIF1-γ在cSCC患者表达水平的研究报道较为少见,且二者与患者病理特征关系的报道更为少见。本文具体探讨了cSCC患者病变组织Nodal和TIF1-γ表达水平及其与病理特征的相关性,希望为早期诊治cSCC患者提供一定的指导意义。现总结报道如下。
1 资料与方法
1.1 一般资料 本研究经过本院医学伦理委员会批准。选择2017年2月—2020年1月在本院诊治的70例cSCC患者为cSCC组。其中男42例,女28例;年龄 41~78岁,平均(64.98±2.98)岁;病程 3个月~4年,平均(2.01±0.18)年;组织学分化:低分化17例,中分化22例,高分化31例;临床分期:Ⅰ期31例,Ⅱ,Ⅲ期19例,Ⅱ,Ⅲ期20例。
纳入标准:①均由本院3名主治医师与皮肤组织病理学检查后证实为cSCC;②患者既往均未采取抗肿瘤治疗包括放射或激光;③均具备完整的临床资料且蜡块保存的鳞癌标本;④发病部位均为面部、头部等暴露部位。
同期选择30例正常皮肤组织为对照组,均为面部、头部外伤和美容手术切除者。男19例,女11例;年龄38~75岁,平均(62.26±3.77)岁。2组患者在性别比、年龄等一般资料对比差异无统计学意义(P>0.05),有可比性。
1.2 方法
1.2.1 Nodal和TIF1-γ表达检测 对照组取自患者手术切取的新鲜正常皮肤,采用8%福尔马林溶液对标本进行固定24 h,石蜡包埋后并放入冰箱以保存。而cSCC组标本取自病理档案库保存的石蜡组织块。从2组标本石蜡块中切取3张切片,其中一张用于磷酸盐缓冲液(PBS)代替一抗为空白对照,一张用于Nodal免疫组织化学染色操作,另一张用于TIF1-γ免疫组织化学染色操作。染色结果判断标准:①根据显色强度进行评分,0分:无显色;1分:淡黄色;2分:黄色;3分:棕黄色。②根据着色细胞数进行评分,0分:阳性细胞数<5%;1分:阳性细胞数为5%~25%;2分:阳性细胞数为26%~50%;3分:阳性细胞数为51%~75%;4分:阳性细胞数>75%。将上述2种方法得出的分数进行乘积所得的结果判为其免疫组织化学阳性表达情况,阴性:0分;弱阳性:1~4分;中度阳性:5~8分;强阳性:9~12分。其中弱阳性、中度阳性与强阳性均判为阳性结果。
1.2.2 病理特征判定 临床分期:Ⅰ期:肿瘤直径<2 cm,无局部淋巴结转移及远处转移;Ⅱ期:肿瘤直径≥2 cm,但<5 cm,无局部淋巴结转移及远处转移;Ⅲ期:无论肿瘤大小,有局部淋巴结转移,但无远处转移。组织学分化分为高分化cSCC、中分化cSCC、低分化cSCC。
1.3 统计学分析 应用SPSS 21.0,其中计量资料用(±s)表示并采用t检验,而计数资料用百分率(%)表示,则用χ2检验,并采用Pearson相关性分析Nodal和TIF1-γ表达水平与病理特征的关系,检验水准为α=0.05,P<0.05有统计学意义。
2 结果
2.1 Nodal与TIF1-γ着色基本情况 显微镜可见Nodal、TIF1-γ主要定位于细胞膜、细胞浆中,且呈现棕黄色或棕褐色,同时染色显著较背景高。
2.2 Nodal与TIF1-γ在2组的表达对比 Nodal在cSCC组中的阳性表达率高于对照组,TIF1-γ在cSCC组中的阳性表达率低于对照组(P<0.05),见表1。
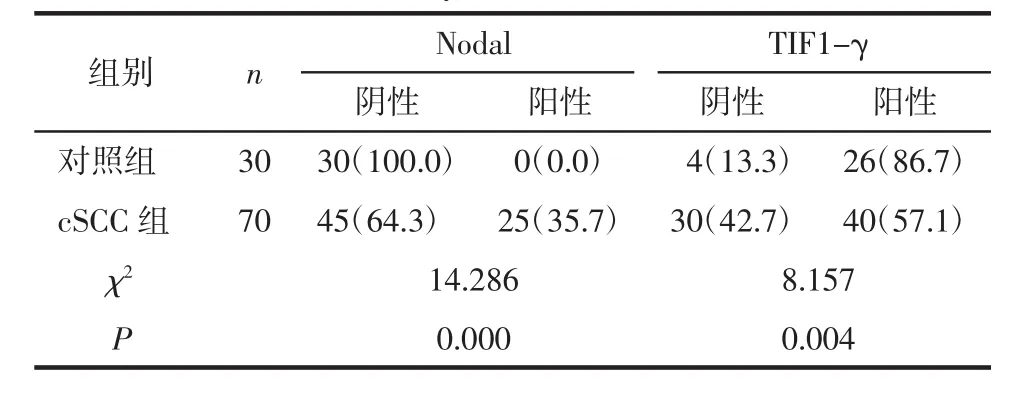
表1 Nodal与TIF1-γ在2组中的表达对比 例(%)
2.3 Nodal与TIF1-γ在cSCC组各组织学分化中的表达对比 在cSCC组中,Nodal在低分化组阳性表达率高于高分化组,TIF1-γ在高分化组阳性率均显著高于中分化组与低分化组(P<0.05),见表2。
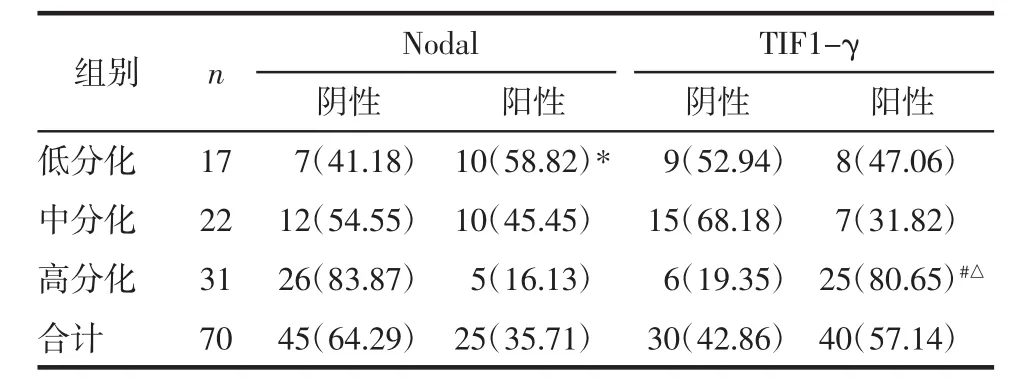
表2 Nodal与TIF1-γ在cSCC组各组织学分化中的表达例(%)
2.4 Nodal与TIF1-γ在cSCC组各临床分期中的表达对比 在cSCC组中,Nodal在Ⅲ期组的阳性表达率高于Ⅰ~Ⅱ期组,IF1-γ在Ⅰ~Ⅱ期组的阳表达性率高于Ⅲ期组(P<0.05),见表3。
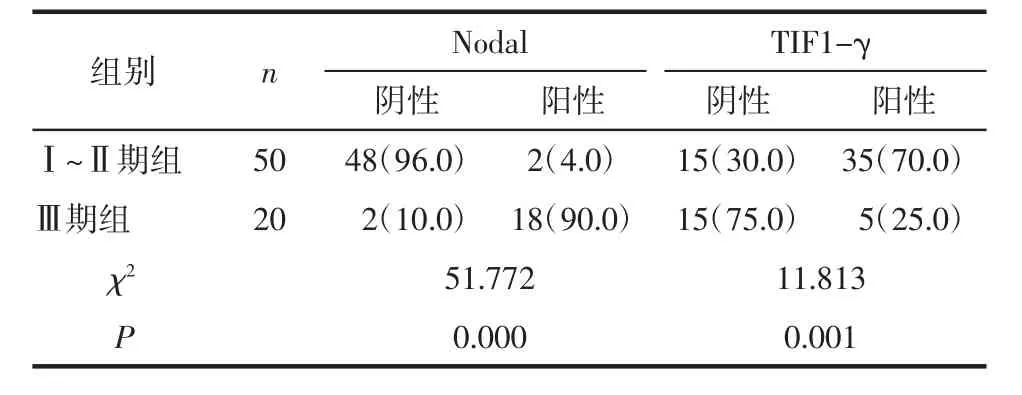
表3 Nodal与TIF1-γ在cSCC组各临床分期中的表达例(%)
2.5 相关性分析 在cSCC组中,Pearson相关性分析显示Nodal、TIF1-γ表达水平与组织学分化、临床分期都存在相关性(P<0.05),见表4。

表4 cSCC患者病变组织Nodal和TIF1-γ表达水平及其与病理特征的相关性
3 讨论
cSCC是发生在表皮与附属器角质形成细胞的恶性肿瘤,好发于皮肤暴露部位如手背及头部等,并且能够进一步浸润转移至深层组织[9]。该病的具体发病机制还不明确,不过病因包括人乳头瘤病毒(HPV)感染、紫外线照射和砷接触等[10-11]。
Nodal与肿瘤发生、发展存在密切的联系,其在肿瘤细胞的增殖与浸润、转移中发挥着显著的调节作用,并且能够促使肿瘤细胞与胚胎干细胞维持多向分化的潜能性[12]。TIF1-γ能够引起TGF-β信号通路中Smad4分子发生单泛素化,使得其活性显著降低,进而导致此通路中抗细胞增生相关基因的表达降低,导致TGF-β信号通路抗细胞增生作用消失,最终引起肿瘤的发生[13]。此外TIF1-γ的表达能够在早期外胚层发育时,对Nodal信号通路造成抑制,并且TIF1-γ在不同实体瘤细胞中出现异常低表达的情况,其基因的异常表达是导致恶性肿瘤发生的重要影响因素[14-15]。本研究显示Nodal在cSCC组中的阳性表达率高于对照组,TIF1-γ在cSCC组中的阳性表达率低于对照组。Pearson相关性分析显示cSCC组Nodal、TIF1-γ表达水平与组织学分化、临床分期都存在相关性。同时本研究显示Nodal在低分化组的阳性表达率显著高于高分化组,并且其在cSCC组患者Ⅲ期组显著高于Ⅰ~Ⅱ期组,提示Nodal的表达可能对肿瘤不同基因的表达产生影响,可进一步引起肿瘤恶性程度的加重,最终导致肿瘤发生转移与浸润。这也反应出Nodal蛋白作为关键性的调节因子,可能与cSCC疾病的发生、发展密切相关,可作为重要的肿瘤标志物之一[16-17]。本研究也发现TIF1-γ在高分化组的阳性表达率均显著高于中分化组与低分化组,并且其在cSCC组患者Ⅰ~Ⅱ期组显著高于Ⅲ期组。提示TIF1-γ在cSCC发生、发展中可能扮演着抑癌基因的角色,但目前对其具体影响机制与其信号转导通路的机制尚未明确,有待进一步探讨。
综上所述,cSCC患者病变组织的Nodal呈现高表达水平,TIF1-γ呈现低表达水平,与患者的临床分期与组织学分化等病理特征都存在相关性。
