蛇葡萄素通过核转录因子-κB通路调控黑色素瘤A375细胞周期和凋亡
2022-07-01蔡美红刘向东龙剑文
蔡美红,刘向东,龙剑文
(1.武汉市武昌医院,湖北 武汉 430063;2.湖北中医药大学,湖北 武汉 430061)
黑色素瘤是常见的皮肤肿瘤,并以其较高的转 移率,死亡率和治疗抵抗而闻名[1]。早期黑色素瘤可以通过手术切除,患者存活率较前提高,且随着新型靶向治疗药物和免疫治疗方法的开发,晚期黑色素瘤的疗效也有明显改善[2],但转移性黑色素瘤患者的总体预后仍然较差[3]。因此,有必要为临床研究寻找新的潜在治疗药物。蛇葡萄素,又称二氢杨梅素,是一种黄酮类化合物,从蛇葡萄茎叶中分离得到,有多种药理特性,如抗氧化、抗炎、抗疲劳、抗癌[4],见图1A。最近的研究表明,蛇葡萄素可以抑制乳腺癌和结肠癌细胞增殖[5-6]。但是,蛇葡萄素对人黑色素瘤细胞增殖,细胞周期和凋亡的影响及机制目前尚不清楚。本文研究了蛇葡萄素对人黑色素瘤A375细胞增殖,细胞周期和凋亡的影响,探讨利用蛇葡萄素治疗人黑色素瘤的可能机制。
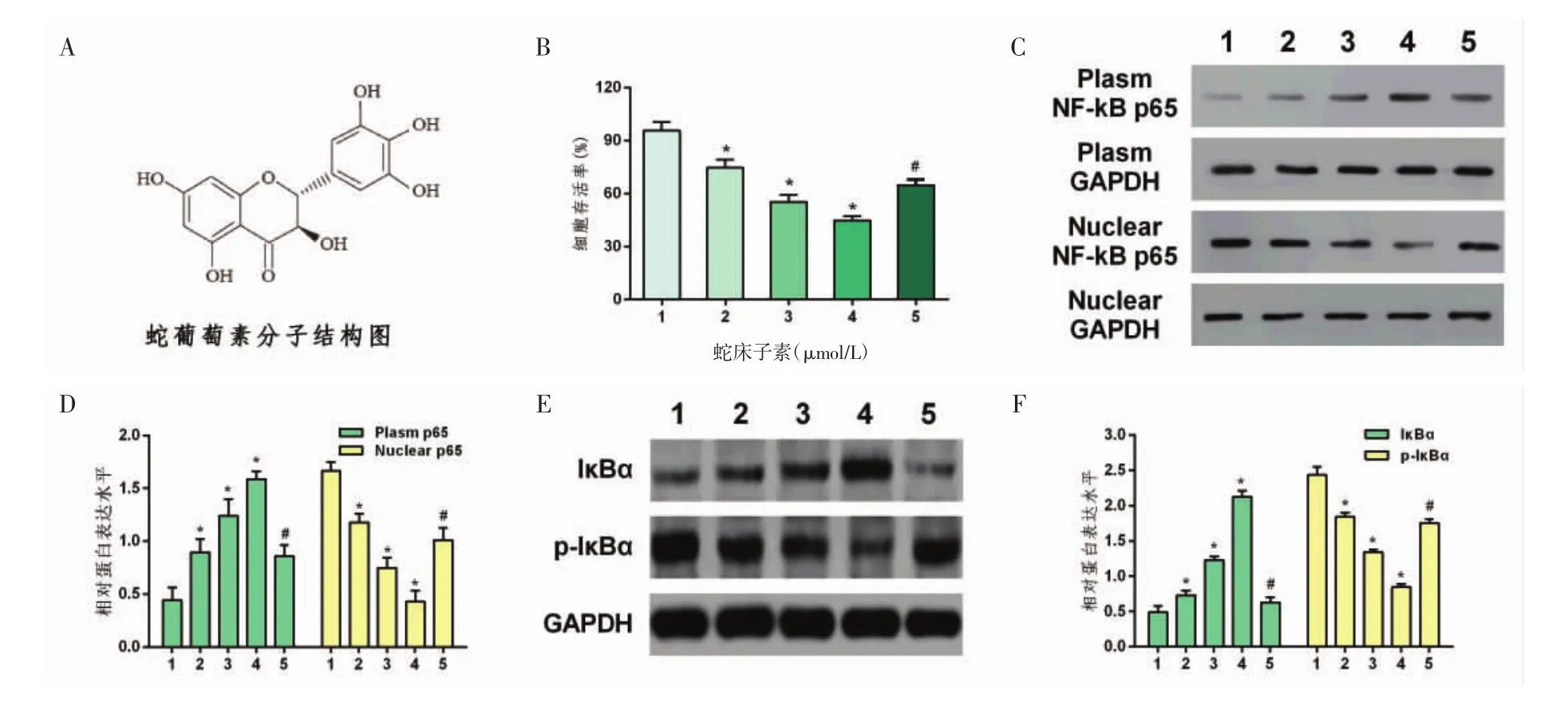
图1 蛇葡萄素的结构式及对A375细胞增殖和NF-κB通路的影响
1 材料与方法
1.1 实验材料 蛇葡萄素(纯度>98%)购自广州伟伯科技有限公司。实验用抗体主要有Bax抗体、Bcl-2抗体、Cleaved-caspase-3抗体、Cyclin D1抗体、CDK4抗体、NF-κB 抗体、p65抗体、IκBα 抗体、p-IκBα 抗体均购自美国Cell Signal Technology公司。PMA购买于Santa Cruz Biotechnology公司。Annexin-V/PI凋亡检测试剂盒购置于美国BD公司。荧光显微镜购置于日本Olympus公司。
1.2 方法
1.2.1 细胞培养 取人黑素瘤A375细胞,于37℃、5% CO2,在含有 10%胎牛血清、青霉素(100 U/mL)及链霉素(100 mg/L)的DMEM培养液中培养,胰酶消化传代,取对数生长期细胞进行实验。正常黑素细胞取自于健康男性包皮[7],在含有细胞生长添加成分(HMGS)的M254培养基中培养,采用钙离子结合蛋白S100免疫组化染色法,证实其纯度超过95%。
1.2.2 蛇葡萄素对正常黑素细胞生长的影响 正常黑素细胞消化后,按5×104/孔接种于96孔板中,培养24h,实验分为只含有培养基和CCK-8的空白组、终浓度分别为 0(对照组)、5、10、25、50、100 μmol/L蛇葡萄素组,每组6孔,培养48 h后,加入八肽胆囊收缩素(CCK-8)10 μL,待培养液显色后,用酶标仪测各孔450 nm波长的吸光度,以细胞的存活率代表细胞的增殖程度。计算公式为:细胞的存活率(%)=[(A1-A3)/(A2-A3)]×100%。A1:实验组;A2:对照组;A3:只含有培养基和CCK-8空白组。
1.2.3 蛇葡萄素对人黑色素瘤A375细胞增殖的影响 取对数生长期A375细胞消化后,于96孔板中培养 24 h,实验分为 0、25、50、100 μmol/L 蛇葡萄素组及100 μmol/L蛇葡萄素组+200 nmol/L PMA组,各组培养48 h后,加入CCK-8 10 μL,待培养液显色,用酶标仪测各孔450 nm波长的吸光度。
1.2.4 Hoechst 33258荧光法检测细胞凋亡形态变化 将5×104/L人黑色素瘤A375细胞接种在6孔板(每孔 2 mL)中培养 24 h 后,实验分为 0、25、50、100 μmol/L蛇葡萄素组及100 μmol/L蛇葡萄素组+200 nmol/L PMA组。在37℃下,各组培养48 h后,磷酸盐缓冲液(PBS)洗2遍,然后用4%甲醛固定10 min,PBS洗涤细胞,在37℃下,用Hoechst 33258(10 mg/L)染色1 h,然后进行荧光显微镜检查。
1.2.5 流式细胞仪检测细胞凋亡率 实验分为0、25、50、100 μmol/L 蛇葡萄素组及 100 μmol/L 蛇葡萄素组+200 nmol/L PMA组,细胞处理48 h后,1 000转/min(半径为20 cm)离心5 min后弃上清液,室温下PBS洗涤2次,收集细胞,加入结合缓冲液,重新悬浮细胞,调整细胞浓度。随后,添加5 μL Annexin V-FITC 和 5 μL PI,并在黑暗中培养 15 min,于 1 h内用流式细胞仪检测细胞凋亡。
1.2.6 流式细胞仪检测A375细胞周期变化 人黑色素瘤A375细胞以5.0×104/L的浓度接种在6孔板中,然后隔夜培养。实验分为 0、25、50、100 μmol/L蛇葡萄素组及100 μmol/L蛇葡萄素组+200 nmol/L PMA组,37℃,继续培养48 h。收集细胞,并用预冷PBS洗涤2次。4℃,在70%乙醇中固定过夜,并用PI和 RNase A 溶液(5 μg/mL PI和 0.5 μg/μL RNase A)避光染色30 min后,流式细胞仪测定细胞DNA含量。
1.2.7 蛋白质印迹法(Western blotting,WB)检测蛋白含量 实验分为 0、25、50、100 μmol/L 蛇葡萄素组及100 μmol/L蛇葡萄素组+200 nmol/L PMA组,37℃,细胞培养48 h,收集细胞,PBS洗涤,冰上裂解 30 min,4℃ 12 000转/min(半径 20 cm)离心20 min,收集上清并用BCA法定量。用10%SDSPAGE分离蛋白并转移到PVDF膜上,PBS洗膜,5%脱脂牛奶在室温下封闭l h。在4℃下用一抗体孵育过夜,随后,用PBS洗涤膜3次,并加入HRP结合的二抗在室温下孵育2 h;洗膜;使用化学发光凝胶成像系统显示蛋白质条带,并使用Image Pro Plus 6.0软件进行定量分析。以β肌动蛋白为内参校正。
1.3 统计学分析 采用SPSS 13.0软件进行统计分析,计量资料以±s表示。多组均数比较采用单因素方差分析。组间多重比较采用SNK-q检验。P<0.05为差异有统计学意义。
2 结果
2.1 蛇葡萄素对正常黑素细胞增殖的影响 对照组黑素细胞存活率为(97.78±2.27)%,5、10、25、50、100 μmol/L 蛇葡萄素组分别为(97.01±1.20)%、(97.56±1.75)%、(97.52±2.59)%,(96.23±2.07)%、(95.46±2.42)%,6组存活率差异无统计学意义(F=1.12,P>0.05)。因此选定蛇葡萄素的工作浓度为25、50、100 μmol/L,对照组浓度为 0 μmol/L。
2.2 蛇葡萄素对A375细胞增殖的影响 不同浓度蛇葡萄素组中,A375细胞存活率组间差异有统计学意义(F=174.57,P<0.01),正常对照组 A375 细胞存活率高于 25 μmol/L蛇葡萄素组、25 μmol/L蛇葡萄素组高于50 μmol/L蛇葡萄素组、50 μmol/L蛇葡萄素组高于100 μmol/L蛇葡萄素组,差异有统计学意义(q=12.40、23.78、29.98,P<0.05)。但加用 NF-κB通路的活化剂200 nmol/L佛波醇脂(PMA)处理后,与100 μmol/L蛇葡萄素组组比较,A375细胞存活率明显提高(q=12.26,P<0.01)。见图1B。
2.3 蛇葡萄素抑制了NF-κB通路的活化 与正常对照组比较,在A375细胞中,各浓度蛇葡萄素呈剂量依赖性地提高了 IκBα 的表达(q=8.08、24.80、54.83,P<0.01),但显著抑制了 p-IκBα 的表达(q=20.15、37.36、54.16,P<0.05)。 p65 在胞浆中的表达升高(q=8.94、15.72、22.57,P<0.01),而核内表达明显降低(q=13.26、24.90、33.47,P<0.05),说明蛇葡萄素抑制了p65向细胞核的转移。但加用NF-κB通路的活化剂200 nmol/L PMA处理后,与100 μmol/L蛇葡萄素组组比较,A375细胞内IκBα的表达明显下降(q=50.19,P<0.01),p-IκBα 的表达明显提高(q=22.75,P<0.01),p65 在胞浆中的表达降低(q=14.77,P<0.01),而核内表达增加(q=14.90,P<0.05),说明PMA削弱了蛇葡萄素对NF-κB信号通路的抑制作用,见图1。
2.4 蛇葡萄素通过抑制NF-κB通路信号通路的活化诱导A375细胞凋亡 Annexin V/PI双染法结果显示,用不同浓度蛇葡萄素(终浓度分别为25,50,100 μmol/L)处理 A375 细胞 48 h 后,细胞总凋亡率分别为 (16.76±1.92)%、(30.04±2.28)%、(40.72±2.18)%,同正常对照组(7.21±1.42)%比较,组间差异均有统计学意义(F=332.61,P<0.01),加用200 nmol/L PMA处理后,细胞总凋亡率为(19.73±2.59)%,较100nmol/L蛇葡萄素组明显降低(q=24.32,P<0.01)。见图2A、C。同时,WB检测了各浓度蛇葡萄素对A375细胞内凋亡相关蛋白表达的影响,结果表明各浓度的蛇葡萄素增强了Cleaved-caspase-3和 Bax 的表达(F=73.96,P<0.01;F=54.78,P<0.01),而降低了凋亡抑制蛋白B细胞淋巴瘤-2(Bcl-2)的表达(F=82.87,P<0.01),而与 100 μmol/L 蛇葡萄素组比较,200 nmol/L PMA处理抑制了蛇葡萄素的上述效应(q=15.19,P<0.01;q=14.59,P<0.01;q=6.83,P<0.01)。见图2D、E。
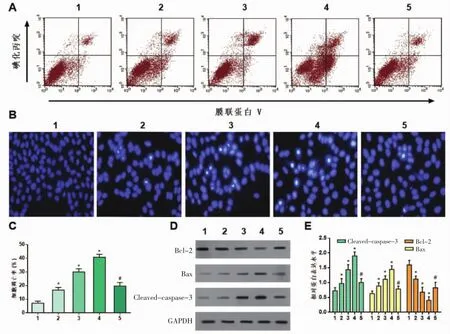
图2 蛇葡萄素通过抑制NF-κB通路信号通路的活化诱导A375细胞凋亡
2.5 观察A375细胞凋亡形态 经Hoechst 33258染色后,正常对照组中的A375细胞饱满,呈现均匀蓝色荧光;而在各浓度蛇葡萄素处理组中细胞明显皱缩,细胞核中可见浓染的荧光颗粒。见图2B。
2.6 蛇葡萄素通过抑制NF-κB信号通路阻滞A375细胞周期于G0/G1期 不同浓度蛇葡萄素组中,人黑色素瘤A375细胞G0/G1期细胞比例差异有统计学意义(F=62.10,P<0.01)。正常对照组细胞G0/G1期比例低于25 nmol/L蛇葡萄素组、25 nmol/L蛇葡萄素组明显低于50nmol/L蛇葡萄素组、50nmol/L蛇葡萄素组明显低于100 nmol/L蛇葡萄素组,差异均有统计学意义(q=5.11、11.83、18.08,P<0.01)。而与100 nmol/L蛇葡萄素组比较,200 nmol/L PMA处理削弱了蛇葡萄素对A375细胞细胞周期的抑制作用(q=10.46,P<0.01)。见图3A、B。同时,笔者进一步检测了蛇葡萄素对细胞周期调节蛋白Cyclin D1和CDK4的表达。结果表明,与正常对照组比较,各浓度蛇葡萄素明显抑制了 CyclinD1(F=207.57,P<0.01),CDK4(F=301.07,P<0.01)的表达,而与 100 nmol/L蛇葡萄素组比较,200 nmol/L PMA处理削弱了蛇葡萄素对Cyclin D1和CDK4表达的抑制作用(q=5.71,P<0.01;q=8.06,P<0.01),见图3C、D。
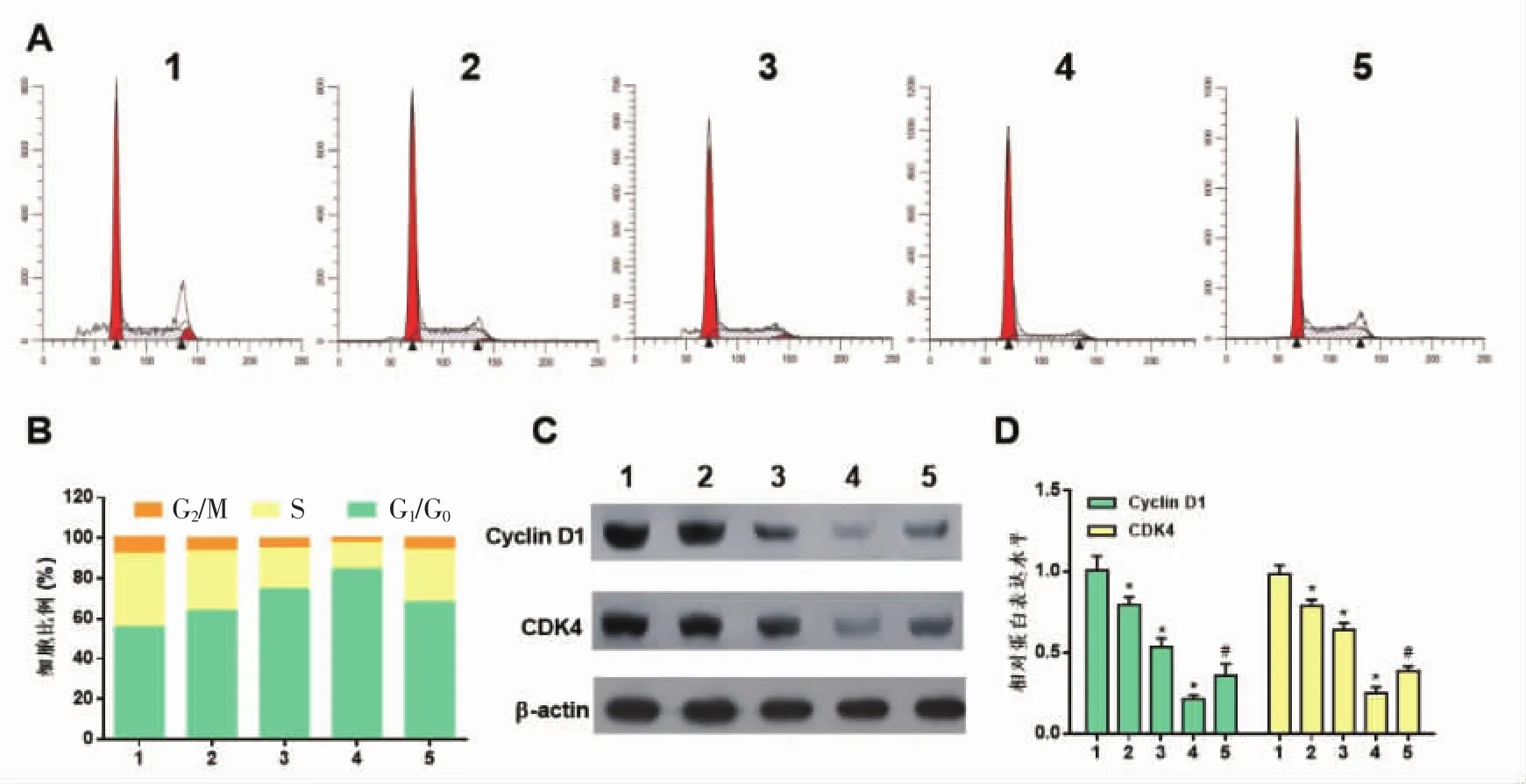
图3 蛇葡萄素通过抑制NF-κB通路信号通路阻滞A375细胞细胞周期于G0/G1期
3 讨论
恶性黑色素瘤有侵袭性,其发病率在过去30年中在世界范围内不断上升。尽管近年来在改善黑色素瘤预后方面做了很多努力,但即使经过积极治疗,黑色素瘤患者的长期生存机会仍然很低。对于Ⅳ期黑色素瘤患者,5年生存率只有9%~28%[8]。肿瘤转移和缺乏有效药物是导致总生存率低的主要原因。那么发现新的药物来抑制黑色素瘤细胞的增殖和转移已成当务之急。天然中草药有多种生物活性,是癌症治疗的常用药物[9]。蛇葡萄素是一种天然的黄酮类物质,存在于葡萄中,浆果、蔬菜、香草等植物中。蛇葡萄素有抗疲劳、抗炎、抗肿瘤、保肝、调节脂质代谢等生物活性[10]。在笔者研究的浓度范围内,蛇葡萄素对正常人黑色素细胞没有明显的细胞毒性。同时,笔者发现,蛇葡萄素在体外能显著抑制人黑色素瘤A375细胞系增殖,并通过抑制NF-κB通路的活化,促进细胞凋亡,诱导细胞周期G0/G1期阻滞。
NF-κB是一种核转录因子,与调控肿瘤细胞的多种生物学效应密切相关。NF-κB蛋白主要由异二聚体p50/p65构成。NF-κB通路活化主要通过磷酸化抑制分子IκBα,并导致其降解,进而释放胞浆二聚体NF-κB p65/p50[11]。NF-κB调节细胞功能最基本的亚单位是p65。在细胞信号转导途径中,NF-κB p65从细胞质转移到细胞核,产生生物学活性[12]。因此,检测NF-κB p65核蛋白可以指示NF-kB的活化程度。实验结果显示,蛇葡萄素明显促进了IκBα 的表达,明显降低了 p-IκBα 的含量,减少了NF-κB p65的核转位,抑制了人黑色素瘤A375细胞NF-κB通路的活化。
研究表明NF-κB通路活化能通过抑制细胞凋亡,促进肿瘤的发生[13]。而促进肿瘤细胞凋亡是一种治疗恶性肿瘤的有效手段。已经证实,抑制NF-κB通路的活化可以促进胃癌、甲状腺癌、乳腺癌等肿瘤细胞的凋亡[14-16]。Bcl-2蛋白家族,包括促凋亡蛋白(Bax)和抗凋亡蛋白(Bcl-2),在线粒体凋亡途径中发挥重要作用。线粒体Bcl-2/Bax蛋白比值对诱导肿瘤细胞凋亡有重要作用[17]。半胱氨酸蛋白酶家族能够促进肿瘤细胞凋亡[18]。Bax在细胞死亡刺激信号作用下向线粒体迁移,引发线粒体通透性转换孔相关事件的级联反应,导致线粒体膜电位下降[19]。而后,Caspase-9被激活,促进Caspase-3的活化,导致细胞发生凋亡[20]。在本研究中,蛇葡萄素促进了Cleaved-caspase-3和Bax的表达,而抑制了Bcl-2的表达,表明蛇葡萄素通过内源性途径促进人黑色素瘤A375细胞凋亡。
NF-κB能参与Cyclin D1等多种细胞周期蛋白的转录,进而调控细胞周期[21]。而细胞周期失调是肿瘤发生发展的重要因素,控制癌细胞的细胞周期过程是抑制肿瘤生长和发展的有效治疗策略。细胞周期蛋白和细胞周期蛋白依赖性激酶(CDKs)与肿瘤细胞周期关系密切[22]。CDKs是细胞周期机制的重要调节因子,调节细胞周期从一个阶段向下一阶段的发展[23]。细胞周期蛋白和CDK活性异常可导致细胞程序性死亡的失调,有利于肿瘤细胞的选择性生长[24]。细胞周期蛋白D1作为G1检查点的关键介质,主要在G1期早期表达。而后,Cyclin D1/CDK4的活性复合体靶向视网膜母细胞瘤蛋白并将其磷酸化,从而释放可激活G1/S期基因表达的转录因子E2F,使细胞周期通过G1/S期[25]。在本研究中,蛇葡萄素通过抑制Cyclin D1和CDK4的表达,将细胞周期阻滞于G0/G1期。
综上所述,笔者证实了蛇葡萄素通过NF-κB通路调控黑色素瘤A375细胞周期和凋亡,抑制A375细胞增殖,为合理利用蛇葡萄素防治恶性黑色素瘤提供了依据。
