SIRT1 基因多态性与BMI 及酒精性肝病相关性的研究
2022-06-30侯叶廷牛海静安彩艳史丽芳格日勒武艳芳
侯叶廷,牛海静,安彩艳,史丽芳,格日勒,武艳芳
(1.内蒙古医科大学附属医院 消化内科,内蒙古 呼和浩特 010050;2.内蒙古医科大学附属医院 临床医学研究中心,内蒙古 呼和浩特 010050)
酒精性肝病(alcoholic liver disease,ALD)由于高发病率、高死亡率,成为全世界备受关注的公共卫生问题,我国ALD 的发生率逐年上升,严重危害人民健康。研究ALD 的发病机制,有利于ALD 的防治。饮酒量、饮酒频率、饮酒种类等影响因素相同的条件下,不同个体对酒精性肝病的易感性不同,很大程度取决于遗传易感性,因此,酒精性肝病基因多态性相关研究成为热点。沉默信息调节因子1(SIRT1)广泛参与哺乳动物细胞寿命的多条信号通路以及糖、脂代谢、胰岛素分泌等多条代谢通路的调控,具有调节机体能量代谢平衡,保持机体糖脂代谢稳态功能。一些动物研究已经发现:通过调节SIRT1 及SIRT1 相关信号通路,显著改善酒精性肝损伤的程度[1-5]。因此,通过调节、干预SIRT1 及SIRT1 相关代谢途径可以缓解酒精性肝病的程度,但具体的调节机制尚不明确。本研究以酒精性脂肪肝病为研究对象,与非酒精性脂肪肝、饮酒对照组、健康对照组对照研究,研究SIRT1基因多态性与BMI 及酒精性肝病的相关性。
1 材料与方法
1.1 实验材料
1.1.1 伦理声明 本研究通过内蒙古医科大学附属医院伦理委员会批准,并遵照赫尔辛基宣言[6],所有受试者签署知情同意书。
1.1.2 研究对象 研究对象分成四组:(1)酒精性脂肪肝组(AFLD,n=176),日饮酒量折合酒精量大于40 g,饮酒年限大于5 年,脂肪肝的超声诊断标准符合欧洲肝病学会[8]和美国肝病研究学会标准[9];(2)非酒精性脂肪肝病组(NAFLD,n=117),无饮酒史,超声诊断标准符合欧洲肝病学会[8]和美国肝病研究学会标准[9];(3)饮酒对照组(n=92),日饮酒量大于40 g,饮酒年限大于5 年,无脂肪肝的证据;(4)健康对照组(n=120),无饮酒史,无脂肪肝证据,相关化验检查正常。
1.1.3 排除标准 本研究所有受试对象无肝细胞癌,有以下任何一项者,将从本研究中排除:(1)有乙肝表面抗原阳性,丙肝抗体阳性,艾滋病抗体阳性;(2)糖尿病患者;(3)其它原因导致的肝病(肝豆状核变性,自身免疫性肝病,药物诱发的肝病等);(4)汉族以外的民族;(5)不愿意参与本研究的。
1.1.4 一般资料收集 符合入选标准的研究对象,详细询问病史,包括饮酒史、饮酒年限,既往病史等,收集性别、年龄、身高、体重,测定肝功能、血糖、血脂,填写基础数据表(表1)。
1.1.5 标本采集 受试对象空腹一夜后,抽取2 mL 外周静脉血,血液标本EDTA 抗凝处理,3000 r/min 离心10 min,用DNA 工具包从外周血中提取全基因组,DNA 浓度检测仪用于确定DNA 的纯度,DNA 保存在-80 ℃冰 箱 中。 注:DNA 工 具 包(Takara Company,Japan)DNA concentration detector(NANODROP2000,Thermo)。
1.2 实验方法
1.2.1 基因类型检查 根据人类基因组计划1000 提供的数据,用Haploview 软件选择四组SIRT1核苷酸片段,分别命名为:rs33957861、rs11599176、rs12413112、rs35689145。基因类型检测应用西格诺质谱分析平台(Sequenom,Son Diego,CA),PCR 引物用质谱分析软件3.1 设计,PCR 多通道反应系统包括2 μL DNA样本(2.5 ng/μL),水2.18 μL,反应缓冲液0.5 μL ,MgCl2(25 mmol/L)0.5 μL,dNTP 混合物(10 mmol/L)0.1 μL,引物混合物(1 μmol/L)0.5 μL。PCR 反应条件如下:95 ℃15 min,然后95 ℃20 s,5 个循环;65 ℃30 s,72 ℃1 min,然后95 ℃20 s,5 个循环;58 ℃30 s,72 ℃1 min,以72 ℃30 min 结束。碱性磷酸酶活性和iPLEX 扩增反应过程依据厂家说明书进行。每次吸取15~25 μL 标本置于光谱分析仪,利用西格诺质谱仪进行分析,下一步用Mass Array Typer 3.4 软件,根据扩增产物确定基因类型。
1.2.2 统计学分析 所有数据用SPSS 22.0 统计软件包进行统计分析,计量资料采用-X±S表示,方差分析统计分析。计数资料用百分数和率表示,χ2检验进行统计分析,OR 值和95% 的可信区间分析采用非条件回归分析,基因多态性、体重和疾病的关系用多元回归分析,基因的单倍型用SHEsis 分析,P<0.05 为有统计学差异。
2 结果分析
2.1 研究对象的一般临床特征
如表1 显示,各组间的年龄、性别、随机血糖比较无统计学差异(P>0.05)。与健康和饮酒对照组相比,NAFLD 组的体重指数(BMI),谷丙转氨酶(ALT),谷草转氨酶(AST),碱性磷酸酶(ALP),胆固醇(Cholesterol),AFLD 组的BMI,ALT,AST,ALP,胆红素(Bilirubin),Cholesterol 显著升高(P<0.05)。而且,与健康对照组相比,酒精对照组的BMI 显著增加(P<0.05)。另外,与NAFLD 组相比,AFLD 组,Cholesterol,ALT,AST 显著升高(P<0.05)。两组间,其它临床指标没有明显差异(P>0.05)。与其它三组比较,AFLD 组,胆红素显著升高(P<0.05)。

表1 研究对象的一般临床指标比较Tab.1 Comparison of the general characteristics of the study subjects in different groups
2.2 SIRT1 基因四组核苷酸与酒精性脂肪肝发病风险的相关性
非条件回归分析和FDR 矫正(表2)显示,与健康对照组和饮酒对照组,携带rs33957861 C>T,rs11599176 A>G,rs12413112 A>G 的个体,AFLD 和NAFLD 的发病风险明显降低,而携带rs35689145的个体,AFLD 和NAFLD 的发病风险上升(均为P<0.05)。另外,与CC 和AA 基因型比较,rs33957861 C>T 的CT+TT,rs11599176 A>G 的AG+GG,rs12413112 A>G 的AG+GG 降低AFLD 的发病风险,然而,与CC 基因型比较,rs35689145 A>G 基因型AG+GG 明显增加AFLD 的发病风险。在NAFLD和AFLD 及健康对照组、饮酒对照组四组中,四组核苷酸的基因频率无明显差异(均为P>0.05)。另外,如表3 所示,用在线的SHEsis 软件行单倍体分析显示单倍体AAAA,CAGA 和CGAA 能明显降低酒精性脂肪肝的发病风险;相反,CAAG 增加AFLD 的发病风险(均为P<0.05)。
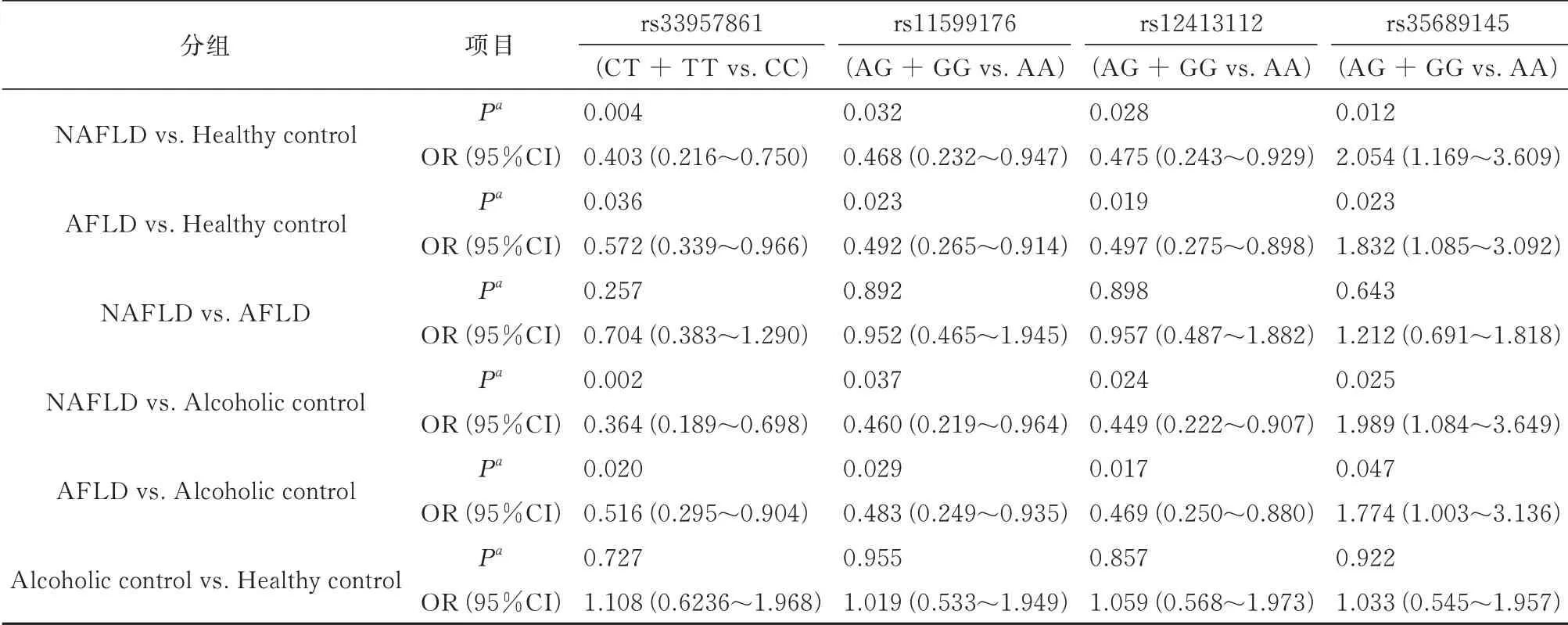
表2 SIRT1 基因四组核苷酸和NAFLD 及AFLD 的相关性Tab.2 Correlation analysis of four SNPs of within the SIRT1 gene and the risk of NAFLD and AFLD

表3 SIRT1 基因四组核苷酸单倍型与AFLD 的相关性分析Tab.3 Correlation analysis of haplotype of four SNPs within the SIRT1 gene with AFLD
2.3 SIRT1 基因四组核苷酸和各组BMI 的关系
就NAFLD 和AFLD 组而言,与CT+TT 基因型比较,携带rs33957861 CC 基因型的个体BMI 较高(图1)。另外,与AG+GG 基因型比较,rs11599176,rs12413112 的AA 基因型携带者BMI 较高。然而,与AG+GG 基因型比较,rs35689145 的AA 基因型有较低的BMI(均P<0.05)。在饮酒对照组,与rs33957861的CC 基因型,rs11599176 的AA 基因型比较,CT+TT 和AG+GG 基因型BMI 较低(均为P<0.05)。而且,在健康对照组,与rs11599176,rs12413112,rs35689145 的AG+GG 基因型比较,rs11599176,rs12413112的AA 基因型有更高的BMI,然而,携带rs35689145 AA 基因型的有较低的BMI(均为P<0.05)。而且,多重回归分析显示,rs33957861 C>T,rs11599176 A>G 和BMI 是AFLD 的独立危险因素(表4)。

图1 SIRT1 基因四组核苷酸和各组BMI 的关系Fig.1 Association of four SNPs within the SIRT1 gene and BMI in subjects from different groups
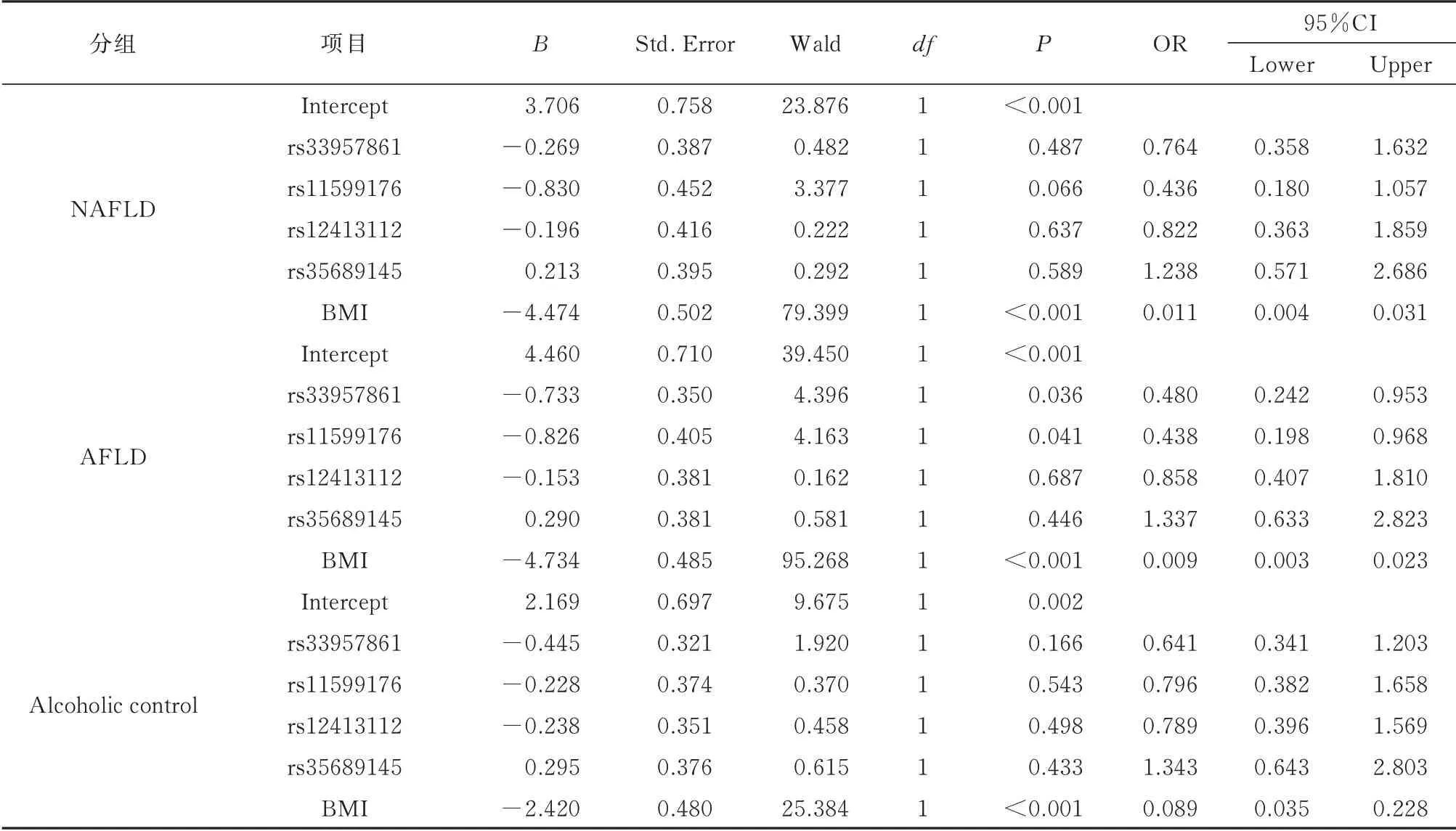
表4 将健康对照组作为参照组进行多元多级回归分析Tab.4 Multivariate polychotomous logistic regression by taking healthy control as a referent group
3 讨论
SIRT1 是介导多条细胞信号转导途径的关键转录因子,在调节能量稳态方面起着至关重要作用。人类SIRT1基因定位于染色体10q22.1,基因长度为33 000 bp,编码的蛋白相对分子质量为120 000,由1 500 个氨基酸残基组成,包含9 个外显子和8 个内含子。本研究选择的SIRT1基因的四组核苷酸rs33957861,rs11599176,rs12413112,rs35689145 均位于内含子。
乙醇对多种调节因子的作用,全部或部分通过抑制中枢信号分子SIRT1 来介导的,SIRT1 相关信号通路参与AFLD 的发生,但具体的调节机制尚未完全明确,基因水平的研究可能揭示SIRT1 参与AFLD 的发病机制。既往研究显示:SIRT1 激动剂白芦藜醇可明显减轻脂质相关代谢性肝损伤[10],另一项研究[11]显示:丹酚酸B 可明显增加SIRT1 的表达,减少C 反应蛋白(CRP)等相关炎症介质水平,减轻大鼠模型的酒精性肝损伤,最近的一项研究[12]发现:敲除小肠SIRT1 对乙醇诱导的小鼠炎症和肝损伤具有保护作用,提示肠道SIRT1 缺乏对乙醇相关肝损伤的保护作用。肝脏的SIRT1 对于酒精性肝损害具有保护作用,而肠道SIRT1作用相反,提示SIRT1 的调节机制具有组织特异性,具体调节机制如何,下调或上调是如何实现的呢?本研究发现,SIRT1基因四组核苷酸与酒精性脂肪肝病的敏感性相关,不同个体对AFLD 的敏感性不同,可能与携带的核苷酸类型有关,SIRT1 对于酒精性肝损害的调节机制非常复杂,不是所有的SIRT1核苷酸对于酒精性肝损害具有保护作用,部分核苷酸会升高ALD 的发生风险,所以单纯调高SIRT1 的水平,不一定会减轻酒精性肝损害,一些对于酒精性肝损伤具有保护作用的SIRT1 激动剂,可能是激活了部分有益的核苷酸,抑制了有害的核苷酸,不同组织中的SIRT1 对于酒精性肝损害的作用不同,但具体机制有待进一步研究,而且本研究仅仅涉及内含子的四条核苷酸,其它与AFLD 相关的核苷酸有待进一步发现及研究。
众所周知,体重指数高的个体通常有过多的脂肪沉积,尤其在肝脏。除了提供能量供应,肝脏中的脂肪酸合成中性脂肪,但过多的中性脂肪超过载脂蛋白的转运能力,最终导致脂肪肝的发生[13-14]。最重要的是脂肪肝患者通常有明显高的体重指数,但是,随着体重指数的下降,肝脏的脂肪沉积下降,脂肪肝可以缓解,以上说明:脂肪肝的发展随着体重指数的增加而发展[15]。而且,以前的临床研究证实了SIRT1基因多态性和体重指数的密切关系。一项研究发现,SIRT1基因(rs10509291 和rs10823116)中,820 例非糖尿病个体中,一般等位基因的变异与升高的体重指数(>23 kg/m2)相关[16]。另外,Zillikens 等[17]发现:在两个独立的群体中,SIRT1基因的rs7895833 和rs1467568 最小等位基因与较低的体重指数是相关的。意大利的一项研究[18]发现:对21 例神经性厌食症患者,26 例正常体重和75 例肥胖患者进行了评价,结果发现厌食症患者SIRT1 显著高于正常体重和肥胖患者(分别为(3.27±2.98)、(2.27±1.13)和(1.36±1.31)ng/mL)。根据年龄和性别调整的每个预测变量的线性回归模型表明,SIRT1 浓度与BMI 呈显著负相关。本研究显示体重指数和SIRT1基因多态性在酒精性脂肪肝病的发病风险中扮演着重要的角色,这与以前大量的研究一致。本研究发现,在非酒精性脂肪肝病和酒精性脂肪肝病个体中,携带SIRT1基因rs33957861,rs11599176 ,rs12413112 突变基因型体重指数较低,然而,携带rs35689145 突变型者体重指数较高。通过logistic 回归分析,rs33957861 C>T,rs11599176 A>G 和体重指数是酒精性脂肪肝的独立危险因素。与本研究相似,Clark 等[19]证实这四组核苷酸和体重指数有密切的联系。一项来自日本的研究[20]发现,在无卡路里限制(CR)组中,具有rs1467568 G 等位基因的女性比没有的BMI 更高(P=0.02),此外,具有rs7895833 A或rs1467568 G 等位基因的妇女,与没有这些等位基因的妇女,从20 岁开始体重增加更加明显(rs7895833为P=0.03,rs1467568 为P=0.003)。因此认为携带SIRT1基因的单核苷酸rs33957861,rs11599176 ,rs12413112 个体有较低的发生酒精性脂肪肝的风险,而携带rs35689145 个体有较高的发生AFLD 的风险。另外,在非酒精性脂肪肝和酒精性脂肪肝个体间,不同组间没有明显的差异。本研究结果显示,在非酒精性脂肪肝和酒精性脂肪肝个体中体重指数没有统计学差异。SIRT1基因多态性可能通过体重指数诱发脂肪肝的发生。
研究发现具有单倍体AAAA,CAGA 和CGAA 的个体发生AFLD 的概率较低,然而,CAAG 发生AFLD 的风险较高,以上的研究进一步揭示SIRT1基因多态性与患者对AFLD 的易感性密切相关。慢性大量酒精喂养的大鼠模型试验显示:肝细胞内SIRT1基因的过度表达可能激活SIRT1 的活性,作为对过度酒精暴露的反应,阻止脂肪的过度沉积[21]。而且,大量证据证明,SIRT1 处于抑制状态下,过量的酒精暴露会导致酒精性脂肪肝的发生,肝内也会产生大量的炎症因子[22],主要是通过破坏肝细胞的营养信号网络调节、转录调节及协同调节的变化。
由本研究可知,四组核苷酸与酒精性脂肪肝的发病风险和体重指数之间的关系是密切相关的。不同个体对AFLD 的敏感性不同,与携带的核苷酸不同可能有关。但这仅仅是内含子的四条核苷酸,其它与AFLD 相关的核苷酸有待进一步发现和研究。减肥和干扰核苷酸代谢有利于AFLD 的预防、治疗。
