肝内门-体静脉分流的彩色多普勒超声影像特征分析
2022-06-30潘国栋张瑶王雪梅杨学平
潘国栋 张瑶 王雪梅 杨学平
肝内门-体静脉分流(intrahepatic portosystemic venous shunt,IPSVS)在临床上较为少见,是指在肝内门静脉分支与汇流入下腔静脉的肝静脉主干或其分支相交通,此种状态下门静脉的血液未经过肝脏代谢而直接通过肝静脉、下腔静脉回流至心脏,继而可引起肝性脑病等多种并发症,因此应引起人们的重视。既往报道称在2000年前有关成人IPSVS的文献报道不足50例[1],近年来随着超声及放射等影像学的广泛应用,发现IPSVS的患者逐渐增多,但多以病例报道为主[2-4],总结39例IPSVS患者的彩色多普勒超声声像图特征,旨在为提高超声医师对本病的诊断水平,为临床医生对肝性脑病的诊断提供理论依据,早期干预,提高患者的生活质量。
1 资料与方法
1.1 一般资料 收集2017年1月至2020年4月在地坛医院行腹部超声检查诊断肝内门-体静脉分流患者的临床资料,分析总结其二维及彩色多普勒超声声像图特征。
1.2 仪器与方法 应用GE LOGIQ E9、GE VOLUSON E8/E10多普勒超声诊断仪,凸阵探头,频率1.0~6.0 MHz。患者空腹>8 h,对肝脏进行多体位、多切面扫查,重点关注肝静脉及门静脉系统血管走行、内径及下腔静脉的走行情况,发现肝脏内异常无回声,对于较小的无回声病变必要时应用“Zoom”键(放大键)观察无回声形态及内部回声情况,追踪扫查其与肝内门静脉、肝静脉、肝动脉、下腔静脉的解剖关系,应用彩色多普勒(CDFI)观察无回声内是否有血流,依据血流色彩判别血流方向,根据频谱多普勒(PW)血流频谱形态,判断血流性质,测定血流速度,以CT或MRI增强扫描为确诊手段[5]。
2 结果
2.1 IPSVS患者临床基本特征 共有39例患者纳入研究。见表1。

表1 39例IPSVS患者的临床基本特征
2.2 肝内门-体静脉分流部位 虽然分流部位不尽相同,但超声表现基本相同,分为肝实质内出现囊状或迂曲管道状的无回声,边界清晰,壁薄、光滑,最为关键表现是无回声一端与肝内门静脉系统相通,而另一端与肝静脉系统相通,CDFI:无回声内可见血流信号,流速偏高,多为花色血流信号,可判别其血流方向为门静脉流向肝静脉,频谱多普勒显示为静脉样频谱,其流速一般大于正常相同节段肝静脉流速,此组病例平均流速为2 812 cm/s;与其相连通的门静脉正常的频谱形态消失,表现为持续的低速频谱。见表2。

表2 肝内门-体静脉分流部位
2.3 门静脉及肝静脉血管内径情况 39例分流患者中可见分流处肝静脉明显增宽32例,内径范围1.2~2.4 cm,内径均值(1.6±1.0)cm;分流处的门静脉、肝静脉内径未见明显增宽7例。31例肝硬化的患者中,门静脉主干增宽23例(74%),同时存在脐静脉开放、胃底静脉曲张等肝外门-体静脉分流征象26例(84%);患者肝脏形态大小回声正常,门脉主干内径正常,无肝外门-体静脉分流8例。见图1~3。

图1 Ⅰ型IPSVS图像,门静脉右后支-下腔静脉分流

图2 Ⅱ型IPSVS图像,门静脉右后支-肝右静脉分流
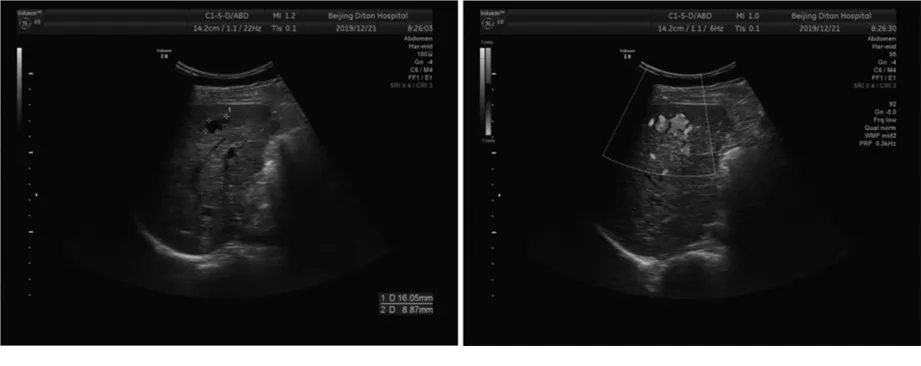
图3 Ⅲ型IPSVS图像,位于肝脏边缘,呈不规则无回声,似囊肿
3 讨论
IPSVS是一种少见的病理改变,病因不明,可继发于肝硬化门静脉高压、肝脏外伤或医源性损伤,也可能是自发性(先天性)[6]。本组中31例患者继发于肝硬化,主要是由于肝内门静脉内压力持续增高,门脉血流受阻,出现代偿性分流,逐渐形成门静脉与肝静脉或下腔静脉等体静脉间的直接连通。8例无肝硬化门静脉高压病史、无外伤及医源性损伤史,考虑其是先天发育异常所致。先天性IPSVS的形成机制在于胚胎期门静脉和肝静脉系统的发育过程中出现未闭的交通支,在出生后也未闭合。有文献报道胎儿期发现先天性门-体静脉分流中分流量较小的病例,可在2岁前出现自发闭合,但具体比例不详[7,8]。
Park等[9]根据门-体静脉分流解剖学形态特征将IPSVS分为4型。Ⅰ型为门静脉右支和下腔静脉间以粗大管道直接连接、持续存在管状交通;Ⅱ型是局限于肝脏一个肝段内门静脉分支及肝静脉间的管状交通,Ⅲ型是近肝脏表面门脉分支与肝静脉分支间呈囊状交通,有时形成静脉瘤[10],Ⅳ型是指分布于肝脏两叶以上的门静脉、肝静脉间广泛交通。文献报道IPSVS多是门静脉末梢分支和肝静脉的末梢分支,伴有或不伴有灶性静脉曲张的局限性分流[11,12],也就是Ⅲ型常见。但本组病例中以Ⅰ型、Ⅱ型多见,在39例中有32例(82.0%)位于肝右叶,明显多于左肝的5例(12.8%,P<0.01),均为门静脉右分支与肝右静脉或下腔静脉相连通,这可能与本组病例患者多以肝病来就诊有关。为了提高本病的诊断率笔者对IPSVS的超声诊断经验做如下总结:(1)肝实质内可见无回声时,应多切面扫查,判定其与肝内血管及胆管的关系,尤其肝脏边缘见小囊状无回声,形态欠规则者,常误诊为肝囊肿,文献中也偶有误诊病例报告[13],本组病例中存在1例首次超声检查被误诊为肝囊肿的患者3例。(2)应常规采用彩色多普勒超声观察无回声是否有血流信号,判断血流方向,频谱形态及血流速度,估测分流量,为临床诊断提供线索,调节彩色血流成像时尽可能采取各种方式提高彩色血流显示的敏感度,依据机器的不同可采取各种微细血流显像模式,降低速度标尺,提高彩色增益,采用能量图等。(3)当分流量较大时,与之相连通的肝静脉内径增宽,走行迂曲,因此对于局限性肝静脉增宽的患者应仔细追踪是否存在IPSVS。(4)与之需要鉴别诊断的除了肝囊肿之外还包括门静脉或肝静脉的瘤样扩张,此时认真观察周围是否存在与之相交通的管道样结构是鉴别的要点[14]。另外超声还可以观察肝脏形态、大小、回声,发现肝硬化、门静脉高压,对IPSVS的病因诊断有一定的帮助。
门-体静脉的分流使得血液中从肠道吸收的大量营养物质未经肝脏的代谢、转化直接进入肝静脉,肝脏的解毒功能未能充分发挥作用,随着病情的进展,大量未经肠肝循环的血液直接进入体循环,其中的有害物质会引起多脏器损害,出现多种并发症,肝性脑病是尤为严重并发症之一,是肝硬化失代偿期比较棘手的问题;出现肝肺综合征及肝肾综合征病例也偶有报道[15]。本组病例合并肝性脑病4例,究其原因考虑为地坛医院是以治疗肝病为主的国家传染病医学中心,肝病的诊治比较规范,本组病例多为肝病复诊病例,患者依从性好,定期复诊、复查,临床较早地进行了干预延缓或避免了肝性脑病的发生。除继发肝硬化或门静脉高压的IPSVS患者外,其他病因患者早期通常没有症状,但有出现肝性脑病的可能,因此提高超声医生的对本病的认识至关重要,早期正确诊断IPSVS,可以避免将患者错误地诊断为精神病或神经性疾病[16]。
由于局部门脉供血减少,肝动脉供血代偿增加及肝细胞的异常修复,易继发肝内局灶增生结节、腺瘤等肝内占位的发生,其中以前者最为常见。Pupulim 等[17]研究中有57%的病例继发肿瘤会增大或出现新增肿瘤,本组病例合并肝肿瘤患者占28%(11例),因此对于此类患者随访观察中应警惕肿瘤的发生及变化。对病灶较大者或肿瘤短期增大者,介入栓塞治疗使分流闭合是有效的治疗手段[18]。
综上所述,彩色多普勒超声因其能够敏感地发现肝内异常无回声,异常的分流通道,并依据血流方向、血流速度等加以甄别明确是否为IPSVS,可作为IPSVS首选的影像检查方法,是IPSVS早期诊断、早期干预治疗的有效手段。
