脑白质高信号与大脑中动脉供血区单发皮质下小梗死发生早期神经功能恶化的关系
2022-06-30丁意平黄双娇李达文盛世英
丁意平,黄双娇,李达文,盛世英
(常州市第一人民医院神经内科,江苏 常州 213000)
急性缺血性脑卒中(acute ischemic stroke,AIS)主要表现为部分脑组织突然失去血液供应,并伴有相应的神经功能缺损,如偏瘫和语言障碍等,发病率、死亡率和致残率高,给社会和家庭带来沉重的负担。皮质下小梗死以前称为“腔隙性卒中”,约占所有缺血性卒中的25%[1]。大脑中动脉供血区单发皮质下小梗死(SSSI)是指位于大脑半球深部白质,包括半卵圆中心、放射冠、基底节等部位的孤立性小梗死,直径通常小于20 mm[2]。皮质下小梗死通常会有相对轻微的神经功能缺损和良好的预后[3]。然而,其中一些患者在脑梗死早期症状持续加重,最终导致更严重的功能障碍,称为早期神经功能恶化(early neurological deterioration,END),其危险因素尚完全不清楚。本研究旨在探究大脑中动脉供血区SSSI 患者发生END 的临床及神经影像学因素,探讨WMH严重程度与END 的关系,以期能对SSSI 患者发生END 做出早期识别及治疗,现报道如下。
1 资料与方法
1.1 一般资料 回顾分析2020 年7 月-2021 年3 月于常州市第一人民医院神经内科住院的大脑中动脉供血区SSSI 患者213 例,其中男148 例,女65 例;年龄30~91 岁,平均年龄(65.57±12.08)岁。根据是否发生END 将患者分为END 组26 例,非END 组187例。纳入标准:①年龄≥18 岁;②急性起病(发病至就诊时间≤72 h);③突发局灶性神经功能缺损,脑梗死诊断标准按照《中国急性缺血性脑卒中诊治指南2018》;④头颅磁共振扩散加权成像(DWI)显示单发大脑中动脉供血区小梗死且梗死灶直径≤20 mm。排除标准:①心源性或其他原因及不明原因梗死;②皮质梗死及多发部位梗死;③有脑卒中病史且改良Rankin 量表评分≥2 分;④合并严重心功能、肝肾功能不全等;⑤因各种原因无法完善头颅MR 检查。
1.2 方法
1.2.1 资料收集 入院时记录患者的临床资料:年龄、性别、美国国立卫生研究院卒中量表(NIHSS)评分,既往史如高血压病、糖尿病、高血脂病、冠心病、既往脑卒中史、抗血小板聚集药物、他汀药物服用史、吸烟史、饮酒史等,入院时收缩压、舒张压;次日完善相关实验室检查,如血常规、生化检验,记录白细胞计数(WBC)、血红蛋白(Hb)、血小板(PLT)、胆固醇(TC)、甘油三脂(TG)、低密度脂蛋白(LDL)、空腹血糖、糖化血红蛋白、尿素(BNU)、肌酐(Scr)、尿酸(UA)、同型半胱氨酸(HCY)等;入院后48 h 内完善心电图、心脏彩超和头颅核磁共振检查。高血压病史定义为既往使用降压药或出院时收缩压>140 mmHg,或舒张压>90 mmHg[4];糖尿病史定义为既往使用降糖药或糖化血红蛋白≥6.5%[5];高脂血症定义为既往使用降脂药物、空腹低密度脂蛋白胆固醇≥160 mg/dl 或空腹总胆固醇≥240 mg/dl[6];吸烟史定义为吸烟≥6 个月,且≥10 支/d;饮酒定义为饮酒≥6 个月且乙醇摄入量≥30 g/d 或210 g/周[6]。一旦患者被送入卒中单元,根据卒中单元的治疗和诊断方案进行抗血栓治疗(包括单抗血小板或双重抗血小板治疗)、血压、血糖和血脂管理。使用NIHSS 表评估入院当天、7 d 内每天至少1 次及神经功能恶化时的NIHSS 评分;END定义为入院72 h 后运动NIHSS 评分增加≥1 分或NIHSS 总评分增加≥2 分[7]。
1.2.2 影像学评估 入院48 h 内进行头颅核磁共振检查,包括T1加权成像、T2加权成像、弥散加权成像、流体衰减反转恢复成像(FLAIR)、磁共振血管造影(MRA)及增强磁共振血管成像(CEMRA);脑梗死病灶大小评价:DWI 轴位显示的脑梗死灶最大层面的病灶直径为脑梗死面积[8],根据梗死灶的部位分为单发基底节区、丘脑、半卵圆中心、放射冠、侧脑室后角小梗死。动脉狭窄情况评价:CEMRA 评估颈内动脉、大脑中动脉粥样动脉硬化及血管狭窄程度,狭窄程度≥50%为血管狭窄;脑白质疏松程度评价[9]:根据T2加权成像及T2FLAIR 上的高信号表现,将WMH 分为脑室周围WMH(PVWMH)和深部脑白质WMH(SCWMH),用Fazekas 量表对白质高信号进行分级。脑室周围:0 分:无病变;1 分:帽状和铅笔样薄层病变;2 分:病变呈光滑的晕圈;3 分:不规则的脑室旁高信号,延伸到深部白质;深部白质:0 分:无病变;1 分:点状病变;2 分:病变开始融合;3 分:病变大面积融合;两者分别计分,相加计算总分;根据评分结果将WMH 分为3 个等级,包括:轻度WMH:总分1~2 分;中度WMH:总分3~4 分;重度WMH:总分5~6 分。陈旧腔隙性梗死定义[8]为皮层下圆形或类圆形、直径≥3 mm 的无症状病灶,在DWI 上呈低信号,在FLAIR 像周围上有高信号环绕。扩大的血管周围间隙(EPVS)[8]:包绕血管或沿着血管走行,边界清楚的圆形、卵圆形或线状、管状结构,直径通常<3 mm,在T1WI、T2WI 和FLAIR 上与脑脊液信号相同(T1WI 低信号,T2WI 高信号,FLAIR 低信号),无对比剂增强效应和占位效应,排除肿瘤及腔隙性梗死灶在内的其他病灶;根据Semiquantitative 量表,0 级:无EPVS;1 级:≤10 个EPVS;2 级:11~20 个EPVS;3 级:21~40 个EPVS;4 级:>40 个扩EPVS。所有影像学资料均由2 名神经科医师盲法评估,如有意见不统一,咨询第3 名上级医师评估后商议决定。
1.3 统计学方法 使用SPSS 24.0 软件分析。计量资料采用K-S 检验进行正态性检验,符合正态分布的计量资料以(±s)表示,采用独立样本t检验进行分析;不符合正态分布的计量资料以[M(P25~P75)]表示,采用Mann-WhitneyU检验分析;计数资料以[n(%)]表示,使用Pearsonχ2检验或连续校正χ2检验或Fisher 精确概率方法比较。以是否发生END 为因变量,将在单因素分析中P<0.05 的自变量纳入多变量Logistic回归分析中,建立二元Logistic 回归模型,探讨END的危险因素。P<0.05 表示差异有统计学意义。
2 结果
2.1 END 与非END 组临床及影像学资料比较 在213 例大脑中动脉供血区SSSI 患者中,SSSI 位于基底节区,包括内囊(n=121,56.81%),其次是放射冠区(n=33,15.49%)、丘脑(n=31,14.55%)、半卵圆中心(n=23,10.80%)和侧脑室后角(n=5,2.35%);入院72 h内,26 例患者(12.21%)发生了END:其中5 例(19.23%)恶化1 分,12 例(46.15%)恶化2 分,9 例(34.62%)恶化≥3 分,187 例患者(87.79%)没有发生END。两组年龄、既往脑梗死、糖尿病、高脂血症、冠心病史、吸烟史、饮酒史、抗血小板、他汀类药物服用史、入院NIHSS 评分、入院时舒张压、收缩压、WBC、LDL、TG、TC、UA、PLT、BUN、Scr、CRP、HCY、Hb、入院血糖及糖化血红蛋白比较,差异无统计学意义(P>0.05);END 组高血压病史、WMH 严重程度、侧脑室后角梗死比例均高于非END 组(P<0.05),见表1。

表1 END 组与非END 组临床及影像学资料比较[M(P25~P75),n(%)]
2.2 多因素Logistic 回归分析 将单因素分析中P<0.05 的变量为自变量纳入多因素Logistic 回归分析。结果表明,侧脑室后角梗死与END 独立相关(OR=14.535,95%CI=2.007~105.271;P=0.008);另以轻度WMH 为参照,中度WMH(OR=11.228,95%CI=3.341~33.733;P=0.000)与重度WMH(OR=7.030,95%CI=2.244~22.021;P=0.001)均与END 独立相关,见表2。在WMH 和END 事件之间的剂量效应分析中,更严重的PVWMH 或SCWMH 发生的END 的概率更大(P=0.007 和P=0.036),具体见图1。将PVWMH 和SCWMH 的Fazekas 评分相加,计算总分,分为轻、中、重度WMH 3 个等级;轻度WMH 97 例(45.54%),发生END 者有6 例(23.08%),无END 者有91 例(48.66%);中度WMH 组93 例(43.66%),发生END者11 例(42.31%),无END 者有82 例(43.85%);重度WMH 组23 例(10.80%):发生END 者9 例(34.62%),无END 者有14 例(7.49%),具体分布情况见图2。

表2 多因素Logistic 回归分析END 的危险因素
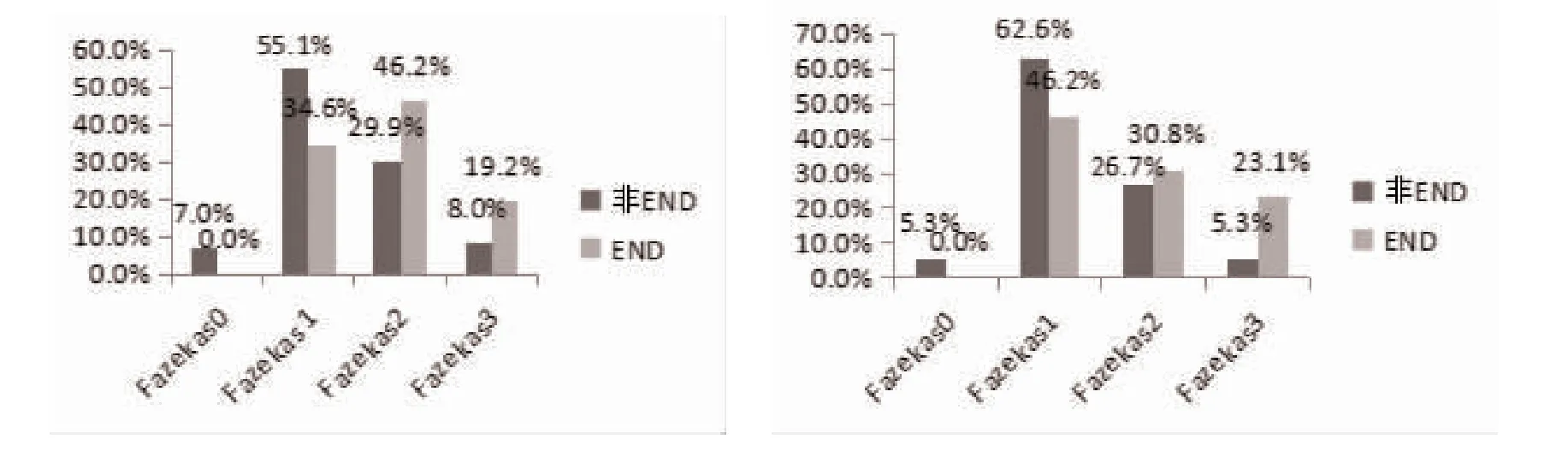
图1 PVWMH(A)和SCWMH(B)与END 事件之间的剂量效应分析
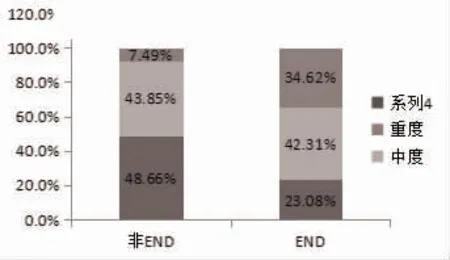
图2 非END 与END 组的WMH 严重程度分布情况
3 讨论
皮质下小梗死传统上称为腔隙性梗死或小血管闭塞,通常梗死体积较小,因此显示出相对有限的功能缺陷[9]。然而,研究表明住院期间20%~30%的SSSI 也会发生END[10,11],这阻碍了神经功能恢复。阐明SSSI 中END 的病理机制和潜在预测因素是有效应对神经功能缺损进展的第一步。本研究以急性大脑中动脉供血区SSSI 患者为研究对象,结果显示213 例患者中有26 例发生END,占总人数的12.21%;在单变量分析中,高血压病史、WMH 严重程度、侧脑室后角梗死都与END 相关,差异有统计学意义。然而,多变量分析表明,在控制其他混杂因素后,高血压病史与END 之间无显著的统计学关联。考虑到高血压病史与WMH 间的密切关系,高血压病史与END 之间的关联可能部分由WMH 介导。此外,与入院的基线血压相比,长期的高血压水平对END 更为重要。这表明慢性和长期血管损伤比急性期的血压波动更容易引起大脑中动脉供血区SSSI患者出现END。
WMH 是一种常见的放射学标志,指脑室周围白质和半卵圆中心对称性斑点状或片状病灶[12]。在急性缺血性卒中患者中,WMH 与梗死生长的易感性[13]和卒中预后不良相关[14]。研究表明[15],严重的WMH 与皮质下小梗死患者的神经功能恶化有关,该研究同时纳入了幕上及幕下皮质下小梗死患者。本研究只纳入了大脑中动脉供动脉血区单发皮质下小梗死患者,探讨END 的临床特征及WMH 对END的影响,结果发现中重度WMH 均为END 的独立危险因素。WMH 导致大脑中动脉供血区SSSI 的神经功能恶化的机制比较复杂,可能与下列因素相关:①WMH 是由受损的组织灌注导致的慢性缺血的标志物,随着血管密度和血流量的降低,脑组织更容易出现细胞功能受损,包括能量代谢和自我修复。与WMH 相关的血脑屏障功能障碍也会导致慢性毒性水肿,也可能加重急性缺血造成的组织损伤[16]。Ryu WS 等[14]的研究表明,WMH 负荷增加会导致WMH 相关的微循环改变,致使毛细血管无复流和血脑屏障损伤以及脑血流/侧支血流维持受损;因此,不良的侧支灌注可能导致严重WMH 患者的症状进展;②WMH 患者的慢性内皮功能障碍可以激活血管内凝血级联反应,导致血清凝血因子的分泌增加,严重WMH 患者中激活的凝血级联反应可能会产生微血栓,导致症状恶化[17];③严重WMH 可造成神经网络中断,卒中后神经功能恢复潜力小;且WMH 可以通过破坏对学习和神经康复很重要的运动/认知网络来影响卒中预后,以上均可以抑制脑卒中的康复[18]。
此外,本研究还分别评估了PVWMH、SCWMH和END 事件之间的剂量效应关系,发现更严重的PVWMH 和SCWMH 发生END 的概率更大,这种现象在PVWMH 中更为明显,这可能与皮质胆碱能通路有关。既往研究表明,PVWMH 可破坏皮质胆碱能通路的完整性[19]。而皮质胆碱能通路受损会通过血管舒缩系统、胆碱能受体等下调脑组织血流灌注及延缓损伤脑组织的修复[20];其次,运动下行纤维通过脑室周围白质,PVWMH 可破坏其纤维传导和阻碍功能恢复,而SCWMH 常常影响短联络纤维,因此导致不同部位WMH 造成卒中后的神经功能修复不同[21]。
此外,多因素分析也显示,相比其他部位(基底节区、丘脑、放射冠及半卵圆中心)梗死,侧脑室后角梗死更容易出现END,这与先前的报道一致。其机制可能是因为侧脑室后部由大脑中动脉深穿支供血,由于侧支循环少,所以脑组织一旦发生缺血梗死更容易进展加重;其次,皮质脊髓束运动纤维在侧脑室旁分布较密集,容易发生运动功能缺损加重。
综上所述,中重度WMH 和侧脑室后角梗死是单发大脑中动脉供血区小梗死发生END 的预测因素。但这项研究有几个局限性:首先,这是一项单中心回顾性研究,存在缺乏统计能力和过度拟合的可能性。尽管纠正了一些混杂因素,但不可避免地会出现入选患者的选择偏倚和某些临床情况下的回忆偏倚。其次,本研究样本量较小,还需要更大样本量、前瞻性或多中心研究进一步探讨单发大脑中动脉供血区皮质下小梗死出现神经功能恶化的发病机制。
