“洪氏一针法”胰管空肠吻合方式在腹腔镜胰十二指肠切除术中的运用
2022-06-30付裕王树鹏孟令宇刘亚辉
付裕 王树鹏 孟令宇 刘亚辉
吉林大学第一医院肝胆胰外二科,长春 130021
近些年,伴随着手术器械的更新及外科医师经验的逐步累积,腹腔镜胰十二指肠切除术(laparoscopic pancreaticoduodenectomy,LPD)在国内外较大的胰腺外科中心逐渐常规化开展。该术式涉及脏器多,术后并发症发生率30%~60%,病死率约5%,常见并发症有胰瘘、出血、胆瘘、腹腔感染、胃瘫等[1]。近年伴随着围术期管理水平的提高,LPD后死亡率明显下降,但术后胰瘘的发生率仍居高不下,约为20%[2],且可继发腹腔积液、感染、腹腔出血等,严重时危及生命。为了降低术后胰瘘发生率,胰肠吻合技术及理念不断革新。洪德飞等[3-5]提出“洪氏一针法”胰管空肠吻合方式,该吻合方式改变了传统的胰管对空肠黏膜吻合理念,使用胰液引流管充分引流胰液及引导空肠黏膜与胰管愈合,经过数年的推广,该吻合方式在国内已逐渐普及。本研究分析LPD后胰瘘发生的危险因素,同时比较“洪氏一针法”胰管空肠黏膜吻合与传统胰管空肠黏膜吻合方式在LPD后胰瘘发生率及胰肠吻合时间上的差异。
资料与方法
一、一般资料
回顾性分析2015年4月至2019年3月间吉林大学第一医院肝胆胰外二科同一手术团队完成的300例行LPD患者的临床资料,根据术后有无发生临床相关性胰瘘分为胰瘘组(43例)和非胰瘘组(257例)。210例使用“洪氏一针法”胰管空肠黏膜吻合方式,90例使用传统胰管空肠黏膜吻合方式。
二、胰肠吻合方法
1.“洪氏一针法”胰管空肠吻合术:首先根据胰管直径,选择合适的胰腺引流管,然后取一段约10 cm长的(带有2~4个侧孔,并剪成斜面)插入胰管内4~5 cm(图1A),再从腹侧进针,贯穿胰腺并穿过胰腺引流管后打结固定(图1B)。若胰腺引流管与胰管之间的空隙较大,可以再次经腹侧贯穿胰腺及引流管固定,尽可能消除胰管与胰腺引流管之间的空隙,以减少术后胰瘘发生率。使用4-Prolene线缝合胰腺背侧,并与空肠浆肌层连续缝合(图1C),在胰管对应空肠处使用电钩打一小孔,将胰腺引流管放入空肠远端,长度约4 cm左右(图1D),注意避免引流管打折、弯曲,影响胰液引流。然后在空肠小孔处行荷包缝合,固定胰腺引流管,封闭小孔。最后胰腺腹侧与空肠浆肌层间断缝合4~6针,完成胰管空肠吻合(图1E、1F)。
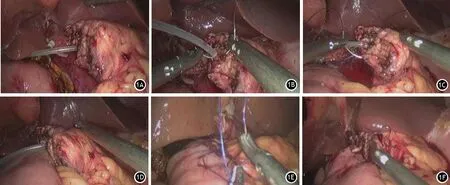
图1 “洪氏一针法”胰管空肠吻合术 1A 留置胰腺引流管;1B 固定胰腺引流管;1C 缝合胰腺后壁;1D 放置胰腺引流管于肠腔内;1E 缝合胰腺前壁;1F 完成胰管空肠吻合
2.传统胰管空肠吻合术:先使用3-0Prolene线缝合胰肠吻合后壁的胰腺残端与空肠浆肌层,然后将胰液引流管置入胰管,在与胰管相对应的空肠处使用电沟切开一小口,将胰液引流管置入空肠内。使用可吸收线间断缝合胰管与空肠黏膜。最后再用Prolene线缝合胰腺残端前壁与空肠浆肌层,完成胰肠吻合。
三、观察指标和评价标准
观察围术期指标,包括(1)术前一般情况:性别、年龄、体重指数(body mass index,BMI)、糖尿病病史、高血压病史、心血管疾病史、腹部手术史、术前胆红素水平等。(2)术中及术后情况:胰腺质地、胰管直径、手术标本切除时间、胰肠吻合时间及术后胰瘘情况等。
临床相关胰瘘的定义参考国际胰腺研究小组的标准[5],即术后≥3 d腹腔引流液中淀粉酶浓度高于正常血清淀粉酶浓度上限3倍及以上,并导致一系列临床并发症从而改变临床治疗方案或需要介入及手术治疗。
四、统计学处理

结 果
一、一般资料
300例患者中男性165例,女性135例,年龄(57±12)岁。上腹部手术史46例,合并糖尿病31例,高血压30例,心血管疾病24例。术前血胆红素≥170 μmol/L 101例,其中合并黄疸85例。术前行经皮经肝胆管引流(percutaneous transhepatic cholangial drainage,PTCD)8例,经皮经肝胆囊穿刺引流(percutaneoustranshepaticgallbladder-drainage,PTGD)75例,内镜鼻胆管引流(endoscopic nasobiliary drainage,ENBD )2例。美国麻醉医师协会(ASA)分级:Ⅰ级40例、Ⅱ级198例、Ⅲ级60例、Ⅳ级2例。术中触摸胰腺质地硬84例,标本切除时间(戳卡建立至标本切除)(87.38±18.42)min,胰肠吻合时间(29.02±6.92) min,胰管直径>3 mm 224例。术后出血23例(7.7%),胆瘘12例(4.0%),胰瘘43例(14.3%),其中B级胰瘘39例(13.0%),C级胰瘘4例(1.3%)。术后病理:胆管癌113例,胰腺癌45例,壶腹癌65例,十二指肠癌30例,其他疾病47例。
二、LPD后胰瘘发生的危险因素
单因素分析结果显示,患者BMI、既往有腹部手术史、胰腺质地软、胰管直径>3 mm与LPD后胰瘘发生相关(P值均<0.05,表1)。多因素logistic回归分析结果显示,BMI高、胰腺质地软为LPD后发生胰瘘的独立危险因素(表2)。
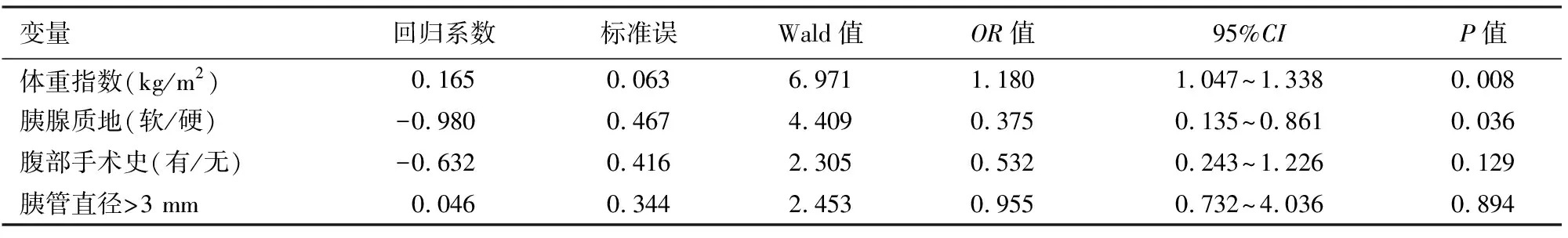
表2 腹腔镜胰十二指肠切除术后胰瘘发生的多因素分析
三、两种胰肠吻合方式比较
与传统的胰管空肠吻合方式相比,“洪氏一针法”胰管空肠吻合方式平均吻合时间短[(27.47±5.32) min比(32.66±7.23) min],术后胰瘘发生率低(13.81%比15.56%),但差异均无统计学意义(P值分别为0.702、0.317)。
讨 论
胰瘘是胰十二指肠切除术后的严重并发症,可导致腹腔积液,感染、出血及延迟性动脉瘤形成等[6],甚至危及生命。本研究对LPD后患者临床资料的单因素分析结果显示,腹部手术史、胰管直径、BMI、胰腺质地均与胰瘘发生相关;多因素分析结果显示,BMI高、胰腺质地软是LPD后胰瘘发生的独立危险因素,与Zhou等[7]、Chen等[8]、El Nakeeb等[9]的研究结果一致。这是由于患者的胰腺外分泌功能往往正常,而质软的胰腺会增加术中胰肠吻合的难度,更容易出现胰腺组织撕裂伤所致[10]。Lee等[11]及Mathur等[12]认为BMI高的患者往往伴随着胰腺的脂肪化,胰腺质地较软,术中胰肠吻合的操作难度较大。徐西伯等[13]认为,BMI较高的患者腹腔及胰腺周围脂肪组织较多,术中暴露胰腺比较困难,因此在术中分离时,胰腺被损伤的风险比较高。
笔者所在的吉林大学第一医院肝胆胰外科自2015年4月至2019年3月共完成300例LPD,术后发生胰瘘43例(14.3%),其中B级胰瘘39例,C级胰瘘4例,低于Akgul等[14]报告的结果。笔者认为,LPD后胰瘘发生原因可大致归为以下几个方面:(1)胰腺引流管与胰管之间或胰腺断端与空肠端存在较大的组织间隙;(2)围术期补液过多及患者存在营养障碍,造成组织水肿,黏连包裹差;(3)胰腺残端组织水肿并且缝合过密及缝线打结过紧,造成缝合线对组织的撕裂及缝合针数过多造成“针眼漏”[15];(4)胰肠吻合口之间存在较大张力及游离胰腺残端过多,破坏胰腺残端血供,影响组织愈合;(5)肠腔压力较高,造成消化液淤积,影响胰液通畅引流[16]。完美的胰肠吻合口可以减少术后胰瘘的发生,一般需要满足以下条件:(1)胰腺残端的血液供应充足;(2)胰液通畅流入肠腔或胃腔;(3)胰腺残端和空肠黏膜间缝合针数尽可能少,结扎松紧得当;(4)操作方便,容易学习[17-19];(5)尽可能消除吻合口之间的间隙。同时还需在围术期减少液体输入量及持续维持高水平蛋白,对胰瘘风险评分较低者应尽早拔出腹腔引流管。
行胰肠吻合术时,需要根据胰腺残端厚度及胰管直径选择合适的胰肠吻合方式。如胰腺较厚,与空肠直径无法理想匹配,强行使用套入式胰肠吻合可增加术后吻合口漏、出血等并发症的发生率。胰液的充分引流是避免胰瘘的关键因素,对于胰管较细的患者行胰管空肠黏膜吻合则可能出现吻合困难增加;吻合口狭窄,影响吻合的通畅性;胰管与空肠黏膜缝合时撕破。因此对于胰管较细的患者,可使用“洪氏一针法”建立胰腺引流管及人工窦道,既可以缩短胰肠吻合时间,也可以一定程度降低术后胰瘘的发生概率。胰腺引流管长度一般选择10 cm左右,置入胰管内4~5 cm,若<3 cm,则支架可能短期内脱落,若置入较长,可能会影响胰液的引流,有可能出现穿透胰尾及急性胰腺炎等并发症[20]。“洪氏一针法”吻合方式改变了胰管对空肠黏膜的吻合理念,且使用胰腺引流管可以充分引流胰液,并引导胰管与空肠黏膜的生长[21]。多中心研究显示,“洪氏一针法”在胰肠吻合中是安全有效的,操作简单便捷,并未增加胰瘘发生率[22]。
胰十二指肠切除术后减少胰瘘发生的关键为“包”和“引”。“包”则是网膜组织粘连及空肠端完全包裹胰腺断端,以减少胰瘘发生。“引”则是确保胰液引流通畅。胰肠吻合方式的选择应该基于充分引流,维持血供,操作简单,非线性切割等,并遵循“宽”、“稀”、“松”原则[23-24]。“宽”则需要边距较大,空肠尽可能覆盖胰腺残端,减少断端空隙,同时缝合时组织较多,避免组织撕裂。“稀”则针距大,减少胰腺组织破坏,防止破坏胰腺血供。“松”则尽可能打结松紧合适,避免缝线撕裂组织。只有遵守这些基本原则,方能减少胰瘘并发症。因此,临床工作中需要手术医师根据患者自身特点灵活选择个体化的胰肠吻合方式。
利益冲突所有作者声明无利益冲突
作者贡献声明付裕:研究操作 论文撰写、数据整理;王树鹏,孟令宇:研究操作、论文撰写、数据整理;刘亚辉:研究指导、论文修改、经费支持
