黄腐酸处理对塔罗科血橙成熟过程中花色苷和糖酸积累的影响
2022-06-29贺明阳喻最新姚世响王日葵周炼邓涂静洪敏
贺明阳,喻最新,姚世响,王日葵,周炼,邓涂静,洪敏*
1(西南大学 柑桔研究所,重庆,400712)2(中国农业科学院柑桔研究所,重庆,400712)3(中国科学院华南植物园植物资源保护 与可持续利用重点实验室,广东 广州,510650)4(西南大学 食品科学学院, 重庆,400715)
血橙(CitrussinensisL.Osbeck)属甜橙类,果肉含有红色血丝,肉质细嫩化渣,具有独特的玫瑰香气[1]。常见的血橙品种有塔罗科(Tarocco)、桑吉耐洛(Sanguinello)和摩洛(Moro)[2-3]。血橙是富含花色苷的柑橘[4],其较低的糖酸比使果实风味减弱[3]。花色苷是血橙中主要的抗氧化活性成分,能够清除自由基[5],还能预防肥胖症、糖尿病、癌症、抗炎症等[3,6],其含量是评价血橙商业价值的重要指标[7]。研究证明血橙花色苷的积累是冷调控过程[8],依赖较大昼夜温差,热带/亚热带气候下种植的血橙普遍着色不够,限制了血橙商业生产的地理种植[6]。目前柑橘产业发展迅速,消费市场对果实品质要求更高。因此,如何促进血橙增糖着色、提升果实鲜食品质,值得探究。
黄腐酸(fulvic acid, FA)是腐植酸中水、酸、碱都可溶的组分,含有羧基、酚羟基和醌基等活性基团[9],具有较强的络合、螯合和表面吸附能力,与氮磷钾等矿质元素互溶,分子质量小,渗透能力强,容易被植物吸收[10]。研究表明,FA能够促进植物生长[11]、提高作物抗逆性[12-13]、增加产量[9,11]、改善果实糖酸比和味感[12,14]。此外,FA对环境友好、人类健康安全[13],且有研究表明FA具有抗炎症、治疗糖尿病的功效[15]。目前,FA处理对血橙成熟过程中花色苷和糖酸积累变化的研究还鲜有报道。
本研究选用我国主要栽培的塔罗科血橙为试材,于果实转色期后(花后230 d)叶面喷施FA。运用HPLC和实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)技术探究血橙成熟过程中(花后230~324 d)果实花色苷和糖酸含量等品质指标变化及相关代谢基因的表达模式,为改善血橙品质提供理论依据。
1 材料与方法
1.1 材料与处理
试验于2016—2018年在重庆市璧山区绿跃血橙种植园进行,供试材料为30年生塔罗科血橙,开花时间为4月23日。预实验研究发现,花后230 d叶面喷施1 g/L FA(含FA质量分数为90%,上海通微生物技术有限公司)能明显改善血橙果实品质,且效果最佳。因此本研究选取树势一致、常规管理的血橙植株,于果实转色期后(花后230 d)叶面喷施1 g/L FA(为FA组),喷施清水为CK组。至果实完全成熟(花后324 d),期间每隔15 d左右取1次样。选取大小适中、无病虫害和机械损伤的果实,3棵树为1次重复,每次重复15个果子,设3次重复。采后当天运回实验室,部分样品取果肉用液氮速冻后于-80 ℃保存,部分样品榨汁后测定相关指标。
1.2 仪器与设备
H1850R台式高速冷冻离心机,长沙湘仪离心机仪器有限公司;TU-1901紫外分光光度计,北京普析通用仪器有限公司;高效液相色谱仪,美国安捷伦公司;CFX96TM实时荧光定量PCR仪,美国伯乐公司。
1.3 实验方法
1.3.1 光谱法测定血橙果汁总花色苷含量
血橙果汁总花色苷含量的测定选用光谱法[1]。血橙鲜果榨汁后10 000 r/min离心10 min。各取2 mL上清液,分别用缓冲液A(0.05 mol/L KCl、0.15 mol/L HCl,pH=1.0)和缓冲液B(0.4 mol/L CH3COONa、0.24 mol/L HCl,pH=4.5)稀释至10 mL。最后于510 nm和700 nm处分别测定吸光度值。结果计算如公式(1)所示:

(1)
式中:ΔA=(A510 nm-A700 nm)pH 1.0-(A510 nm-A700 nm)pH4.5;DF是稀释倍数;484.82是矢车菊素-3-葡萄糖苷分子质量;24 825是其摩尔吸光系数。
1.3.2 HPLC测定血橙果肉可溶性糖和有机酸含量
糖、酸的提取参考ZHANG等[16]和郑惠文等[17]的方法。称取3 g研磨成粉末的果肉样品,加入5 mL 80%(体积分数)冰乙醇。35 ℃水浴浸提20 min,室温5 000 r/min离心5 min后取上清液,重复抽提3次,合并上清液后定容至20 mL。取5 mL提取液,室温5 000 r/min离心5 min。然后取3 mL上清液在35 ℃下旋转蒸干,最后用1.5 mL双蒸水溶解,过0.22 μm 的滤膜。
色谱条件参考喻最新等[7]的方法。可溶性糖测定的色谱条件:色谱柱选用APS-2HYPERSIL柱(260 mm×4.6 mm,5 μm),柱温35 ℃,流动相为V(乙腈)∶V(水)=70∶30,流速为1.0 mL/min,进样量为10 μL,示差折光检测器(refractive index detector,RID)。抗坏血酸测定的色谱条件:色谱柱选用UMISILC18(2)柱(260 mm×4.6 mm,5 μm),柱温25 ℃,流动相为V(甲醇)∶V(0.1%磷酸)=1∶99,流速为0.8 mL/min,进样量为10 μL,检测波长为245 nm。柠檬酸、苹果酸测定的色谱条件:色谱柱选用Venusil MP C18柱(260 mm×4.6 mm,5 μm),柱温40 ℃,流动相为V(甲醇)∶V[0.05 mol/L KH2PO4溶液(pH 2.5)]=97∶3,流速1 mL/min,检测波长为210 nm,进样量为20 μL。
总糖、总酸含量为各组分含量之和。
1.3.3 血橙果肉总RNA提取及cDNA合成
果肉总RNA提取参考天根植物多糖多酚总RNA提取试剂盒(DP441型)的产品说明,然后经Tiangen FastKing RT Kit (with gDNase)(KR116型)试剂盒反转录成cDNA,-20 ℃保存备用。
1.3.4 qRT-PCR测定基因表达水平
血橙花色苷及糖酸代谢相关基因引物序列分别参考CARMONA等[6]和LIU等[18],内参基因选用EF-1α[8](Accession No.XM_015533332)。参照宝生物SYBR®PremixExTaqTMII的说明操作,在实时荧光定量PCR仪上反应。反应体系如下:10 μL SYBR Green I mix,0.8 μL正向引物,0.8 μL反向引物,1.5 μL cDNA模板,6.9 μL ddH2O。操作程序如下:95 ℃、30 s;95 ℃、5 s,58 ℃、30 s,经40个循环反应。融解曲线绘制:95 ℃、10 s,降温到65 ℃后开始以0.5 ℃每步升温,并维持5 s采集荧光信号,反应至95 ℃结束。每个样品3次重复。采用2-ΔΔct法进行相对定量分析。
1.3.5 数据处理
选用Microsoft Excel 2007进行数据处理,并执行单因素方差分析(P<0.05),选用Origin 9绘图。
2 结果与分析
2.1 FA处理对血橙果汁总花色苷含量及果实着色的影响
由图1可知,血橙成熟过程中,FA处理组花色苷含量始终显著高于CK组。花后324 d,FA组花色苷含量为48.92 mg/L,比CK组提高了153.7%。结果表明,花后230 d叶面喷施FA能显著促进血橙果实花色苷积累。花色苷属黄酮类化合物[7]。XU等[13]发现FA处理对葡萄苯丙烷代谢相关酶活性以及终产物的积累具有诱导作用,能够提高鲜食葡萄总黄酮含量。
由图2可知,花后230~324 d,FA组和CK组果实的果肉以及果汁颜色均越来越深。花后230 d,FA组和CK组果肉均未着红色。花后243 d,FA组开始出现红血丝,CK组仍未着红色。花后261~324 d,FA组和CK组果肉均含有红血丝,果汁颜色越来越红,且FA组血橙果肉和果汁颜色明显比CK组红。花色苷含量变化与血橙果肉以及果汁颜色的变化进程基本一致。

图1 黄腐酸处理对血橙成熟过程中果汁花色苷含量的影响Fig.1 Effects of preharvest application of fulvic acid on anthocyanin content in maturing Tarocco blood oranges注:*表示同一时期2组果实在P<0.05水平上存在显著差异(下同)
2.2 FA处理对血橙花色苷合成相关结构基因表达水平的影响
血橙花色苷代谢途径已阐明[6,19]。莽草酸途径连接糖代谢与次生代谢,糖酵解途径产生的磷酸烯醇式丙酮酸和戊糖磷酸途径产生的赤藓糖-4-磷酸进入莽草酸途径生成苯丙氨酸[20]。苯丙氨酸作为最直接的前体物质,经苯丙氨酸解氨酶(phenylalanine ammonia-lyase, PAL)、肉桂酸4-羟化酶(cinnamate 4-hydroxylase, C4H)、CoA连接酶(4-hydroxy-cynnamoyl CoA ligase, 4CL)、查尔酮合成酶(chalcone synthase, CHS)、查尔酮异构酶(chalcone isomerize, CHI)、黄酮醇3-羟化酶(flavonone 3-hydroxylase, F3H)、类黄酮3-羟化酶(flavonoid 3′-hydroxylase, F3′H)、类黄酮3,5-羟化酶(flavonoid 3′5′-hydroxylase, F3′5′H)等催化生成二氢黄酮醇。二氢黄酮醇可经黄酮醇合成酶(flavonol synthase, FLS)催化形成黄酮醇,或是在二氢黄酮醇4-还原酶(dihydroflavonol 4-reductase, DFR)催化下生成无色花青素。无色花青素经花青素合成酶(anthocyanin synthase, ANS)及糖基转移酶(UDP-glucose-flavonoid 3-O-glucosyltransferase, UFGT)作用生成稳定的花色苷,最后经谷胱甘肽转移酶(glutathione-S-transferases, GST)转至液泡储存。
由图3可知,血橙成熟过程中FA组和CK组的12个基因表达水平基本呈现先上升后下降的趋势,该结果与喻最新等[7]研究一致。FA处理后,4CL表达量在花后261、276、293、324 d显著上调,分别为CK组的1.84、1.49、1.74、3.65倍;CHS表达量在花后243、261、293、324 d显著上调,分别为CK组的1.58、1.29、2.17、1.66倍;DFR表达量在花后243、276、309、324 d显著上调,分别为CK组的1.59、1.55、1.46、2.30倍;ANS表达量在花后243、261 d显著上调,分别为CK组的1.80、2.55倍;UFGT表达量在花后243、261、324 d显著上调,分别为CK组的1.68、2.21、2.10倍;GST表达量在花后243、261、276、324 d显著上调,分别为CK组的2.82、3.64、2.09、1.96倍;且这些基因在其他时期与CK组表达丰度基本一致。综合分析认为,花后230 d叶面喷施FA能够激活4CL、CHS、DFR、ANS、UFGT、GST的表达,认为这些基因是FA调控血橙花色苷合成的关键结构基因。另外,FA处理诱导F3′5′H、ANS、GST及UFGT的表达峰值提前了32 d,F3H的表达峰值提前了15 d。XU等[13]研究发现FA处理显著诱导了葡萄果皮中PAL、C4H、4CL、CHS表达的上调,研究结果与本研究结果相互印证。
二氢黄酮醇的转化是类黄酮代谢途径中的一个重要节点[7]。本研究发现血橙成熟过程中FA组DFR与FLS表达水平的比值始终高于CK组,表明FA处理使血橙类黄酮代谢途径朝着无色花青素方向进行,且随着ANS、UFGT及GST表达水平显著上调,促进了无色花青素合成稳定的花色苷。该结果与低温对血橙花色苷的调控机制相似[6]。

A~L-基因分别为PAL、C4H、4CL、CHS、CHI、F3H、F3′5′H、FLS、DFR、ANS、UFGT、GST图3 黄腐酸处理对血橙成熟过程中花色苷合成相关结构基因表达水平的影响Fig.3 Effects of preharvest application of fulvic acid on transcription levels of anthocyanins biosynthesis related structural genes in maturing Tarocco blood oranges
2.3 FA处理对血橙果肉可溶性糖含量的影响
糖是柑橘果实品质最主要的指标之一,柑橘果实主要积累蔗糖、果糖和葡萄糖等可溶性糖。由图4可知,花后230 d,蔗糖、果糖和葡萄糖含量比例约为2∶1∶1,龚荣高等[21]在甜橙果实膨大后期也发现该结果。花后324 d,FA组总糖、果糖、葡萄糖、蔗糖质量分数分别为75.33、20.87、20.22、33.84 mg/g,比CK组分别提高了10.2%、15.1%、14.5%、6.7%。花后261 d,FA组总糖、蔗糖、果糖、葡萄糖含量虽高于CK组,但无显著差异。花后243、276、293、309、324 d,FA组总糖、蔗糖、果糖、葡萄糖含量均显著高于CK组,表明FA处理显著提高了血橙成熟过程中可溶性糖含量。彭玲等[9]和张玲[12]在苹果果树中施用FA后也发现果实中有相似结果。另外,整个血橙成熟过程中果糖、葡萄糖积累变化量明显高于蔗糖,表明蔗糖在合成的同时也在分解[22]。可溶性糖是反应甜度的适宜指标,其含量增加可提升血橙甜度和口感[23]。
2.4 FA处理对血橙蔗糖代谢相关基因表达水平的影响
蔗糖代谢是柑橘糖积累的重要过程[21],主要由蔗糖合成酶(sucrose synthase, SS)、蔗糖磷酸合成酶(sucrose phosphate synthase, SPS)和酸性转化酶(acid invertase, AI)等关键酶催化[18]。蔗糖合成与分解受SS可逆调控[21]。蔗糖经转化酶催化水解生成果糖和葡萄糖的反应不可逆[22]。由图5可知,花后243、261、276、293、324 d,FA组AI表达量显著高于CK组。FA处理对血橙成熟过程中SS、SPS的表达水平无明显促进作用,而蔗糖含量却显著增加。邱文伟等[24]发现除了糖代谢酶的成分与活力外,韧皮部后运输是叶源光合同化产物进入汁囊的限速阶段,跨膜运输是果实细胞糖分积累的控制点。综合分析认为,FA处理可能通过激活AI表达来加快蔗糖水解,产生的蔗糖浓度梯度为蔗糖跨膜运输提供了动力[25],加快了韧皮部后运输速率及跨膜运输能力,以此来增加果实细胞中可溶性糖总量的积累。
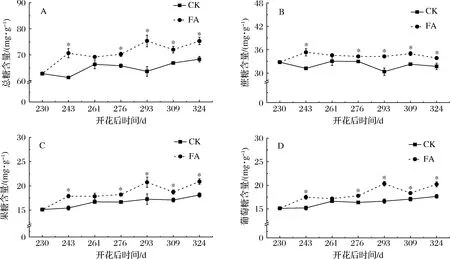
A-总糖;B-蔗糖;C-果糖;D-葡萄糖图4 黄腐酸处理对血橙成熟过程中可溶性糖含量的影响Fig.4 Effects of preharvest application of fulvic acid on soluble sugar content in maturing Tarocco blood oranges

A~E-基因分别为AI、SS1、SS2、SPS1、SPS2图5 黄腐酸处理对血橙成熟过程中蔗糖代谢相关基因表达水平的影响Fig.5 Effects of preharvest application of fulvic acid on transcription levels of sucrose metabolism related genes in maturing Tarocco blood oranges
2.5 FA处理对血橙果肉有机酸含量的影响
由图6可知,血橙成熟过程中,FA组和CK组果实总酸、柠檬酸、抗坏血酸、苹果酸含量基本呈下调趋势,且2组果实总酸、柠檬酸含量无显著差异。YAO等[26]也发现果实成熟后期柠檬酸含量降低,可能与参与三羧酸(tricarboxylic acid,TCA)循环为细胞供能、氨基酸代谢[26]以及γ-氨基丁酸(γ-aminobutyric acid,GABA)支路[27]等有关。花后276、324 d,FA组抗坏血酸含量显著高于CK组,其他时期无显著差异。花后324 d,FA组苹果酸含量显著高于CK组,其他时期无显著差异。由于柠檬酸是柑橘中主要的有机酸,所以认为FA处理对血橙成熟过程中有机酸含量的影响不显著。

A-总酸;B-柠檬酸;C-苹果酸;D-抗坏血酸图6 黄腐酸处理对血橙成熟过程中有机酸含量的影响Fig.6 Effects of preharvest application of fulvic acid on organic acid content in maturing Tarocco blood oranges
2.6 FA处理对血橙柠檬酸代谢相关基因表达水平的影响
柠檬酸是柑橘中主要的有机酸,由乙酰辅酶A与草酰乙酸在线粒体柠檬酸合成酶(citrate synthase,CS)的催化下缩合合成,通过TCA循环催化,主要储存在液泡中[28-29]。柠檬酸的降解主要由乌头酸酶(aconitase,AC)、异柠檬酸脱氢酶(isocitrate dehydrogenase,IDH)等催化[28]。由图7可知,在花后243~261 d,FA处理抑制了CS、AC表达,在花后309 d,FA诱导CS、AC表达上调。FA组IDH表达量在花后243、261、293 d显著低于CK组,在花后324 d,FA组IDH表达量显著高于CK组。总的来说,FA处理后CS、AC、IDH调控柠檬酸积累的作用不大。

A~C-基因分别为CS、AC、IDH′图7 黄腐酸处理对血橙成熟过程中柠檬酸代谢相关基因表达水平的影响Fig.7 Effects of preharvest application of fulvic acid on transcription levels of citric acid metabolism related genes in maturing Tarocco blood oranges
3 结论
本研究通过转色期后(花后230 d)叶面喷施FA,显著提高了血橙成熟过程中总糖、果糖、葡萄糖、蔗糖的含量,可溶性糖积累与AI表达水平相关。FA处理对总酸、柠檬酸、苹果酸、抗坏血酸含量的影响不显著,CS、AC、IDH调控柠檬酸积累的作用不大。糖是评价柑橘果实风味和整体品质的重要指标,也是合成花色苷的原料[19],不仅通过糖酵解连接莽草酸途径来影响花色苷代谢[20],还作为信号分子调控花色苷合成相关基因的表达[7]。因此,FA可能通过提高血橙果实中的蔗糖、葡萄糖、果糖含量使总糖含量增大,进而使果实中合成花色苷的底物增多,或是通过提高血橙中可溶性糖的含量激活了花色苷合成相关的信号转导途径,诱导4CL、CHS、DFR、ANS、UFGT、GST表达上调从而使血橙中花色苷含量增加。
总之,叶面喷施FA提高了血橙成熟过程中花色苷和糖的积累,促进血橙增糖着色,对酸积累也无不利影响,其中AI、4CL、CHS、DFR、ANS、UFGT、GST是调控花色苷和糖积累的关键基因。本研究阐释了FA对血橙成熟过程中花色苷和糖酸积累的影响及相关代谢基因的表达特征,为进一步改善血橙品质提供理论依据。
