LncRNA KCNQ1OT1 降表达对顺铂耐药卵巢癌细胞耐药性的影响及其作用机制
2022-06-29沈艳丽冯文广杨静伊婷易金玲
沈艳丽,冯文广,杨静,伊婷,易金玲
新疆医科大学第五附属医院妇科,乌鲁木齐 830011
目前,卵巢癌是病死率位居前列的妇科恶性肿瘤,其治疗方案以手术、化疗、放疗等综合治疗为主[1]。但在化疗过程中相当多的患者由于卵巢癌细胞耐药而导致化疗失败,增强肿瘤细胞对化疗药物的敏感性是提高卵巢癌治疗效果的有效途径[2]。肿瘤耐药为多因素参与的对肿瘤药物的抵抗,包括减少凋亡、增加修复DNA 损伤、减少摄取水溶性药物、改变药物的代谢等[3]。长链非编码RNA(LncRNA)是一类长度大于200 nt 的非编码RNA,越来越多的研究发现其在机体正常的生长发育以及疾病发展等多种生物学过程中发挥重要调控作用。LncRNA KCNQ1OT1 位于人类染色体11p15.5,研究显示其与肺癌的增殖和耐药有关[4-5]。哺乳动物雷帕霉素靶蛋白(mTOR)是一种非典型的丝氨酸/苏氨酸蛋白激酶,可介导多种蛋白如缺氧诱导因子(HIF-1α)等的产生[6],而蛋白激酶B(AKT)是其上游调控关键蛋白。AKT/mTOR 信号通路与人类多种肿瘤密切相关,在肿瘤细胞增殖、凋亡、血管发生、转移及放化疗抵抗中均发挥重要作用[7]。2020年3月—2021年3月,为了进一步了解卵巢癌细胞顺铂(DDP)耐药的相关机制,本研究观察分析KCNQ1OT1 调控AKT/mTOR 信号通路对卵巢癌细胞顺铂耐药的影响。现报告如下。
1 材料与方法
1.1 主要材料 实验细胞:SKOV-3 人卵巢癌细胞来源于普诺赛生物,细胞培养条件为McCoy′s 5A+10%胎牛血清(FBS)+1%PS,37 ℃,5% CO2,饱和湿度。主要试剂与耗材:FBS(Excell Bio,FND500);McCoy′s 5A 培养基(GIBCO,16600-082);0.25%胰酶(GIBCO,25200-056);PBS 粉剂(北京中杉金桥生物,ZLI-9062);10 000 U 青霉素—链霉素双抗(GIBCO,15070-063);DMSO(Sigma,D2650);CCK-8 细胞增殖/毒性检测试剂盒(全式金生物,FC101-04);DDP(Sigma,P4394);25 cm2培 养 瓶(Corning,430639);96 孔板(Corning,3599);KCNQ1OT1-si RNA 及NC-siRNA(苏州吉玛基因);p-AKT(兔多克隆抗体,abcam,ab8805);p-mTOR(兔单克隆抗体,abcam,ab109268)。主要仪器:CO2细胞培养箱(上海力康仪器,Smart Cell HF-90);生物安全柜(上海力康仪器,HF1200LC);台式低速离心机(上海飞鸽仪器,DK-80);恒温水浴锅(上海精宏仪器;TGL-16GB);荧光倒置显微镜(日本尼康,Eclipse TS100-F);-20 ℃低温冰箱(合肥美菱,BCD-249LCK);-80 ℃低温冰箱(合肥美菱,DW-HL388);手动单道移液器(Eppendorf,Research plus)。
1.2 实验方法
1.2.1 细胞的复苏与传代 细胞复苏:从液氮罐中取出冻存的细胞,将其立即置于37 ℃水浴中快速摇晃的冻存管,使细胞在2 min 内快速解冻;将解冻后的细胞快速加入放有完全培养基的离心管内,离心后弃去上清;将细胞接种于培养瓶中,37 ℃、5%CO2培养箱内培养。细胞传代:当细胞融合至80%左右时,弃去瓶中的培养基,加入3 mL 无菌PBS 缓冲液冲洗2 遍;弃去PBS 后加入1 mL 0.25%胰蛋白酶,轻摇培养瓶,消化1 min 后加入1 mL 完全培养基终止消化;用吸头反复冲洗培养瓶,将脱落的细胞转移至15 mL 离心管中,离心5 min 后弃去液体;用2 mL完全培养基重悬沉淀细胞,计数细胞并调整细胞密度1×105/mL;将其接种于培养瓶中培养,37 ℃、5%CO2培养箱内培养。
1.2.2 卵巢癌DDP 耐药细胞株构建 取对数生长期的SKOV-3 细胞,当细胞融合达70%左右时,在培养基中加入0.1 μg/mL DDP 培养48 h;弃去含药培养基,用不含药培养基继续培养;待细胞生长融合至90%,使用上述步骤重复诱导2 次。待细胞长满传代后,使用小剂量(0.1 μg/mL)到高剂量(0.5 μg/mL)浓度递增干预。其间使用不同浓度DDP诱导阶段计算耐药指数(RI),当RI≥4 时,则认为耐药细胞株建立成功。CCK-8 检测 SKOV-3、SKOV-3/DDP 耐药株50%细胞生长的药物浓度(IC50)并计算RI:取对数生长期的SKOV3、SKOV3/DDP 细胞,用完全培养基将其制备成5×104/mL 单细胞悬液;将其接种至96 孔板中,每孔 100 μL。培养 24 h 待细胞贴壁后弃去培养基,并加入不同浓度(0.25、0.50、1.00、2.00、4.00、8.00 μg/mL)DDP溶液,每个浓度设5个复孔,同时设空白孔;继续培养72 h后弃去培养基,每孔加入CCK-8 溶液100 μL,置于37 ℃孵箱内1 h;用酶标仪检测各孔在450 nm 波长处的OD 值,计算IC50及RI。细胞增殖抑制率(%)=[(OD对照孔-OD实验孔)/OD对照孔]×100%。RI=耐药细胞系的IC50/敏感细胞系的IC50。
1.2.3 SKOV3、SKOV3/DDP 细胞 KCNQ1OT1 表达检测 采用qRT-PCR 法。用TRIzol 法提取SKOV-3、SKOV-3/DDP细胞总RNA,检测其浓度和纯度后,应用MMLV 反转录试剂盒将RNA 反转录为cDNA。以cDNA 为模板,应用qRT-PCR 法检测SKOV-3、SKOV-3/DDP 细胞KCNQ1OT1 表达,引物由上海生工生物工程有限公司合成。引物序列:KCNQ1OT1上游为 5′-CTTTGCAGCAACCTCCTGT-3′,下游为5′-TGGGGTGAGGGATCTGAA-3′;GAPDH 上游为5′-GAGTCAACGGATTTGGTCGT-3′,下 游 为 5′-TTGATTTTGGAGGATCTCG-3′。 PCR 反 应 条 件 :95 ℃ 10 min,95 ℃ 15 s、60 ℃ 60 s,共完成 45 个循环 。 以 GAPDH 作 为 内 参 ,使 用 2-△△Ct法 计 算KCNQ1OT1相对表达量。
1.2.4 SKOV3/DDP 细胞分组与 KCNQ1OT1 降表达转染 取对数生长期的SKOV-3/DDP 细胞,常规培养后接种于6孔板;待细胞融合至约70%时,将细胞分为KCNQ1OT1 降表达组、转染对照组和对照组,KCNQ1OT1 降表达组、转染对照组参照Lipofectamine 2000 说明书进行转染。KCNQ1OT1 降表达组细胞转染KCNQ1OT1-siRNA,转染对照组细胞转染NC-siRNA,对照组正常培养不转染。转染5 h后更换为新鲜培养基,继续培养48 h 后收集各组细胞。采用qRT-PCR 法检测KCNQ1OT1,方法同“1.2.3”,观察降表达效果。
1.2.5 KCNQ1OT1 降表达的 SKOV3/DDP 细胞耐药性观察 收集转染48 h 后的各组细胞,并加入不同浓度(0.25、0.50、1.00、2.00、4.00、8.00 μg/mL)DDP 溶液,每个浓度设5 个复孔,同时设空白孔;继续培养72 h 后弃去培养基,采用CCK-8 法检测DDP对各组细胞增殖情况,并计算增殖抑制率、IC50及RI,方法同“1.2.2”。
1.2.6 KCNQ1OT1降表达的SKOV3/DDP细胞周期检测 收集“1.2.4”转染48 h后的各组细胞,加入预冷的70%乙醇溶液,在-20 ℃下孵育2 h。弃去上清后,分别加入5 μg/mL的RNase 0.1 mL、50 μg/mL 的碘化丙啶(PI)0.5 mL,放置于37 ℃环境下避光反应30 min,采用流式细胞仪检测各组细胞的细胞周期。
1.2.7 KCNQ1OT1 降 表 达 的 SKOV3/DDP 细 胞AKT/mTOR 信号通路活性检测 采用Western blotting 法。收集“1.2.4”转染 48 h 后的各组细胞,加入100 μL RIPA 及 1 μL PMSF 裂解细胞并提取细胞总蛋白;采用BCA 法检测蛋白浓度,并根据蛋白浓度取样、加热变性后进行SDS-PAGE 电泳;电泳后转移至PVDF 膜,使用5% 脱脂奶粉封闭2 h;加入p-AKT、p-mTOR 抗体 4 ℃孵育过夜,使用 TBST 洗涤3 次;加入相应的辣根过氧化物酶标记的二抗室温下孵育1 h,TBST 洗涤3 次后加入发光液;使用凝胶成像仪拍照并进行灰度分析,以目的蛋白与β-actin灰度比值表示p-AKT、p-mTOR相对表达量。
1.3 统计学方法 采用SPSS25.0 统计软件。计量资料采用Kolmogorov-Smirnov 检验法进行正态分布检验,正态分布以表示,多组比较行单因素方差分析,重复测量数据行重复测量的方差分析;非正态分布以中位数(四分位数间距)表示,采用非参数检验。P<0.05为差异有统计学意义。
2 结果
2.1 卵巢癌DDP 耐药细胞株构建结果 由表1 可见,随着 DDP 浓度增加,SKOV-3 及 SKOV-3/DDP 细胞增殖抑制率均升高(P均<0.05);在相同DDP浓度下,SKOV-3/DDP细胞增殖抑制率低于SKOV-3细胞增殖抑制率(P均<0.05);DDP 对 SKOV-3 细胞 IC50为 1.224 μg/mL,DDP 对 SKOV-3/DDP 细胞 IC50为4.920 μg/mL,RI 为 4.020,成功构建卵巢癌 DDP 耐药细胞株。
表1 不同浓度DDP作用下SKOV3、SKOV3/DDP细胞增殖情况比较(,n=6)
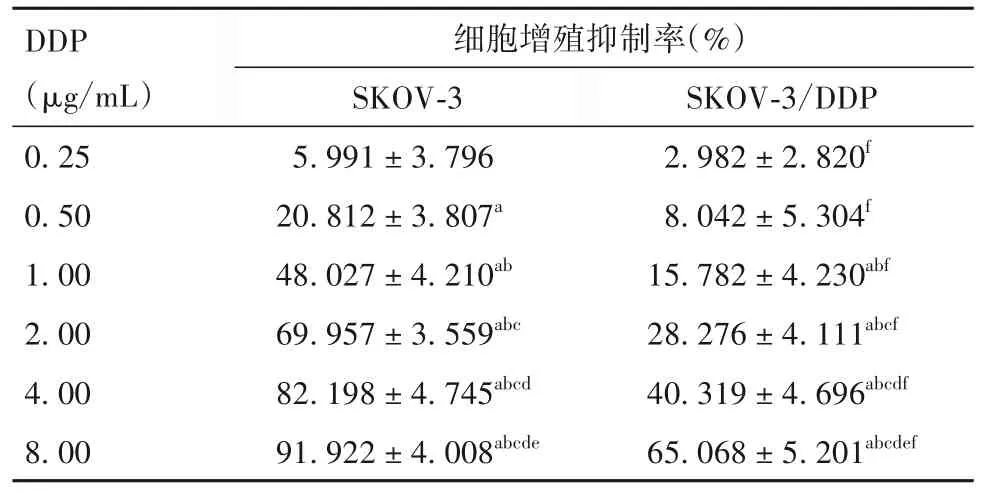
表1 不同浓度DDP作用下SKOV3、SKOV3/DDP细胞增殖情况比较(,n=6)
注:与 0.25 μg/mL DDP 比较,aP<0.05;与 0.50 μg/mL DDP 比较,bP<0.05;与1.00 μg/mL DDP比较,cP<0.05;与2.00 μg/mL DDP比较,dP<0.05;与4.00 μg/mL DDP 比较,eP<0.05;与DDP 同浓度作用的SKOV-3细胞比较,fP<0.05。
SKOV-3/DDP 2.982±2.820f 8.042±5.304f 15.782±4.230abf 28.276±4.111abcf 40.319±4.696abcdf 65.068±5.201abcdef DDP(μg/mL)0.25 0.50 1.00 2.00 4.00 8.00细胞增殖抑制率(%)SKOV-3 5.991±3.796 20.812±3.807a 48.027±4.210ab 69.957±3.559abc 82.198±4.745abcd 91.922±4.008abcde
2.2 SKOV-3、SKOV-3/DDP 细胞 KCNQ1OT1 表达比较 SKOV-3/DDP细胞KCNQ1OT1相对表达量为2.482 ± 0.405,高于 SKOV-3 细胞的 1.088 ± 0.241(P<0.05)。
2.3 各组SKOV-3/DDP 细胞KCNQ1OT1 表达比较 KCNQ1OT1 降表达组细胞中KCNQ1OT1 相对表达量为0.428 ± 0.157,低于转染对照组的1.024± 0.305 及对照组的 0.978 ± 0.215(P均<0.05),转染对照组与对照组间差异无统计学意义。
2.4 各组SKOV-3/DDP 细胞耐药性比较 由表2可见,随DDP 浓度增加,各组细胞增殖抑制率均升高(P均<0.05);在相同DDP 浓度下,KCNQ1OT1 降表达组细胞增殖抑制率均高于转染对照组和对照组(P均<0.05)。DDP对KCNQ1OT1降表达组细胞IC50为 3.613 μg/mL,RI 为 0.734;DDP 对转染对照组、对照组细胞 IC50分别为 9.737、8.461 μg/mL,RI 分别为1.979、1.720。
表2 不同浓度DDP作用下各组SKOV-3/DDP细胞细胞增殖情况比较(,n=6)
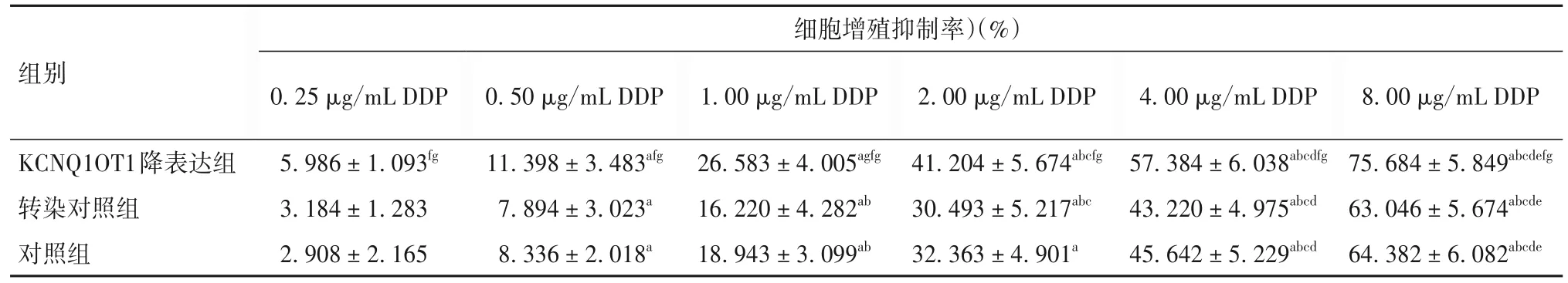
表2 不同浓度DDP作用下各组SKOV-3/DDP细胞细胞增殖情况比较(,n=6)
注:与0.25 μg/ML DDP 比较,aP<0.05;与0.50 μg/mL DDP 比较,bP<0.05;与1.00 μg/mL DDP 比较,cP<0.05;与2.00 μg/mL DDP 比较,dP<0.05;与4.00 μg/mL DDP比较,eP<0.05;与同浓度转染对照组比较,fP<0.05;与同浓度对照组比较,gP<0.05。
细胞增殖抑制率)(%)8.00 μg/mL DDP 75.684±5.849abcdefg 63.046±5.674abcde 64.382±6.082abcde组别2.00 μg/mL DDP 41.204±5.674abcfg 30.493±5.217abc 32.363±4.901a 0.25 μg/mL DDP 5.986±1.093fg 3.184±1.283 2.908±2.165 0.50 μg/mL DDP 11.398±3.483afg 7.894±3.023a 8.336±2.018a 1.00 μg/mL DDP 26.583±4.005agfg 16.220±4.282ab 18.943±3.099ab 4.00 μg/mL DDP 57.384±6.038abcdfg 43.220±4.975abcd 45.642±5.229abcd KCNQ1OT1降表达组转染对照组对照组
2.5 各组SKOV-3/DDP细胞周期分布比较 见表3。
表3 各组SKOV-3/DDP细胞周期分布比较(,n=6)
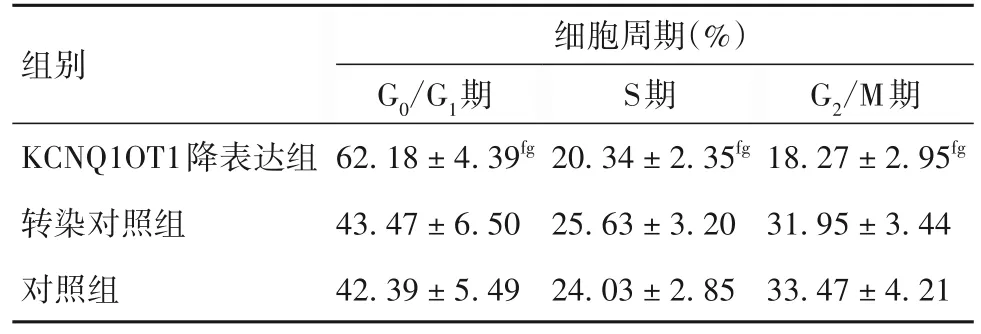
表3 各组SKOV-3/DDP细胞周期分布比较(,n=6)
注:与同浓度转染对照组比较,fP<0.05;与同浓度对照组比较,gP<0.05。
G2/M期18.27±2.95fg 31.95±3.44 33.47±4.21组别KCNQ1OT1降表达组转染对照组对照组细胞周期(%)G0/G1期62.18±4.39fg 43.47±6.50 42.39±5.49 S期20.34±2.35fg 25.63±3.20 24.03±2.85
2.6 各组 SKOV-3/DDP 细胞 p-AKT、p-mTOR 蛋白表达比较 见表4。
表4 各组SKOV-3/DDP细胞p-AKT、p-mTOR蛋白表达比较(,n=6)
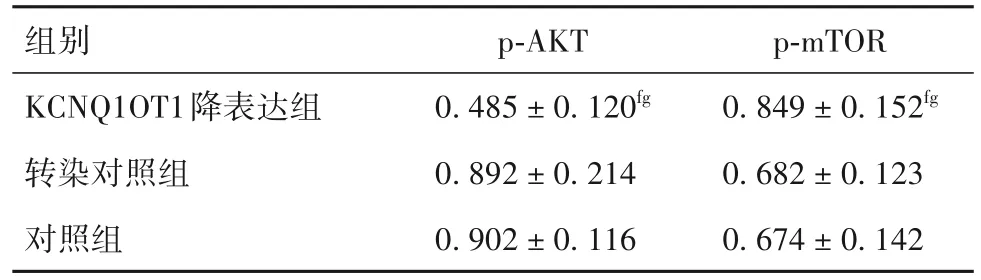
表4 各组SKOV-3/DDP细胞p-AKT、p-mTOR蛋白表达比较(,n=6)
注:与同浓度转染对照组比较,fP<0.05;与同浓度对照组比较,gP<0.05。
组别KCNQ1OT1降表达组转染对照组对照组p-AKT 0.485±0.120fg 0.892±0.214 0.902±0.116 p-mTOR 0.849±0.152fg 0.682±0.123 0.674±0.142
3 讨论
由于卵巢癌在化疗过程中极易出现耐药,常导致治疗进入瓶颈。因此,研究卵巢癌耐药的分子机制及其逆转耐药的方式,已成为当前妇产科领域亟需攻克的难题之一。
目前,在人类基因中包含的具有编码蛋白质功能的基因约为20 000 个,仅占人类整个基因组的1.5%左右[8],而其余的基因被称为非编码RNA。随着研究的不断深入,发现无论LncRNA 还是短链非编码RNA,均对人类的多种疾病具有调控作用[9]。近年来越多越多的研究显示,在卵巢癌中存在某些异常表达的LncRNA,且某些LncRNA 已被证实具有调控肿瘤细胞增殖、侵袭、凋亡及肿瘤细胞耐药等过程,从而发挥相应的抗癌、抑癌基因作用[10-12]。
LncRNA KCNQ1OT1 是 KCNQ1 的反义链转录物,其在多种恶性肿瘤组织中表达量升高,故推测KCNQ1OT1 可作为肿瘤诊断、治疗预后的重要标志物,并具有促癌作用[13]。然而,KCNQ1OT1是否参与卵巢癌的DDP 耐药过程,目前尚无相关研究报道。AKT 是一个丝/苏氨酸蛋白激酶,是PI3K 下游的一个作用靶点;mTOR则是一种与PI3K/AKT通路密切相关的蛋白激酶,mTOR 作为AKT的底物可被激活。研究认为[14],AKT/mTOR 信号通路在恶性肿瘤发生、发展、侵袭、转移以及化疗耐药等多种过程中均具有显著的影响作用,其作用主要表现在促进肿瘤细胞增殖而抑制肿瘤细胞凋亡,同时促进肿瘤血管生成等。为进一步了解卵巢癌DDP 耐药机制,并从基因层面寻求逆转卵巢癌耐药的途经,本研究分析了KCNQ1OT1 是否通过调控AKT/mTOR信号通路对卵巢癌细胞DDP耐药产生影响。
本研究经DDP 反复间歇冲击诱导法构建卵巢癌细胞DDP 耐药细胞株SKOV3/DDP,构建后显示对 SKOV-3/DDP 细胞 DDP 的 RI 为 4.020。这提示SKOV3/DDP 细胞株构建成功,与相关报道结果相似[15-16]。关于卵巢癌细胞DDP 耐药的机制,目前主要认为与以下几条途径有关[17]:①细胞解毒系统增强,导致药物迅速灭活;②改变药物靶点,从而降低药物的作用效力;③减少化疗药物的摄入,同时增加化疗药物外排;④增强细胞DNA 修复能力,同时提高抗凋亡基因的表达能力。
本研究结果显示,SKOV-3/DDP 细胞中KCNQ1OT1 表达量高于SKOV-3 细胞;与转染对照组和对照组比较,KCNQ1OT1降表达组细胞G0/G1期细胞比例升高,p-AKT 蛋白表达量降低而p-mTOR 蛋白表达量升高。这提示KCNQ1OT1 参与了卵巢癌细胞DDP 耐药过程,且干扰KCNQ1OT1 表达可有效抑制SKOV3/DDP 细胞增殖活性,即干扰KCNQ1OT1表达可有效逆转卵巢癌细胞耐药。其逆转耐药的机制可能与阻滞细胞周期于G0/G1期,以及调控AKT/mTOR通路有关。而AKT/mTOR通路在前期本实验室研究中已证实参与卵巢癌细胞耐药过程,是细胞耐药的重要机制之一。因此,干扰KCNQ1OT1 表达可有效逆转卵巢癌细胞DDP 耐药,其机制与阻滞耐药细胞于G0/G1期及调控AKT/mTOR 信号通路有关,这可能成为卵巢癌耐药逆转的潜在途径。
