基于网络药理学预测乌头治疗原发性肝癌的作用机制
2022-06-29张懿丹麦婷婷方晶晶万坤铭王丽娜
张懿丹,麦婷婷,方晶晶,万坤铭,王丽娜
1 海军军医大学基础医学院,上海 200433;2 海军军医大学中医系
原发性肝癌是我国常见的恶性肿瘤,病死率高,其病因和发病机制尚未确定[1]。目前,临床治疗原发性肝癌的方法主要包括以肝切除术、肝移植术为代表的外科治疗及经肝动脉化疗栓塞术、局部消融、化疗、靶向治疗等局部治疗,均取得一定疗效,但也存在局限性[2]。近年来,中医药逐步介入原发性肝癌的治疗过程,在病程各期联合西医疗法可达到提高疗效、减轻不良反应、延长患者生存期等目的,具有良好的辅助作用[3]。乌头分为川乌、草乌两种,入心、肝、脾经,有温阳散寒、除湿止痛的功能。多项研究报道,乌头对恶性肿瘤有治疗作用。口服乌头汤及外敷癌症镇痛散均可有效缓解患者癌性疼痛;肌内注射乌头注射液可提高患者巨噬细胞吞噬功能,提高机体免疫力,增强抗肿瘤能力[4]。现代药理学研究也显示,乌头具有抗肿瘤、调节免疫、抗炎和镇痛等方面的药理作用[5]。虽然已有多项研究表明了乌头治疗肿瘤的有效性,但关于乌头治疗原发性肝癌的相关报道仍然较少。2020年2月—2021年12月,本研究运用网络药理学方法分析了乌头治疗原发性肝癌的有效成分及作用机制,旨在为乌头用于原发性肝癌治疗的基础和临床研究提供理论依据。
1 材料与方法
1.1 乌头有效活性成分筛选 在中药系统药理学数据库与分析平台(TCMSP,http://tcmspw. com/tcmsp.php)中查找中药川乌与草乌的化学成分,以生物口服利用度(OB)≥30%、化合物类药性(DL)≥0.18为条件筛选乌头的有效活性成分。
1.2 乌头治疗原发性肝癌的相关靶点收集 乌头潜在作用靶点收集:在TCMSP 数据库中利用Targets information 功能进行在线分析,利用Mol ID 一栏搜索上一步筛选出的乌头有效活性成分ID,得到各有效活性成分对应的靶点信息,在美国国家生物技术信息中心基因数据库(NCBI,https://www. ncbi.nlm.nih.gov/gene/)中将靶点信息转换为基因名称。原发性肝癌潜在靶点收集:在GeneCards 数据库(https://www. genecards. org/)中 以“primary liver cancer”为关键词检索获得已有研究的原发性肝癌相关基因,以相关度>0 为筛选标准,最大化纳入原发性肝癌相关靶点。通过使用韦恩图工具(https://bioinfogp. cnb. csic. es/tools/venny/)将原发性肝癌潜在靶点与乌头潜在作用靶点取交集,获得乌头治疗原发性肝癌的相关靶点。
1.3 乌头治疗原发性肝癌的有效活性成分—相关靶点相互作用关系分析 在Cytoscape3.7.2 软件中构建乌头治疗原发性肝癌的有效活性成分—相关靶点相互作用网络图,在输出结果中以不同颜色的节点分别代表乌头、乌头有效活性成分、乌头治疗原发性肝癌的相关靶点以及原发性肝癌,若节点间有相互作用,则两者以直线相连,以此观察乌头治疗原发性肝癌的有效活性成分—相关靶点相互作用关系。
1.4 乌头治疗原发性肝癌核心靶点筛选 在bioDBnet数据库(https://biodbnetabcc.ncifcrf.gov/)中将乌头治疗原发性肝癌相关靶点进行基因ID 转换,将乌头治疗原发性肝癌相关靶点导入STRING数据库(https://string-db. org/),将物种设定为Homo sapiens 并删去无关联的节点,获得乌头治疗原发性肝癌相关靶点的蛋白互作关系,将数据保存后导入Cytoscape 3.7.2 软件,构建乌头治疗原发性肝癌相关靶点蛋白互作关系图。蛋白互作关系图中,节点表示乌头治疗原发性肝癌的相关靶点,度中心性(DC)表示一个节点与其他所有节点间直接联系数的总和,DC值越大,节点越大,与其他靶点的相关性越大。选取DC 值前5 位的靶点作为乌头治疗原发性肝癌的核心靶点。
1.5 相关靶点的GO生物学过程及KEGG信号通路分析 在Geneontology 数据库(http://geneontology.org/)中对相关靶点进行GO 生物学过程分析,以校正后P<0.05 作为筛选标准,得到显著富集的过程。在 KEGG 数据库(https://www. kegg. jp/)中对相关靶点进行KEGG 信号通路分析,以校正后P<0.05 作为筛选标准,得到显著富集的通路。
2 结果
2.1 乌头有效活性成分筛选结果 在TCMSP 数据库中共收集到符合OB≥30%、DL≥0.18 的川乌有效活性成分3 种、草乌有效活性成分8 种,去重后获得乌头有效活性成分10种。见表1。

表1 乌头有效活性成分
2.2 乌头治疗原发性肝癌的相关靶点收集结果在TCMSP 数据库中共搜索到有靶点信息的乌头有效活性成分3 个,共24 个靶点信息。见表2。在GeneCards 数据库中共收集到14 274 个原发性肝癌相关基因。通过韦恩图工具将乌头潜在作用靶点与原发性肝癌相关靶点取交集,获得乌头治疗原发性肝癌的相关靶点22 个,包括乙酰胆碱酯酶(ACHE)、肾上腺素能受体α1A(ADRA1A)、肾上腺素能受体α1B(ADRA1B)、肾上腺素能受体α1D(ADRA1D)、肾上腺素能受体β2(ADRB2)、雄激素受体(AR)、毒蕈碱型乙酰胆碱受体M1(CHRM1)、毒蕈碱型乙酰胆碱受体M3(CHRM3)、热休克蛋白90αA1(HSP90AA1)、热休克蛋白 90αB1(HSP90AB 1)、核受体辅激活蛋白 1(NCOA1)、核受体辅激活蛋白2(NCOA2)、内皮型一氧化氮合酶(NOS3)、阿片受体 δ1(OPRD1)、阿片受体 μ1(OPRM1)、孕酮受体(PGR)、前列腺素内过氧化物合酶1(PTGS1)、前列腺素内过氧化物合酶2(PTGS2)、视黄醇X 受体α(RXRA)、SCN5A、拓扑异构酶Ⅱα(TOP2A)、拓扑异构酶Ⅱβ(TOP2B)。

表2 乌头有效化学成分的相关靶点信息数
2.3 乌头治疗原发性肝癌的有效成分—相关靶点相互作用关系分析结果 乌头治疗原发性肝癌的有效成分—相关靶点相互作用网络图可见,编号为MOL002086 的有效成分可通过靶点PGR、NCOA1、NCOA2作用于原发性肝癌,编号为MOL002087的有效成分可通过靶点NCOA2、PGR、RXRA 作用于原发性肝癌,编号为MOL004763 的有效成分可通过ACHE、ADRA1A、ADRA1B、ADRA1D、ADRB2、AR、CHRM1、CHRM3、HSP90AA1、HSP90AB1、NOS3、OPRD1、OPRM1、PTGS1、PTGS2、RXRA、SCN5A、TOP2A、TOP2B 这19 个相关靶点作用于原发性肝癌。见OSID码图1。
2.4 乌头治疗原发性肝癌核心靶点筛选结果 乌头治疗原发性肝癌相关靶点蛋白互作关系图可见,乌头治疗原发性肝癌的核心靶点为NOS3、ACHE、ADRA1B、AR和PGR。见OSID码图2。
2.5 相关靶点的GO生物学过程及KEGG信号通路分析结果 GO 生物学过程分析共收集到校正后P值<0.05 的GO 生物学过程62 个,包括类固醇激素受体活性、G 蛋白偶联胺受体活性、肾上腺素能受体活性、肽结合、核受体结合以及胺结合等。见OSID码图3。KEGG 信号通路分析共收集到校正后P值<0.05 的信号通路18 个,包括雌激素信号通路、钙信号通路、白细胞介素17(IL-17)信号通路、磷脂酰肌醇3-激酶(PI3K)-蛋白激酶B(AKT)信号通路以及辅助性T细胞17(Th17)细胞分化等。见表3。
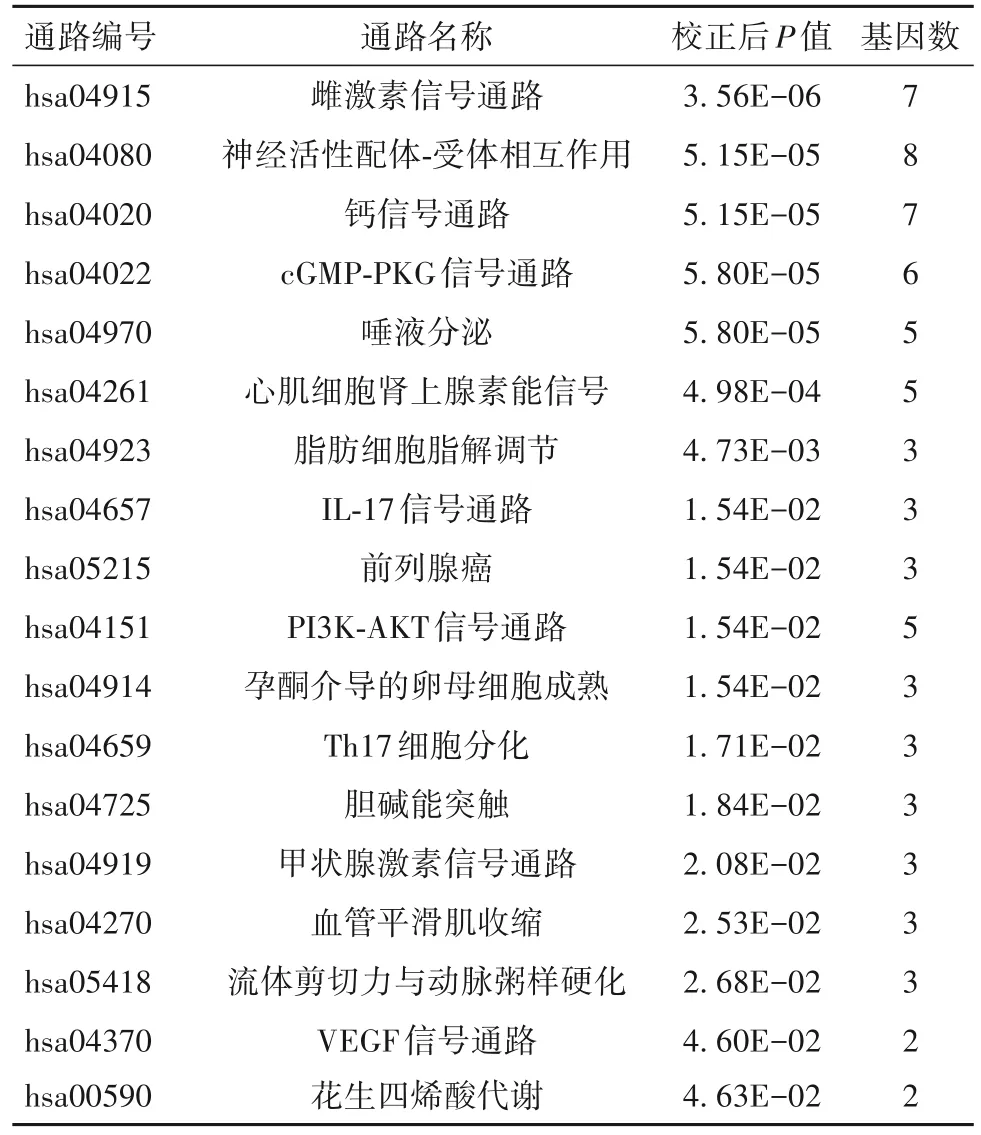
表3 乌头治疗原发性肝癌核心靶点的KEGG信号通路分析结果
3 讨论
网络药理学可通过运用多种数据库和分析工具来构建药物—疾病网络,从而挖掘网络中的关键节点,阐释药物作用于疾病的机制[6]。本研究基于网络药理学分析了乌头治疗原发性肝癌的有效成分及作用机制,以期为原发性肝癌的治疗提供理论依据。
本研究共筛选获得3种乌头有效成分及22个乌头治疗原发性肝癌的相关靶点,其中乌头有效成分异波尔定碱治疗原发性肝癌的潜在靶点有19个,占总作用靶点的86.4%,并可作用于NOS3、ACHE、ADRA1B 和AR 这4 个乌头治疗原发性肝癌核心靶点。以往对异波尔定碱的相关研究主要集中于降血压及抗焦虑方面,本研究结果显示,异波尔定碱作用的关键靶点NOS3 是NOS 的一种亚型,能够起调节血管扩张和平滑肌增生的作用[7]。有研究发现,NOS3在癌旁肝组织中的表达增加,可能是通过其舒张血管、增加肝癌组织血供和促进肝癌组织血管形成的作用促进其生长[8]。这提示异波尔定碱作用的NOS3在肝癌生长过程中具有重要作用,异波尔定碱可以作为治疗肝癌潜在活性成分进行更深入的研究。
已有研究表明,炎症与肝癌密切相关[9]。在肝癌发生发展过程中,炎症可促进肝癌细胞的增殖与存活,通过影响免疫调控帮助肝癌细胞逃脱免疫系统监视,还能促使基因突变并诱导血管生成[10]。炎症细胞作为肝癌微环境的重要组成部分,贯穿着肝癌发生发展和转移的全过程,抑制炎症可以延缓肝癌的生长和进一步发展,扩大早期发现癌症的机会并降低肝癌转移的病死率[11]。Th17 细胞是一种具有独立分化和调节机制的CD4+T 淋巴细胞,可特异性分泌重要的促炎细胞因子IL-17,其诱导的炎症介质可刺激功能失调的髓样细胞的扩张和募集,建立一个促血管生成和免疫抑制的肝癌微环境,从而促进肝癌的生长和转移[12-13]。近年来,在组织干细胞中还发现了IL-17介导的直接有丝分裂信号,进一步证明了IL-17 在肝癌发展过程中的重要作用[14]。有临床研究发现,肝癌患者外周血和癌组织中Th17细胞占CD4+T 淋巴细胞的比例显著升高,能促进血管生成和肝癌细胞增殖的IL-17 表达也显著高于非癌组织,提示Th17 细胞比例升高和IL-17 水平升高与肝癌发生发展密切相关,其可成为抗肝癌的重要靶点[15]。本研究发现,乌头有效成分的作用靶点与Th17 细胞分化以及IL-17 信号通路密切相关,这与以往乌头能够抑制炎症反应的研究相互印证,为乌头用于原发性肝癌治疗的研究提供了网络药理学证据[16-17]。
此外,在癌细胞中高表达的HSP90α 作为一种分子伴侣,可通过与癌组织发生相关蛋白结合使蛋白以活性形式存在,从而促进肝癌的生长与转移。PI3K-AKT信号通路的异常活化与肝癌细胞的生长、代谢密不可分,其中的AKT 作为HSP90α 的客户蛋白,可被HSP90α 抑制剂诱导凋亡,使肝癌细胞的增殖和迁移受到抑制[18-19]。与 HSP90α 抑制剂作用相似,乌头有效化学成分的作用靶点涉及HSP90AA1,且与PI3K-AKT 信号通路密切相关,提示乌头或可通过影响HSP90AA1 进而抑制PI3K-AKT 信号通路达到抗肝癌的目的,具有一定的研究价值。
同时,我们发现KEGG 信号通路富集分析中富集程度最高的雌激素信号通路囊括了PGR 在内的7 个靶点,而雌激素及其受体可通过介导炎症因子的表达在一定程度上抑制肝癌的发展[20]。KEGG 通路富集分析同时发现,钙信号通路包含了钙依赖性蛋白NOS3 在内的7 个作用靶点,可介导NOS3 蛋白表达的过程[8]。这提示乌头对原发性肝癌的治疗是多靶点、多途径的,应当从多角度进行研究。
综上所述,本研究通过网络药理学方法,从理论上初步分析了乌头治疗原发性肝癌的有效成分及相关靶点,并对其作用机制进行了探讨,为乌头治疗原发性肝癌相关机制提供了网络药理学证据。乌头可通过异波尔定碱等有效成分作用于NOS3、ACHE、ADRA1B等核心靶点,调控类固醇激素受体活性、激素结合、G 蛋白偶联胺受体活性等生物学过程及IL-17、PI3K-AKT 等信号通路,多靶点、多途径协同发挥治疗原发性肝癌的作用。但本研究存在着一定的局限性:①仅使用网络药理学方法对乌头治疗原发性肝癌的相关机制作理论分析,并没有运用体内或体外的相关研究论证乌头治疗原发性肝癌的相关靶点及信号通路,因此乌头治疗原发性肝癌的有效性尚需进一步的实验研究。②乌头的毒性在很大程度上限制了其研究与临床应用,目前不仅缺乏其抗肿瘤机制的深入研究,而且其成分靶点的研究也存在空白,导致我们可用于讨论的相关参考文献较少。在以后的研究中,我们希望可以通过体内或体外的临床研究佐证我们通过网络药理学分析得出的结论,并致力于寻找乌头减毒增效的方法,以期未来能够进一步挖掘乌头治疗原发性肝癌的深层次机制,为临床提供安全有效、作用明晰的治疗策略。
