荆树皮栲胶/纤维素-聚乙烯亚胺气凝胶吸附阿散酸的研究
2022-06-29杨桂芳刘以凡叶晓霞刘明华
林 娜 杨桂芳 刘以凡 ,2 叶晓霞 ,2 刘明华 ,2,*
(1. 福州大学环境与安全工程学院,福建福州,350108;2. 福建省生物质资源化技术开发基地,福建福州,350108)
对氨基苯胂酸(阿散酸,p-ASA)作为一种常见的有机砷添加剂,是一种低毒类有机物,具有提高饲料利用率和调节肠道寄生虫的作用,已被广泛应用于畜禽养殖[1-3]。畜禽摄入的p-ASA 通常会随着动物的尿液和粪便排出体外被用作肥料,会造成地表水和土壤污染[1,4-5]。更严重的是,p-ASA 经微生物降解后会形成毒性大、致癌性强的无机砷,从而影响植物和微生物的生长发育,甚至会通过食物链的传递,危及人类健康[6]。为了减少p-ASA的污染,亟需开发出一种环境友好、成本低廉的处理方式。目前,去除p-ASA的方法主要为降解和吸附[7]。其中,降解主要包括高级氧化[8-9]和光催化[10-11]。虽然通过降解可以完全将p-ASA转化为无机物和无机砷,但是如果没有后续的处理过程,无机砷会造成二次污染。此外,催化剂制备困难、成本高、回收难度大。而吸附法具有处理效果好、可操作性强、成本低廉、处理污染物种类多和可再生循环使用等优点,是目前处理p-ASA的主要方法之一。近年来,各种吸附剂如铁氧化物、锰氧化物[12]、有机金属框架物[13]和壳聚糖[14]等成为吸附p-ASA的主要吸附材料,虽然其中一些材料已被证明对p-ASA具有良好的吸附性能,但因成本高、回收困难等缺点限制了其实际应用。为了解决这些问题,研究人员将研究重点逐渐转向磁性复合碳材料[15-16]和宏观块状材料,尤其是宏观块状材料,如气凝胶[17-18]、块状膜[19]等。
纤维素气凝胶作为区别于无机气凝胶和有机聚合物气凝胶的第三代气凝胶,具有密度低、比表面积大(108~539 m2/g)、孔隙率高、廉价易回收、可生物降解性和生物相容性佳等优点[20]。纤维素气凝胶已被用于去除各种污染物,如金属离子Cu2+和各种有机污染物[21],水产品养殖废水中的硝酸盐、亚硝酸盐和磷酸盐[22]及废水中的染料(如亚甲基蓝[23]、酸性红[24])等。纤维素气凝胶不仅可以处理废水,还可以作为捕获剂捕获CO2[25]。然而,原始纤维素气凝胶仅具有羟基官能团,其活性远低于其他基团(如氨基和羧基),因此对有机污染物的吸附能力有限,需通过对原始纤维素气凝胶表面进行化学修饰(如氨化、磺化、赋磁[26-27])以引入活性吸附位点,从而增强其强度性能及其对有机污染物的吸附能力。
基于此,本实验在纤维素气凝胶的基础上,通过氨化并与荆树皮栲胶(BWT)交联,制备新型功能化荆树皮栲胶/纤维素-聚乙烯亚胺气凝胶((Cell/BWT)@PEI),并对其进行结构表征,同时通过改变溶液pH 值、吸附时间和p-ASA 初始质量浓度等反应条件,考察(Cell/BWT)@PEI 对p-ASA 的吸附性能及吸附机理。
1 实 验
1.1 主要试剂
纤维素粉(Cell,α-纤维素,白色粉末状,聚合度180,平均分子质量162.06,粒径90 µm)、PEI(99%)、环氧氯丙烷、p-ASA(98%)皆为分析纯,购自上海阿拉丁生物科技股份有限公司;BWT,购自天津福晨化学试剂厂;NaOH、尿素,均为分析纯,购自国药集团化学试剂有限公司。
1.2 主要仪器
紫外-可见分光光度计,T6 新世纪,北京普析通用仪器有限责任公司;Zeta 电位与纳米粒度仪,NanoPlus3,美国Micromeritics公司;智能恒温培养振荡器,ZWYR-2012C,上海智城分析仪器制造公司;孔径分布和比表面积分析仪(BET),ASAP2020,美国Micromeritics 公司;X 射线光电子能谱仪(XPS),ESCALAB 250 X,美国Thermo Fisher Scientific 公司;X 射线粉末衍射仪(XRD),Miniflex 600,日本株式会社Rigaku;真空干燥箱,VOS-60A,施都凯仪器设备(上海)有限公司。
1.3 Cell@PEI和(Cell/BWT)@PEI的制备
将2 g 纤维素粉加入到m(NaOH)∶m(尿素)∶m(水)=7∶22∶81的溶解体系中,然后置于超低温冷冻储存箱中进行冷冻处理,经3~5 次反复冷冻获得质量分数为4%的胶状纤维素。取上述溶液50 g,在充分搅拌的条件下加入4 g PEI,30 min 后逐渐加入5 g 环氧氯丙烷,在70℃下反应4 h,得到块状水凝胶,用去离子水反复冲洗以置换去除多余的NaOH、尿素和PEI,直至水凝胶呈中性,最后经冷冻干燥获得Cell@PEI。再取上述溶液50 g,在充分搅拌的条件下加入4 g PEI和1 g BWT,30 min后逐渐加入5 g环氧氯丙烷,在70℃下反应4 h,得到块状水凝胶,用去离子水反复冲洗以置换去除多余的NaOH、尿素和PEI,直至水凝胶呈中性,最后经冷冻干燥获得(Cell/BWT)@PEI。
1.4 (Cell/BWT)@PEI的结构表征
分别采用扫描电子显微镜、孔径分布和比表面积分析仪、X射线粉末衍射仪和X射线光电子能谱仪测定样品的形貌、比表面积、晶型结构和化学状态。
1.5 吸附实验
将储备液p-ASA 稀释至100 mg/L,取50 mL 并投加20 mg(Cell/BWT)@PEI,在 25℃、160 r/min 转速条件下反应360 min。反应完毕后,取一定量上清液,采用紫外-可见分光光度计测定p-ASA 吸光度,根据式(1)计算 (Cell/BWT)@PEI 对p-ASA 的平衡吸附容量 (Qe,mg/g)。
式中,C0为p-ASA 初始质量浓度,mg/L;Ce为吸附达到平衡后p-ASA质量浓度,mg/L;V为溶液体积,L;X为(Cell/BWT)@PEI投加量,g。
1.6 吸附再生实验
采用1 mmol/L NaOH 作为解吸剂对吸附p-ASA 后的(Cell/BWT)@PEI 进行5 次解吸再生实验。每次再生后抽滤、用去离子水洗涤(Cell/BWT)@PEI至中性并干燥,重复吸附实验(同1.5部分)。计算每次再生的(Cell/BWT)@PEI 对p-ASA 的平衡吸附容量和去除率。
2 结果与讨论
2.1 (Cell/BWT)@PEI的表征
2.1.1 SEM分析
纤维素粉、Cell@PEI 及 (Cell/BWT)@PEI 的表面微观形貌如图1 所示。从图1 可以看出,与纤维素粉的粗糙表面结构不同,Cell@PEI具有孔隙结构发达的三维网状结构,这表明通过溶胶-凝胶法引入PEI后改变了原料纤维素的表面形貌。此外,引入BWT 的(Cell/BWT)@PEI 的孔隙结构更加发达,具有较大的比表面积,为吸附提供更多孔道,从而提高吸附效率。由(Cell/BWT)@PEI 的EDS 图(见图2)可知,(Cell/BWT)@PEI 的主要元素为C、O、N,这表明其成功引入了氨基。

图1 纤维素粉(a,b)、Cell@PEI(c,d)、(Cell/BWT)@PEI(e,f)的SEM图Fig.1 SEM images of Cell(a,b),Cell@PEI(c,d),and(Cell/BWT)@PEI(e,f)
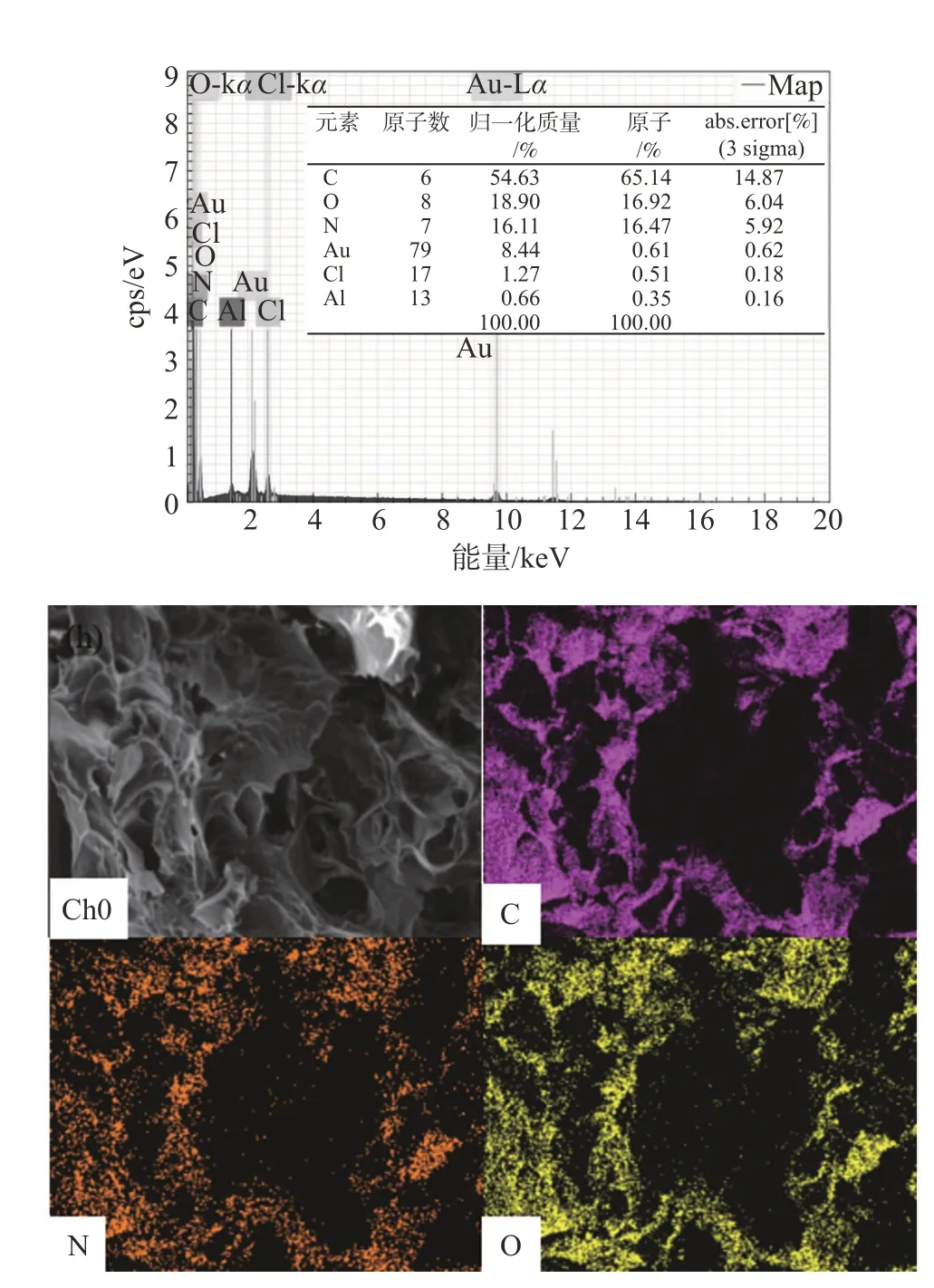
图2 (Cell/BWT)@PEI的EDS图Fig.2 EDS images of(Cell/BWT)@PEI
2.1.2 BET分析
采用BET 模型和N2吸附-脱附方法测定纤维素粉和(Cell/BWT)@PEI的孔径分布和比表面积,结果如图3所示。由图3可知,(Cell/BWT)@PEI的比表面积较纤维素粉的显著增大,这可能是由于氨基改性和BWT 的引入使纤维素的结构发生了变化,进一步证实了SEM 的分析结果。根据IUPAC 公布的气体吸附等温线分类标准,(Cell/BWT)@PEI 符合Ⅴ型等温线的特征,其比表面积为190.6 m2/g,孔径为15.2 nm,是典型的介孔材料;与纤维素粉相比,所制备的(Cell/BWT)@PEI更有利于吸附有机污染物。

图3 纤维素粉和(Cell/BWT)@PEI的N2吸附-脱附等温线Fig.3 N2 adsorption-desorption isotherms of Cell and(Cell/BWT)@PEI
2.1.3 XRD分析
纤维素粉、Cell@PEI 和(Cell/BWT)@PEI 的XRD谱图如图4所示。由图4可知,纤维素粉为I型结晶结构,在2θ=15.0°、22.6°及34.2°处出现的峰分别对应I型结构的典型晶面 (101)、(002) 及 (040)。而Cell@PEI 和(Cell/BWT)@PEI 的XRD 谱图呈现出典型的Ⅱ型结构,分别在2θ=20.0°及22.0°处出现Ⅱ型结构的典型晶面(101)。这说明经PEI改性后,纤维素的晶型结构发生了明显变化,同时也证明PEI成功接枝到了纤维素上。特别的是,(Cell/BWT)@PEI 与Cell@PEI 的晶型基本保持一致,表明BWT 的缩合作用对Cell@PEI晶型结构的影响较小。

图4 纤维素粉、Cell@PEI和(Cell/BWT)@PEI的XRD谱图Fig.4 XRD spectra of Cell,Cell@PEI,and(Cell/BWT)@PEI
2.1.4 TG-DTG分析
对纤维素粉和(Cell/BWT)@PEI 进行TG-DTG 分析,结果如图5 所示。从图5 可以看出,纤维素粉和(Cell/BWT)@PEI 的热分解过程相似。首先,样品在温度低于250℃时出现少量的质量损失,这是由于水分的蒸发;其次,250℃~400℃时出现较大的质量损失,主要是由于样品中纤维素链的热分解;最后,在温度高于400℃时,样品基本完成热分解反应,开始发生炭化反应。对比纤维素粉和(Cell/BWT)@PEI 的TG曲线可以发现,经PEI改性后,样品热解过程中质量损失有所减少,表明(Cell/BWT)@PEI 的热稳定性提高。此外,由图5(b)可知,相较于纤维素粉,(Cell/BWT)@PEI 的最大热分解速率显著降低。由此可知,经BWT 缩合和PEI 接枝后的(Cell/BWT)@PEI具有较好的热稳定性。

图5 纤维素粉和(Cell/BWT)@PEI的TG(a)和DTG(b)曲线Fig.5 TG(a)and DTG(b)curves of Cell and(Cell/BWT)@PEI
2.2 (Cell/BWT)@PEI对p-ASA的静态吸附性能分析
2.2.1 溶液pH值对(Cell/BWT)@PEI吸附性能的影响
在吸附温度25℃、p-ASA 初始质量浓度60 mg/L、吸附时间300 min、吸附剂(Cell/BWT)@PEI 投加量0.4 g/L 的条件下,研究溶液pH 值对(Cell/BWT)@PEI吸附性能的影响,结果如图6 所示。由图6 可知,溶液 pH 值对(Cell/BWT)@PEI 吸附性能的影响显著。当 pH 值<5.0 时,(Cell/BWT)@PEI 对p-ASA 的Qe及去除率随着pH 值的增大而提高;当pH 值=5.0 时,(Cell/BWT)@PEI 对p-ASA 的Qe(158.5 mg/g) 及去除率 (63.4%) 最大;pH 值>5.0 时,(Cell/BWT)@PEI对p-ASA 的Qe和去除率随pH 值增大呈明显下降趋势。实验结果表明,酸性条件有利于(Cell/BWT)@PEI 对p-ASA 的吸附,而碱性条件则不利于该吸附反应的进行。这是由于溶液pH 值的变化会严重影响p-ASA 的化学形态、溶解度及亲水性等性能,最终影响(Cell/BWT)@PEI 对其的吸附性能。p-ASA 在不同pH 值下的化学形态分布如图7 所示。由图7 可知,不同 pH 值下,p-ASA 的 pKa 值[28-29]分别为 1.9、4.1和9.2。酸性条件下,(Cell/BWT)@PEI 在水溶液中可发生氨基表面质子化,使其表面带正电荷,从而可与带负电荷的p-ASA 发生静电吸附,因此其对p-ASA的Qe和去除率增大;碱性条件下,(Cell/BWT)@PEI表面携带的负电荷逐渐增多,与p-ASA 之间形成的静电斥力增大,另外,溶液中OH-离子增多也会对(Cell/BWT)@PEI 吸附p-ASA 造成一定的竞争效应,导致p-ASA 的吸附受到抑制[30-31],因而其对p-ASA 的Qe和去除率减小。因此,选取溶液pH 值=5.0 为优选条件,并进行后续实验。

图6 溶液pH值对(Cell/BWT)@PEI吸附p-ASA的影响Fig.6 Effect of solution pH value on the adsorption by(Cell/BWT)@PEI for p-ASA

图7 p-ASA在不同pH值下的化学形态分布图Fig.7 Chemical morphological distribution of p-ASA at different pH values
2.2.2 吸附时间对(Cell/BWT)@PEI吸附性能的影响
设定吸附温度25℃、吸附剂(Cell/BWT)@PEI 投加量0.4 g/L、p-ASA 初始质量浓度60 mg/L、溶液pH值=5.0,进行吸附反应。在反应过程中,间隔一定时间进行取样,测定该时刻(Cell/BWT)@PEI 对p-ASA的吸附容量(Qt)及去除率,以考察吸附时间对(Cell/BWT)@PEI 吸附p-ASA 的影响,结果如图8所示。

图8 吸附时间对(Cell/BWT)@PEI吸附p-ASA的影响Fig.8 Effect of time on the adsorption by(Cell/BWT)@PEI for p-ASA
由图8可知,随着吸附时间的延长,(Cell/BWT)@PEI 吸附p-ASA 的过程可大致分为快速吸附和慢速吸附2 个阶段。快速吸附发生在吸附的初始阶段(0~30 min),在此阶段,(Cell/BWT)@PEI 对p-ASA 的吸附速率较快,去除率也迅速提高。吸附60 min 后,(Cell/BWT)@PEI 对p-ASA 的Qt和去除率分别达到118.5 mg/g 和47.4%。这主要是由于以下两方面原因:①溶液和(Cell/BWT)@PEI 表面的p-ASA 存在较大的浓度差,此时具有较大的吸附驱动力;②吸附开始阶段,吸附剂表面存在大量的吸附位点,易于吸附反应的进行。之后,随着吸附的进行(30~540 min),溶液与(Cell/BWT)@PEI 表面的p-ASA 浓度差逐渐变小,且(Cell/BWT)@PEI 表面的吸附位点也逐渐减少。因此,随着吸附时间的延长,虽然(Cell/BWT)@PEI 对p-ASA的Qt和去除率继续保持提高,但提高速率逐渐减小。反应进行至360 min后,(Cell/BWT)@PEI吸附性能减弱,吸附反应趋于平衡;吸附时间为360 min时,(Cell/BWT)@PEI 对p-ASA 的去除率为64.6%,Qt为161.5 mg/g。因此,选择吸附时间360 min以进行后续实验。
2.2.3p-ASA 初始质量浓度对纤维素粉及(Cell/BWT)@PEI吸附性能的影响
在吸附温度25℃、吸附时间360 min、纤维素粉和(Cell/BWT)@PEI 投加量均为0.4 g/L、溶液pH 值为5.0 的条件下,考察p-ASA 初始质量浓度(10、30、50、75、100 mg/L)对纤维素粉及(Cell/BWT)@PEI吸附性能的影响,结果如图9所示。

图9 p-ASA初始质量浓度对纤维素粉及(Cell/BWT)@PEI吸附性能的影响Fig.9 Effect of initial mass concentration of p-ASA on the adsorption by Cell and(Cell/BWT)@PEI for p-ASA
由图9可知,p-ASA 溶液的初始质量浓度从10增至 100 mg/L 时 ,(Cell/BWT)@PEI 对p-ASA 的Qe从20.85 增至163.3 mg/g,此时对应的去除率为65.3%。当p-ASA 初始质量浓度较低时,(Cell/BWT)@PEI 表面的吸附位点较多,可快速吸附p-ASA,因此,p-ASA 去除率较高;此时,(Cell/BWT)@PEI 表面的吸附位点多于p-ASA分子,因此Qe较低。而当p-ASA初始质量浓度较高时,溶液中p-ASA分子存在明显的竞争吸附,相互斥力的影响较大,使未被吸附的p-ASA分子不易靠近(Cell/BWT)@PEI 表面而造成部分吸附位点失效,因而p-ASA 去除率下降。p-ASA 溶液的初始质量浓度为10~100 mg/L时,(Cell/BWT)@PEI的吸附容量曲线一直保持上升趋势,说明该吸附反应中(Cell/BWT)@PEI 的Qe尚未达到,仍有可能继续增加,表明(Cell/BWT)@PEI 具有优异的吸附性能。
2.2.4 吸附动力学分析
将(Cell/BWT)@PEI 对p-ASA 的Qt随时间变化的数据(见图8)用准一级动力学模型和准二级动力学模型进行拟合,建立了(Cell/BWT)@PEI 吸附p-ASA的动力学模型(见图10)。
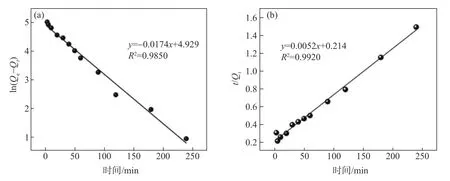
图10 (a)准一级动力学方程拟合;(b)准二级动力学方程拟合Fig.10 Fitting equations for(a)pseudo-first-order kinetics and(b)pseudo-second-order kinetics
从图10(a)和图10(b)可以看出,准二级动力学模型的相关系数R2(0.9920)大于准一级动力学模型相关系数R2(0.9850),说明(Cell/BWT)@PEI 对p-ASA 的吸附更符合准二级动力学模型,这表明(Cell/BWT)@PEI在吸附p-ASA的过程中,二者之间发生了电子转移,即(Cell/BWT)@PEI 对p-ASA 的吸附过程是化学吸附过程[32-33]。
2.2.5 吸附等温线分析
用Langmuir 和Freundlich 模型拟合了不同温度下(Cell/BWT)@PEI 吸附p-ASA 的吸附等温线数据,结果如表1和表2及图11所示,其中,Qm为理论最大吸附容量。由表1 和表2 可知,不同吸附温度下(除298 K外),Freundlich模型的决定系数R2均大于Lang⁃muir 模型,说明Freundlich 模型更适用于描述(Cell/BWT)@PEI对p-ASA的吸附,即(Cell/BWT)@PEI对p-ASA 的吸附为多分子层吸附,且p-ASA 分子与(Cell/BWT)@PEI 表面之间存在相互作用[3]。此外,Lang⁃muir等温式和Freundlich等温式的吸附平衡常数(KL、KF)以及Qe均随着吸附温度的升高(<328 K)而减小,表明升温不利于(Cell/BWT)@PEI 对p-ASA 的吸附;Freundlich 吸附等温式的吸附强度常数1/n<1,Langmuir 的KL在 0~1 之间,说明(Cell/BWT)@PEI 对p-ASA的吸附容易进行。

图11 (a)Langmuir方程拟合图;(b)Langmuir方程线性拟合图;(c)Freundlich方程拟合图;(d)Freundlich方程线性拟合图Fig.11 (a)Langumuir equation fitting;(b)linear fitting of Langumuir equation;(c)Freundlich equation fitting;(d)linear fitting of Freundlich equation

表1 (Cell/BWT)@PEI吸附p-ASA的Langmuir吸附等温式Table 1 Langmuir adsorption isotherm equations for (Cell/BWT)@PEI adsorbing p-ASA

表2 (Cell/BWT)@PEI吸附p-ASA的Freundlich吸附等温式Table 2 Freundlich adsorption isotherm equations for (Cell/BWT)@PEI adsorbing p-ASA
2.2.6 吸附热力学分析
为了更好地了解(Cell/BWT)@PEI 对p-ASA 的吸附过程,对该吸附过程的热力学反应进行了研究,结果见表3。由表3可知,在不同温度下,(Cell/BWT)@PEI 对p-ASA 吸附的 ΔH值为负,表明(Cell/BWT)@PEI 对p-ASA 的吸附过程属于放热反应,即高温不利于此吸附过程的进行。ΔG为负值且随温度升高而增大,说明(Cell/BWT)@PEI 对p-ASA 的吸附是自发的,低温下吸附效果更好。负的ΔS值说明(Cell/BWT)@PEI对p-ASA的吸附过程是熵逐渐减少的过程。

表3 (Cell/BWT)@PEI吸附p-ASA的热力学参数Table 3 Thermodynamic parameters for the adsorption of p-ASA by (Cell/BWT)@PEI
2.3 (Cell/BWT)@PEI吸附p-ASA的机理研究
为了阐明p-ASA 在(Cell/BWT)@PEI 界面上的分子相互作用,利用XPS 光谱探讨(Cell/BWT)@PEI 的吸附机理。此外需知,吸附机理受复合材料结构、溶液pH值、官能团等多种因素的影响。
2.3.1 静电作用
p-ASA在(Cell/BWT)@PEI界面上的吸附存在静电相互作用的物理化学过程。首先,p-ASA上具有较强还原活性的极性氨基[2,34-35],且由图7已知,p-ASA有3 个 pKa 值 (1.9、4.1 和 9.2)。此外,PEI 是一种水溶性聚胺,在水溶液中呈碱性,分子链上具有大量的氨基N原子(伯、仲、叔胺的比例通常为1∶2∶1),使其具有强亲质子性,因此PEI 是一种阳离子聚电解质[3,36]。当溶液pH值<5.0时,p-ASA 在(Cell/BWT)@PEI 上的Qe随着溶液pH 值增大而提高,并在pH 值=5.0 时达到峰值 (158.5 mg/g)。此时,(Cell/BWT)@PEI 在溶液中带正电荷,p-ASA 在溶液中负电荷的比例较大,导致二者之间存在静电吸引作用,因而提高了吸附效果。当溶液呈碱性(pH值为10~14)时,p-ASA 与(Cell/BWT)@PEI 都带负电荷,静电斥力导致吸附效果不断下降。因此,根据(Cell/BWT)@PEI 所携带离子的特性和p-ASA 分子的pKa 值以及不同pH值条件下(Cell/BWT)@PEI 和p-ASA 分子的表面电荷情况(见图7和图12)可知,(Cell/BWT)@PEI吸附p-ASA过程的主要机理是静电作用。

图12 不同pH值下(Cell/BWT)@PEI的Zeta电位Fig.12 Zeta potential of(Cell/BWT)@PEI at different pH value
2.3.2 氢键作用
吸附剂与吸附质之间的氢键作用被认为是吸附有机污染物的重要机理之一[37]。(Cell/BWT)@PEI 分子和p-ASA分子中存在大量的H键供体和H键受体,这就意味着二者之间存在一定的氢键作用。因此,采用XPS 光谱分析以进一步确定吸附p-ASA 前后(Cell/BWT)@PEI的氢键作用,结果如图13所示。
由图13(a)和图13(d)可知,(Cell/BWT)@PEI 的C 1s谱图主要由3种类型的C(C—C/C=C(284.8 eV)、C—O/C=N(286.0 eV)和C=O(287.3 eV))构成。由于(Cell/BWT)@PEI 将p-ASA 吸附至其表面,因此官能团C—O/C=N 的比例由吸附前的49.20% 增至50.16%,C=O 键的比例由吸附前的9.31% 增至10.14%。C—C/C=C键的比例由41.49%降至39.70%,这可能是因为它们参与了氢键的形成。另外,(Cell/BWT)@PEI 的 N 1s 谱图 (见图 13(b)和图 13(e)) 中存在3个官能团的峰,分别对应于C=N(398.8 eV)、—NH2/N—H(399.3 eV)和N…H—O(N)(402.0 eV)。在吸附p-ASA 后,—NH2/N—H 键的比例由31.55%降至27.27%,而C=N 和N…H—O(N)的比例分别由56.17%、12.28%增至57.56%、15.17%,这些都说明了N—H 是形成氢键的关键基团。在图13(c)和图13(f)中可观察到 2 种 O 的峰,分别是 530.8 eV 处的 O…H、532.3 eV 处的纤维素C—OH。吸附p-ASA 后,O …H 的比例由11.31%增至14.04%,与此同时,C—OH 的比例由 88.69% 降至 85.96%,表明(Cell/BWT)@PEI的官能团C—OH参与了p-ASA吸附过程中O…H的形成。PEI是较强的H键供体,与H键受体之间可形成较强的氢键作用,从而可与p-ASA上的氨基反应形成氢键以吸附p-ASA。

图13 (Cell/BWT)@PEI吸附p-ASA前后的XPS谱图Fig.13 XPS spectra of each element before and after adsorption of p-ASA by(Cell/BWT)@PEI
2.4 (Cell/BWT)@PEI的再生性能
纤维素气凝胶大都采用成本低、解吸率高以及不造成二次污染的药剂作为解吸剂进行再生实验,本实验采用1 mmol/L NaOH 作为解吸剂,对吸附p-ASA 后的(Cell/BWT)@PEI 进行解吸再生实验,结果如图14所示。由图14 可知,(Cell/BWT)@PEI 经过 5 次循环再生后,对p-ASA 的Qe从初始的163.3 mg/g 降至107.2 mg/g,去除率从65.3%降至42.9%,表明(Cell/BWT)@PEI 再生5 次后仍可吸附水体中大部分p-ASA。

图14 (Cell/BWT)@PEI的5次循环再生使用效果Fig.14 Adsorption performence of(Cell/BWT)@PEI after five-rounds reusing
3 结 论
以纤维素为原料,采用NaOH/尿素/水混合溶液溶解纤维素,通过溶胶-凝胶法将荆树皮栲胶(BWT)和聚乙烯亚胺(PEI)接枝到纤维素上以制备荆树皮栲胶/纤维素-聚乙烯亚胺气凝胶((Cell/BWT)@PEI),并考察了其对p-ASA 的静态吸附性能,得出以下结论。
3.1 (Cell/BWT)@PEI 对p-ASA 的最佳吸附条件为:溶液pH 值为5.0、吸附时间为360 min、吸附温度为25℃、(Cell/BWT)@PEI 投加量为0.4 g/L,该条件下(Cell/BWT)@PEI 对p-ASA 的平衡吸附容量和去除率分别为163.3 mg/g和65.3%。
3.2 (Cell/BWT)@PEI 对p-ASA 的吸附符合Langmuir等温吸附方程和Freundlich 等温吸附方程,但Freun⁃dlich等温吸附方程更适于描述此吸附过程且该吸附过程自发进行。(Cell/BWT)@PEI 对p-ASA 的吸附过程为化学吸附过程,符合准二级动力学方程。吸附热力学分析表明,(Cell/BWT@PEI)对p-ASA的吸附过程为放热反应,高温不利于吸附反应的进行。
3.3 结合X射线光电子能谱(XPS)谱图和Zeta电位分析可知,(Cell/BWT)@PEI对p-ASA的吸附机理为二者间的静电作用和氢键作用。
3.4 吸附再生实验结果表明,循环再生5 次后,(Cell/BWT)@PEI对p-ASA的去除率为42.9%、平衡吸附容量为107.2 mg/g,表明(Cell/BWT)@PEI 具有良好的再生使用效果。
