微纳米生物活性玻璃诱导牙本质再矿化研究
2022-06-29唐洁吟邹学农陈晓峰
唐洁吟,王 刚,刘 聪,邹学农,陈晓峰
(1.华南理工大学 材料科学与工程学院,生物医学工程系,广州 510641;2.国家人体组织功能重建工程技术研究中心,广州 510006);3.中山大学附属第一医院 脊柱外科,广州 510080;4.广东省骨科学重点实验室,广州 510080)
牙本质构成了牙齿的主体硬组织部分,对其功能的正常行使发挥着极为重要的作用。日常由于龋、磨耗等均会使牙本质直接暴露在口腔环境中,造成牙本质过敏,当受到外界刺激(冷热、酸甜等)时会引起疼痛,对患者生活产生极大困扰[1]。治疗牙本质过敏可通过封闭牙本质小管降低牙本质的渗透性,或降低牙髓神经的兴奋性[2-3]。目前临床上,使用较多的脱敏材料包括含氟化物产品、含钾产品、锶盐、树脂类粘结剂等[4],但这类脱敏剂主要与牙本质发生机械结合而不是化学结合。当暴露于酸性条件或刷牙时,脱敏剂容易从牙本质表面被去除,疗效并不持续。
生物活性玻璃因其特有的无机非晶态结构、促进骨细胞活性、提高生物矿化速度等优点,能与骨组织形成化学键合,同时其降解释放的离子可促进多种基因表达,已经成为骨修复领域的重要热点之一[5-6]。随着生物活性玻璃机理和应用研究的深入,由于牙体牙髓组织与骨组织在组成结构上的相似性,生物活性玻璃在齿科修复领域的应用研究也逐渐增多[7]。2004年,研究者首次将生物玻璃45S5(NovaMin)添加到牙膏中,用于治疗牙本质过敏。用含有NovaMin的牙膏刷牙后,牙膏中的生物活性玻璃能够附着在牙本质表面形成羟基磷灰石层[8-9]。NovaMin 还替代传统牙膏中的氧化铝作为摩擦剂,可降低牙龈出血的发生率,抑制牙面菌斑生长[10]。除了在牙膏中的应用,NovaMin 还可以作为抛光膏用于临床牙本质过敏的治疗和牙齿漂白治疗后脱矿牙釉质的再矿化[11]。Wang 等[12]发现用含有 NovaMin 牙膏处理后的牙本质具有更低的牙本质渗透性,表面封闭效果也更好。Vollenweider 等[13]比较了使用火焰喷雾合成的纳米级45S5 与传统的微米级45S5,结合拉曼及EDX 等分析发现,45S5 能较好地诱导牙本质再矿化,且纳米级45S5 能更快释放Ca 和Si 离子,其再矿化效果也更显著。Curtis 等[14]进一步证明,相对于熔融生物活性玻璃在牙本质表面形成磷灰石层,溶胶-凝胶结合微波烧结技术制备的纳米生物活性玻璃能深入牙本质小管形成紧密连接的棒状磷灰石,更好地封闭牙本质小管。但是上述溶胶-凝胶法制备的生物活性玻璃颗粒尺寸多在几十微米尺度,且粒径分布范围较宽,难以进入牙本质小管(管径分布在1~3 µm);同时其玻璃实际化学组成与传统45S5有较大差异,无法完全排除其组分对矿化效果的影响[15]。此外,相关牙本质再矿化研究中,将生物活性玻璃粉体沉积在牙本质切片样品正面,其作为脱敏材料的操作性及与牙本质初期界面结合效果有待进一步验证。
近年来,通过溶胶-凝胶法与有机模板法结合制备得到的微纳米生物活性玻璃(MNBG)以其小尺寸、单分散及微结构特性,逐渐受到研究者关注,与传统的生物活性玻璃相比,MNBG 形貌及结构尺寸等可控,具有更高的比表面积和生物活性,能更快地释放Ca 离子及更快的矿化速度[16-17],这些特性对于封闭牙本质小管,缓解牙本质过敏症具有显著促进作用。本研究以不同尺寸的微纳米生物活性玻璃球形粉体为原料,制备出便于操作的生物活性玻璃糊剂作为牙本质过敏症脱敏材料(MNBGP),进一步研究了MNBGP 与脱矿牙本质切片结合效果、诱导脱矿牙本质切片体外再矿化及堵塞封闭牙本质小管的能力。
1 实验方法
1.1 微纳米生物活性玻璃的制备
通过溶胶-凝胶结合模板法制备MNBGs (摩尔分数80%SiO2、16%CaO 和4%P2O5)[18]。在40 ℃、磁力搅拌条件下,首先将模板剂十二胺(DDA)溶解于一定量去离子水和无水乙醇中;然后将正硅酸四乙酯(TEOS)、磷酸三乙酯(TEP)和四水硝酸钙(CN)溶液间隔半小时依次滴加到上述溶液中。搅拌3 h 后,将所得溶液过夜陈化、洗涤、冷冻干燥,最后在650 ℃烧结3 h 得到MNBG 颗粒。为了制备不同粒径的 MNBGs,实验中改变模板剂DDA、前驱体TOES 的用量(表1)制备出不同粒径的MNBGs,分别简称为 MNBGs-1、MNBGs-2 和MNBGs-3。
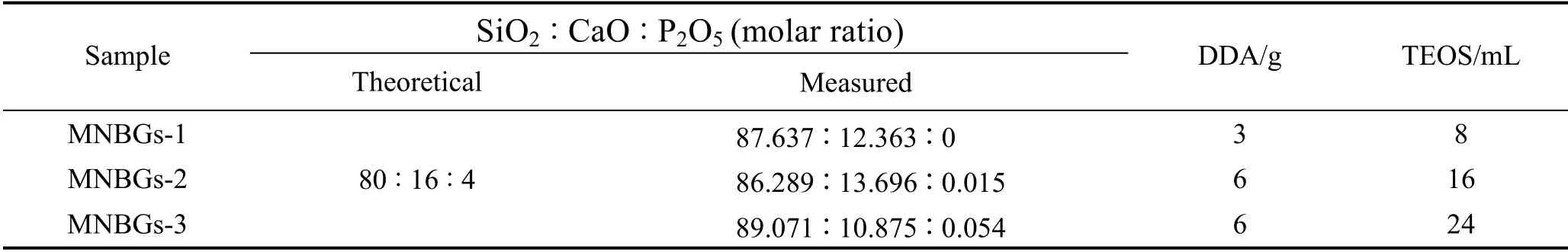
表1 不同粒径MNBGs 的理论、实际化学组分和试剂用量Table 1 Theoretical and measured chemical composition,reagent dosage of MNBGs with different particle sizes
1.2 牙本质切片样品的制备
在广州医科大学附属口腔医院颌面外科收集了健康人体第三磨牙80 颗,牙齿相关实验均通过该院的伦理审查。将收集到的牙齿及时处理清洗干净,然后用0.1%(w/v)的麝香草酚溶液浸泡,4 ℃保存备用。用硬组织切割机沿轴向切割牙齿,打磨制备成牙本质切片样品(5 mm×5 mm×2 mm),然后超声清洗置于麝香草酚溶液待用。考虑到牙本质结构中含有大量无机组分碳酸羟基磷灰石(HCA),对制备的牙本质切片样品用乙二胺四乙酸(EDTA)酸蚀去除其无机矿物,可以更真实地反映材料体外诱导牙本质矿化的能力[19]。
1.3 生物活性玻璃矿化材料在脱钙牙本质切片样品上固定
将不同粒径的 MNBGs 微球按粉液比为200 mg/mL 的比例分散到海藻酸钠-磷酸盐溶液中,超声处理使其进一步分散均匀,最后得到生物活性玻璃糊剂(MNBGP)。不同粒径MNBGs 制备的糊剂分别称为MNBGP-1、MNBGP-2、MNBGP-3。
对预备好的脱矿牙本质切片样品进行冲洗、灭菌、干燥,再将少量MNBGP 糊剂涂覆于脱矿牙本质切片样品上,自然晾干半小时,再用1 mL 去离子水冲洗3 次,晾干。
1.4 脱矿牙本质切片在人工唾液中再矿化
用GAL[20]提出的人工唾液 (AS) 配方,将涂覆有MNBGP 的脱矿牙本质切片样品浸泡在10 mL AS 溶液中,37 ℃恒温恒湿养护箱中静置;并将没有涂覆糊剂的牙本质切片样品进行类似处理设为对照组,每组设3 平行样。分别矿化1、7、14、28 d 后取出样品,用乙醇、水交替清洗三次,37 ℃烘干,进一步测试脱矿牙本质切片样品,评价不同MNBGP体外诱导牙本质再矿化形成羟基磷灰石的能力。
1.5 测试与表征
采用高分辨场发射扫描电子显微镜(FE-SEM,Merlin,ZEISS)观察样品的表面形貌,同时结合X 射线能谱分析(EDS)测定材料的化学组成。采用场发射透射电子显微镜(TEM,JEM-2100HR,JEOL)观察样品的微观结构。选取扫描电镜图片中颗粒(至少100 个),采用ImageJ 软件进行测量,统计其粒径结果。通过射线衍射分析仪(XRD,X'Pert ³ Powder X,PANalytical)测定样品的物相组成。采用傅里叶变换红外光谱仪(FT-IR,Vector33,Bruker)测定样品的化学结构。
2 结果与讨论
2.1 MNBG 形貌和结构
通过改变模板剂 DDA 和前驱体TEOS 用量,成功制备出不同粒径的微纳米生物活性玻璃微球(MNBGs),图1为不同粒径MNBGs 的SEM 照片、TEM 照片和粒径分布图。从SEM 照片(图1(a1~c1))中可以观察到,三种不同粒径的MNBGs 颗粒均呈规则的球形;微球表面表现出小颗粒堆积的粗糙结构。从TEM 照片(图1(a2~c2))可以观察到,不同粒径的MNBGs 为实心结构,且均具有良好的分散性。从粒径分布图(图1(a3~c3))可以观察到,三种MNBGs的粒径分布均较窄,说明三种MNBGs 尺寸分布较均匀,平均粒径分别为300、700 和1100 nm。

图1 不同粒径的微纳米生物活性玻璃球的SEM(a1~c1)、TEM(a2~c2)照片和粒径分布图(a3~c3)Fig.1 SEM (a1-c1),TEM (a2-c2) images and particle size distributions (a3-c3) of MNBGs with different particle sizes
进一步分析制备的MNBGs 物相组成和化学结构,图2为三种MNBGs 的XRD、FT-IR 图谱。从XRD 图谱可以观察到(图2(a))三种MNBGs 的峰形相似,在2θ=23°附近呈现弥散衍射峰,这与非晶态硅酸盐的特征衍射峰相对应[21],结果表明改变粒径对其非晶态结构并无显著影响。从FT-IR 图谱(图2(b))可以观察到,不同粒径的MNBGs 图谱同样具有相似性,在1090、800 和475 cm-1处的吸收带分别与Si-O-Si 的非对称伸缩振动、对称伸缩振动和对称弯曲振动峰对应[22],且三种大小颗粒的峰位均未发生显著的偏移,表明MNBGs 的化学结构也不受颗粒粒径变化的影响。

图2 三种微纳米生物活性玻璃球的 XRD 图谱(a)和FT-IR(b)图谱Fig.2 XRD patterns (a) and FT-IR spectra (b) of MNBGs
2.2 MNBGs 与脱矿牙本质切片样品结合
牙本质切片酸蚀(EDTA 处理)前后的SEM 照片如图3,能谱分析结果如表2。可以观察到(图3(a)),酸蚀前牙本质切片样品的表面牙本质小管暴露,表面留下少量切割凹痕,制备的牙本质切片牙本质小管的内径约1~2 μm,而自然牙本质-釉质界面处正常小管直径为0.5~0.9 μm[15],其直径差异是由于切片样品切割时更靠近牙齿颈部,稍远于牙冠;EDS能谱分析结果表明酸蚀前牙本质切片表面含有较多钙、磷元素,Ca/P 比值为 1.45(如表2),其比值与羟基磷灰石的Ca/P 理论值 (1.67)接近[19,23]。经EDTA酸蚀处理后(图3(b)),切片表面变得更加光滑,小管直径略微增加,这是由于EDTA 酸蚀脱去牙本质小管壁的无机矿物,仅剩少量胶原纤维等有机物(如图3(b)插图),牙本质小管壁变薄,进而增大牙本质小管直径。对比酸蚀后牙本质切片EDS 能谱分析,发现切片表面钙、磷含量极低,对应Ca/P 比值仅为0.35,远小于1.67,说明EDTA 酸蚀处理对牙本质切片表面的无机矿物成功完成了脱矿。

表2 牙本质切片表面EDTA 酸蚀前后各元素含量(摩尔分数)及钙磷比Table 2 Chemical components (molar percent) and Ca/P ratio on the surface of dentin before and after EDTA etching

图3 牙本质切片样品酸蚀前(a)后(b)的SEM 照片(插图为牙本质小管放大照片)及生物活性玻璃糊剂实物照片(c)Fig.3 SEM images of the dentin surface without (a) and with (b) EDTA-etching,magnified photo of dentin tubules (insert in (b)),and photo of bioactive glass paste (c)
制备的生物活性玻璃糊剂(MNBGP) (图3(c))具有良好的操作性。用MNBGP 涂覆脱矿牙本质切片样品表面的SEM 照片如图4所示。从图中可以观察到,由于MNBGP 液相含有一定量海藻酸钠,使得糊剂具有黏性,促进MNBGs 更好地粘附在脱矿牙本质切片表面。图4显示,粒径较小的 MNBGs 能更均匀分布在脱矿牙本质切片表面(图4(a)),随着MNBGs 粒径增加,逐渐形成团聚体,产生的空隙也相应增大,MNBGs 在脱矿牙本质切片表面的分布也更不均匀(图4(c))。此外,海藻酸钠富含的羧基能够与Ca2+发生离子交联,形成网络结构[24-25],因此,海藻酸钠能够与生物活性玻璃等相互作用,同时促进矿化的磷灰石层与牙本质切片结合。
进一步对MNBGP 涂覆前后以及用去离子水冲洗后的脱矿牙本质切片样品进行全反射-红外光谱(ATR-FTIR)分析(图5),由图可知,未涂覆MNBGP的脱矿牙本质切片样品(对照组)的ATR-FTIR 光谱无明显的P-O 吸收峰,表明酸蚀处理后,切片表面无机组分基本除去,结果也与EDS 能谱分析对应;与对照组(涂覆MNBGP 处理)相比,涂覆后脱矿牙本质切片表面的 ATR-FTIR 光谱在800、1090 cm-1处均出现了明显的Si-O-Si 特征吸收峰[26];进一步用离子水冲洗处理,脱矿牙本质切片表面仍然保留Si-O-Si特征对应吸收峰,且峰位无明显偏移,表明MNBGP 与脱矿牙本质切片仍结合紧密,MNBGs 能较好地黏附。进一步对图5(b,c)分析,脱矿牙本质切片表面的特征峰强度(800、1090 cm-1)经去离子水冲洗后较冲洗前强度降低,可能是由于部分 MNBGs被冲掉从而减弱了特征峰强度。

图5 脱矿牙本质切片表面涂覆不同MNBGP 前后,以及去离子水冲洗后的全反射-红外光谱Fig.5 ATR-FTIR spectra of demineralized dentin surface before and after coating with MNBGP,and after rinsing with water
2.3 MNBGs 体外诱导牙本质再矿化
在人工唾液中对未涂覆糊剂(对照组)和涂覆不同MNBGP 糊剂(实验组)的脱矿牙本质切片进行体外磷灰石形成能力评价,脱矿牙本质切片表面矿化不同时间的SEM 照片如图6所示。从图6(a1~a4)可以观察到,对照组样品矿化后,由于表面的无机矿物晶体已经酸蚀脱去,无法吸附Ca2+和PO43-,进而阻碍矿化结晶形成类羟基磷灰石[27],矿化前后牙本质小管仍呈开放状态,表明脱矿后牙本质切片无法自行矿化形成足够的羟基磷灰石以封闭牙本质小管,这也与天然过敏牙本质较难自矿化缓解牙本质症状相一致。从图6(b1~d1)可以观察到,脱矿牙本质切片表面涂覆MNBGP 后,部分MNBGs 颗粒可以直接填充并堵塞开放的牙本质小管,隔绝外界刺激;随着脱矿牙本质切片在人工唾液中矿化时间延长,MNBGs 在人工唾液进行离子交换,Ca2+、PO43-局部达到饱和,促进HA 在MNBGs 和脱矿牙本质切片表面沉积(图6(b2~d2)和图6(b3~d3)),矿化到第28 d 时,糊剂涂覆的脱矿牙本质切片表面基本被HA 完全覆盖(图6(b4~d4))。矿化前期,MNBGs 颗粒物理充填开放的牙本质小管,阻隔牙本质小管与外界环境,从而保护牙髓组织及牙髓神经;在人工唾液中矿化一段时间后,MNBGs 通过化学沉积HA 层彻底隔绝牙本质与人工唾液。比较不同MNBGP 糊剂处理组(图6(b~d))照片,可以观察到不同MNBGP对牙本质小管封闭及诱导牙本质再矿化的能力有差异,其顺序对应: MNBGP-2>MNBGP-1>MNBGP-3。其顺序不完全与 MNBGs 粒径大小对应,推测MNBGP 诱导牙本质再矿化的能力受玻璃颗粒直径和玻璃颗粒自身矿化活性的综合作用,一方面只有颗粒大小与暴露的牙本质小管口径相匹配(颗粒大小与牙本质小管直径相近或略小于小管直径)才能更好地物理堵塞以封闭牙本质小管;另一方面生物活性玻璃自身矿化活性越高,化学作用沉积的HA 更多,其封闭效果也越好。
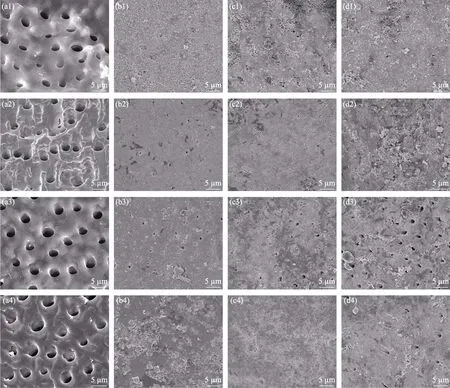
图6 未经材料处理(对照组)(a)和涂覆MNBGP-1(b)、MNBGP-2(c)、MNBGP-3(d)的脱矿牙本质切片在人工唾液中浸泡1 d (a1~d1)、7 d (a2~d2)、14 d (a3~d3)和28 d (a4~d4)后的表面SEM 照片Fig.6 SEM images of the surfaces of demineralized dentin slices without (a) (control) and with treatment by MNBGP-1 (b),MNBGP-2 (c),and MNBGP-3 (d) after soaking in AS for 1 d (a1-d1),7 d (a2-d2),14 d (a3-d3) and 28 d (a4-d4)
图7为脱矿牙本质切片样品在人工唾液中矿化不同时间后的纵截面(平行牙本质小管方向)SEM照片,对照组的脱矿牙本质切片的截面照片显示,牙本质小管内壁及截面边缘均没有形成明显矿化物,表明切片脱矿后在人工唾液中无法自发矿化封闭牙本质小管。与对照组相比,经MNBGP 涂覆过的脱矿牙本质切片截面边缘的牙本质小管内充填有MNBGs 颗粒,牙本质小管被紧密堵塞,通过小管内外MNBGs 进一步的矿化作用,牙本质小管管口处沉积一层HA,进一步封闭并隔绝外界刺激;随矿化时间进一步延长,MNBGP 涂覆过的脱矿牙本质切片表面沉积更厚的HA 层,矿化28 d (图7(a4,b4,c4)),HA 层最厚可达5~10 μm[28]。

图7 未经材料处理(a)和涂覆MNBGP-1(b)、MNBGP-2(c)、MNBGP-3(d)的脱矿牙本质切片在人工唾液中浸泡1 d (a1~d1)、7 d (a2~d2)、14 d (a3~d3)和28 d (a4~d4)后的纵截面的SEM 照片Fig.7 SEM images of the longitudinal section of demineralized dentin samples without (a) (control) and with treatment by MNBGP-1 (b),MNBGP-2 (c),and MNBGP-3 (d) after soaking in AS for 1 d (a1-d1),7 d (a2-d2),14 d (a3-d3) and 28 d (a4-d4)
图8为脱矿牙本质切片样品矿化28 d 后的表面能谱扫描分析。矿化28 d 后,脱矿牙本质切片样品表面Ca、P 元素均有所增加,且实验组显著高于对照组,其中玻璃颗粒尺寸较小的组(MNBGP-1 和MNBGP-2 处理组)钙、磷元素含量变化更显著,具体Ca、P参数见表3。结果表明MNBGP-1和MNBGP-2组Ca、P 含量明显提高,其Ca/P 比值也最接近天然牙本质的1.67,说明涂覆MNBGP 糊剂能较好地诱导脱矿牙本质的再矿化,粒径较小的 MNBGs 组糊剂涂覆脱矿牙本质切片后,其矿化形成的HA 晶体结构更接近天然牙本质。值得注意的是,矿化后对照组的Ca、P 含量仍较少,但是其Ca/P 比值同样与天然牙本质的Ca/P 比近似,表明在人工唾液环境下,牙本质自身也可能发生少量再矿化,但是由于磷灰石沉积过少无法通过SEM 直接观察到,这也与前面对照组矿化28 d 的SEM 照片仍显示大量暴露牙本质小管对应。
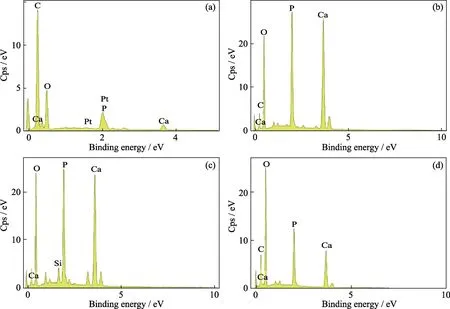
图8 对照组(a)和MNBGP-1(b)、MNBGP-2(c)、MNBGP-3(d)涂覆的脱矿牙本质切片在人工唾液中矿化28 d 表面的EDS 能谱分析Fig.8 EDS analyses of the surface of demineralized dentin slices without (a) (control) and with treatment by MNBGP-1 (b),MNBGP-2 (c),and MNBGP-3 (d) after soaking in AS for 28 d

表3 脱矿牙本质切片表面钙、磷元素含量(摩尔分数)及钙磷比Table 3 Chemical components ( molar percent) and Ca/P ratio in molar on the surface of remineralized dentin
对脱矿牙本质切片矿化28 d 的表面物相结构进行XRD 分析(如图9)。从图谱中可以看出,与天然牙本质对比,脱矿牙本质表面的HA 特征峰强度降低,衍射峰数量减少,特别是(002)、(211)、(112)和(202)晶面衍射峰。矿化 28 d 后,对照组(没有糊剂处理)及糊剂处理过的脱矿牙本质切片样品表面均出现HA 特征衍射峰: 对照组HA 特征衍射峰较少,仅少量对应(002)、(211)和(112) 晶面且峰强较小;涂覆不同MNBGP 糊剂后的脱矿牙本质切片表面则出现更多HA 特征衍射峰: 对应(002)、(211)、(112)、(300)、(202)、(310)、(222)、(213)和(004)晶面[29],衍射峰显著增强,其峰位与峰强也更接近天然牙本质,表明脱矿牙本质切片经 MNBGP 处理和一定时间(28 d)矿化可形成晶体结构类似天然牙本质的HA 层。值得注意的是,生物玻璃粒径较小的 MNBGP-1 和MNBGP-2 组的衍射峰强度最大,说明MNBGP-1 和MNBGP-2 组处理脱矿牙本质切片诱导形成的 HA数量更多,其结果也与SEM 和EDS 分析结果一致。另外,与矿化前的牙本质相比,实验组矿化后图谱出现CaCO3的(104)[30]晶面特征衍射峰强度显著增强,可能是因为在人工唾液的矿化过程中,涂覆糊MNBGP 剂的牙本质切片局部快速释放更高浓度Ca2+,形成了更多的CaCO3晶体。
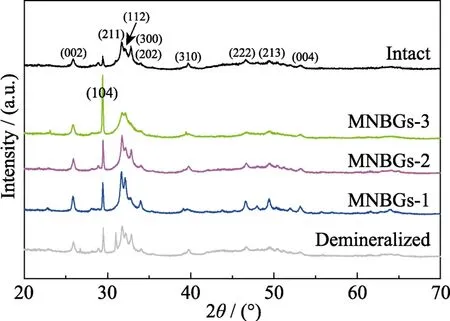
图9 天然牙本质、脱矿牙本质和在人工唾液中浸泡28 d的脱矿牙本质切片样品表面的XRD 图谱Fig.9 XRD patterns of the surface of intact dentin,demineralized dentin and slices without treatment (control) and being treated with MNBGP after being soaked in AS for 28 d
3 结论
以不同粒径的微纳米生物活性玻璃微球为分散质海藻酸钠-磷酸盐缓冲溶液为分散剂,成功制备了便于操作的新型生物活性玻璃糊剂用于牙本质脱敏。不同粒径微纳米生物活性玻璃微球制备的糊剂均能与牙本质界面紧密结合,含尺寸较小微纳米生物活性玻璃微球的糊剂在脱矿牙本质切片表面分布得更均匀。微纳米生物活性玻璃微球制备的糊剂在人工唾液中能较好地诱导牙本质再矿化形成磷灰石以堵塞封闭牙本质小管,脱矿牙本质切片表面形成的磷灰石层随矿化时间延长而增厚,矿化28 d 时磷灰石层的厚度可达到5~10 μm。糊剂中生物活性玻璃微球的尺寸与暴露的牙本质小管直径相当或略小时可以更好地填充、矿化封闭牙本质小管。本研究证实微纳米生物活性玻璃微球材料将在牙本质脱敏方面具有较好潜在应用前景。
猜你喜欢
杂志排行
无机材料学报的其它文章
- Effects of Residual Stresses on Strength and Crack Resistance in ZrO2 Ceramics with Alumina Coating
- Microstructure and Corrosion Behavior of Brazed Joints of SiC/SiC Composites and Hastelloy N Alloy Using Cu-Ni Alloy
- Reversible Conversion between Space-confined Lead Ions and Perovskite Nanocrystals for Confidential Information Storage
- 生物活性玻璃-二氧化锰复合支架的制备与表征
- 2D SiC/SiC复合材料电阻率对服役环境的响应特性
- 碳纳米管内填充生长超细一维亚化学计量比氧化钨纳米线
