银杏类黄酮合成关键基因的鉴定和GbANR2的基因的克隆
2022-06-29季雅菲
季雅菲
(中国农业大学,北京 100089)
1 引言
1.1 背景介绍
银杏(Ginkgo bilobaL.)俗称“白果”,为我国特有珍贵树种,在植物界享有“活化石”之称,集生态防护、观赏、经济等价值为一体,具有良好开发前景和研究价值[1]。
类黄酮是大多数植物中含量较多的一类次生代谢物,原花青素是类黄酮中的主要成分之一,主要由花青素还原酶(ANR)调控合成[2]。由于原花青素等黄酮类化合物能为农作物提供良好性状,提高食品的保健作用,还可以为转基因材料着色[3],故而该类化合物的合成途径的相关研究逐渐受到人们的关注。
1.2 研究目的及意义
近年来,研究者已经相继从一些植物中,如杉木、拟南芥中克隆了ANR 基因,并进行了相关的遗传和生化研究,但是银杏GbANR2基因的克隆与表达分析的分子机制鲜有报道[4-5]。本研究以类黄酮合成途径为切入点,通过基因共表达分析鉴定出合成途径中的关键结构基因,对关键基因GbANR2进行了基因克隆,并对其进行生物学分析。本研究将为明确GbANR2对银杏类黄酮的合成的作用提供理论基础,为定向培育高类黄酮含量的优质银杏植株提供理论基础。
2 材料方法
2.1 银杏黄酮类化合物合成相关结构基因的共表达分析
从NCBI Sequence Read Archive(SRA)数据库(https://github.com/ncbi/sra-tools)中下载126 个银杏样本的高质量转录组(RNA-seq)数据,对其进行数据处理获得126 个样品中所有基因的表达数据[7-8]。将通过KEGG 鉴定出的银杏类黄酮合成途径中的48个结构基因进行基因共表达分析,计算所有基因之间的皮尔森相关系数(PCC),筛选PCC>0.75 的基因,并利用Cytoscape软件实现基因的共表达网络的可视化。
2.2 GbANR2基因克隆
2.2.1 试验试剂
本试验所用的主要试剂有:RNA 试剂盒(Omega,R6827-01,广州)、反转录MonScript™RTIII All-in-One Mix with dsDNase 试剂盒、Phanta®Max Super-Fidelity DNA 高保真酶试剂盒、大肠杆菌感受态细胞(Tsingke,TSC01,北京)、DL5000DNA Marker(Tsingke,TSJ012-500,北京)、pClone007 Blunt Simple Vector Kit载体试剂盒、TAE溶液、ddH2O无菌水。
2.2.2 基因克隆
(1)RNA 提取及纯度测定。试验过程中的RNA 提取步骤按照试剂盒(Omega,R6827-01,广州)说明进行。摘取银杏幼叶,磨样、涡旋、孵育、离心、涡旋,直至所有样品转移到色谱柱中。加入RWF洗涤缓冲液,丢弃滤液和收集管。
(2)引物设计。提取DNA 甲基化相关基因CDS 序列,使用Primer Primier 程序设计引物,采用直接扩增的方式进行克隆。正向引物(5’-3’)为ATGGCACCGCAGGCTTATCC,反向引物(5’-3’)为TTAGCAGGTAAGCAAGCCCTTGG。
(3)目的片段凝胶回收。切下含目的DNA 片段凝胶,加入等倍体积的Buffer GDP,水浴,短暂离心,将FastPure DNA Mini Columns-G 吸附柱置于Colletion Tubes 2 mL 收集管中,将≤700 μL的溶胶液转移至吸附柱中,将滤液弃除,吸附柱置于收集管中。静置,滤液弃除,重复前一步骤,将吸附柱置于在离心管中,加入Elution Buffer 至吸附柱中央,静置,弃去吸附柱,离心管存于-20°C。
(4)目的片段连接与转化。取100 μL大肠杆菌感受态细胞,加入连接产物,静置。将其放入水浴中激活45 s,静置。加入无抗性SOC/LB 培养液,摇1 h。将复苏液涂抹至含氨苄青霉素(Amp)的培养基上,倒置过夜12~16 h。
2.3 GbANR2生物信息学分析
2.3.1GbANR2基因结构分析及染色体定位
基于银杏基因组数据库中基因的位置信息,运用TBtools软件实现目的基因的基因结构的可视化。
2.3.2GbANR2蛋白结构预测
利用SWISS-MODEL 在线软件分析银杏ANR 蛋白三维结构模型,并与蛋白质二级结构预测结果进行比较。
2.4 GbANR2在银杏不同组织中的表达
选取银杏成年根(R)、成年茎(S)、未成熟叶片(IL)、成熟叶片(ML)、雌球果(OS)、大孢子叶球(M)、未成熟果实(IF)与成熟果实(MF),利用GraphPad 进行作图,分析GbANR2 在银杏不同组织中的表达量。
3 结果分析
3.1 基因共表达分析鉴定银杏类黄酮合成途径的核心结构基因
利用处理后的126 个银杏公共转录组数据[6],对48 个类黄酮合成结构基因进行共表达分析(PCC>0.75),筛选出12个高度相关的核心基因[7],这些基因在类黄酮合成中发挥重要作用,现将其定义为参与类黄酮合成的核心基因。分别为CHS5、4CL2、DFR2、F3’H1、ANR3、PAL4、CHS1、ANS1、ANR2、CHI、CHS4、F3H1。
3.2 GbANR2基因克隆
3.2.1 目的基因的扩增与纯化
以cDNA 为模板,利用Phanta® Max Super-Fidelity DNA Polymerase 进行GbANR2(Gb_10028)基因克隆,如图1,将所有的PCR 产物进行电泳检测并且进行切胶回收、转化和阳性克隆鉴定。
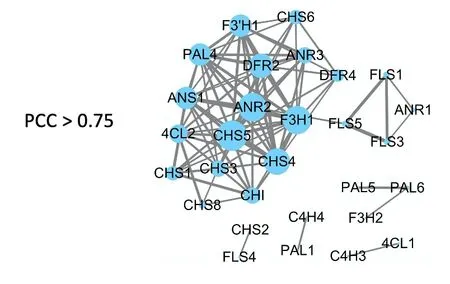
图1 类黄酮通路相关核心结构基因的共表达分析Fig.1 The analysis on coexpression of core structure genes relatedto flavonoid pathway
3.2.2 克隆序列比对
将擎科公司测序结果使用NCBI 网站进行分析,将测序结果与原DNA 序列输入进行比对,根据多序列比对结果可知,克隆序列与目的基因的序列完全相同,大小为1029bp,编码341个氨基酸。
3.3 GbANR2的生物信息学分析
3.3.1GbANR2的基因结构和染色体定位
运用TBtools 进行基因结构可视化分析,得出GbANR2基因分布在3号染色体上,具有4个内含子、5个外显子,长度为1029bp。通过DANMAN 软件对GbANR2碱基序列进行翻译,得到由341个氨基酸组成的蛋白质。
3.3.2GbANR2同源性分析
使用Blast 将GbANR 序列与其它植物的ANR 基因序列进行比对,结果显示GbANR 基因的核苷酸序列与其它植物的ANR基因的核苷酸序列同源性非常高,尤其是裸子植物的白云杉和北美云杉,相似性分别为74.44%和74.24%,说明GbANR 与来自裸子植物的ANR 具有较近的亲缘性。此外,GbANR 与日本柳杉、野茶树、苹果的相似性依次为72.59%,65.32% 和64.99%。因此,从蛋白质序列比较结果推测GbANR正是银杏ANR基因家族成员之一。
3.3.3GbANR2蛋白结构预测
通过SOPMA 预测蛋白质的二级结构,结果显示,GbANR2蛋白结构中α 螺旋有141 个氨基酸,所占比例为41.23%;β 转角有27 个氨基酸,所占比例为7.89%,延伸链(Extended strand)有50 个氨基酸,所占比例为14.62%,无规则卷曲(Random coil)有124 个氨基酸,所占比例为36.26%。使用Swiss-model 对GbANR2蛋白的三级结构进行预测,结果显示,GbANR2以花青素还原酶为模板构建,两者蛋白的三级结构相似性为59.16%,模型主要包括12 个α 螺旋与10个β 转角。
3.4 GbANR2在银杏不同组织中的表达
银杏发育过程中,GbANR2基因在根、茎中表达量较低,而生长初期相反,表达量较高,而后又迅速下调,使花青素得以积累。在不同的银杏组织中,ANR 基因的表达量均有所不同,依次是IF>OS>IL>MF>R>S>ML>M ,表达量结果差异显著。
4 结语
本研究从银杏公共数据库中下载了银杏转录组数据126个,对原始数据进行处理和均一化,以皮尔森相关系数PCC>0.75 为标准,鉴定出12 个关键核心基因。其中GbANR2基因与其它基因的相互调控关系较为紧密,对该基因进行了克隆,并对其在染色上位置、基因结构、蛋白结构,以及在不同组织中的表达量进行了分析。研究表明ANR基因在在根、茎中的表达量较低,在叶、果实中的表达量较高,ANR基因在植物特定器官表达中起重要作用。
类黄酮在银杏叶中具有重要作用,因此研究银杏类黄酮代谢途径,并利用相关基因进行有效的调控是获得高产类黄酮的基础。本研究鉴定了银杏类黄酮合成关键基因,克隆了银杏GbANR2基因。为了更好得进行后续研究,可以从银杏幼叶中选取表达量较高的其它核心基因进行克隆,为研究银杏类黄酮合成途径提供丰富的理论依据。
