细胞角蛋白的表达水平与结直肠癌临床病理学特征的相关性研究
2022-06-29熊中原曹邦伟
司 海 刘 然 熊中原 曹邦伟
(1.潍坊医学院肿瘤学教研室,山东潍坊 261053;2.北京市平谷区医院病理科,北京 101200;3.首都医科大学附属北京友谊医院肿瘤中心,北京 100050)
结直肠癌(colorectal cancer,CRC)是全球最常见的消化道恶性肿瘤之一,其发病率和病死率居高不下。据2020年全球癌症统计数据[1]显示:其发病率和病死率在所有恶性肿瘤中分别位列第3位(10.00%)和第2位(9.40%);在中国,结直肠癌在所有恶性肿瘤中的发病率和病死率分别位列第2位(12.20%)和第5位(9.50%)[2]。因此,探究新的分子标志物对提高结直肠癌的预后判断与诊疗具有重要意义。
细胞角蛋白(cytokeratin,CK)是上皮细胞骨架的主要组成部分,主要作用是维持上皮组织的稳定和完整,同时也是诊断病理学中用于检测和分类上皮源性肿瘤的特异性标志物[3-6]。腺癌一般以单层上皮细胞角蛋白为主,特别是CK7、8、18~20[7]。因此,CK的表达有可能作为结直肠癌较为理想的辅助诊断指标。本研究检测了结直肠癌及配对的癌旁正常组织中CK7、8、18~20的表达并分析其差异,目的是探究其在结直肠癌组织中的表达与患者临床病理学特征的关系。
1 对象与方法
1.1 研究对象
选取北京市平谷区医院2013年至2021年行结直肠癌根治术患者的病理组织蜡块标本。纳入标准:①经病理学确诊为结直肠癌;②首次手术,且术前均未行放射治疗(以下简称放疗)、化学药物治疗(以下简称化疗)及靶向治疗。③病例资料完整。排除标准:合并其他原发恶性肿瘤者。最终纳入200例,其中男性100例、女性100例。本研究经市平谷区医院医学伦理委员会批准。
1.2 免疫组织化学法检测结直肠癌及癌旁组织中CK7、8、18~20的表达
所有标本均经10%(体积分数)甲醛固定,石蜡包埋,4 μm连续切片。免疫组织化学法采用MaxVision法,石蜡切片经脱蜡、水化和冲洗,并用抗原修复缓冲液进行抗原修复。一抗为鼠抗人CK7(货号:YM3054)、CK8(货号:YM3055)、CK18(货号:YM6166)、CK19(货号:YM6577)和CK20(货号:YM6037)均购自Immunoway公司;二抗为MaxVision/HRP〗试剂(货号:KIT-5002)购自中国福州迈新生物科技有限公司。DAB显色,复染并封片。染色结果判断:根据染色强度和阳性细胞百分率分析CK7、8、18~20的表达水平[8]。染色判定标准为(细胞质着色情况):无着色,0分;弱着色(浅黄色)1分;中等强度着色(棕黄色)2分;强着色(棕褐色),3分。阳性细胞百分率的判定标准为:细胞质着色为黄色或棕褐色,阳性细胞百分率≤5%计0分,6%~25%计1分;26%~50%计2分;51%~75%计3分;≥76%计4分。最终评分为两项评分之积,并定义0~2分为阴性,3~12分为阳性。免疫组织化学法检测结果最终由两名经验丰富的病理学专家双盲判断,评分如有差异,取两者平均值。
1.3 统计学方法

2 结果
2.1 一般资料
纳入的200例患者,年龄27~89(65.69±10.46)岁,<65岁94例、≥65岁106例;结肠癌100例,直肠癌100例;高分化5例、中分化170例、低分化25例;淋巴结转移85例(42.50%)、远处转移6例(3.00%)。Ⅰ期33例(16.50%)、Ⅱ期75例(37.50%)、Ⅲ期86例(43.00%)、Ⅳ期6例(3.00%)。
2.2 CK7、8、18~20在结直肠癌与癌旁组织中的表达
CK7主要表达于细胞质,在癌组织中表达阴性(图1A);在癌旁组织中,1.00%(2/200)的病例呈阳性表达,差异无统计学意义(P=0.478)。CK8主要表达于细胞膜和细胞质,在癌组织中有99.00%(198/200)的病例阳性表达(图1B);在癌旁组织中,91.50%(183/200)病例阳性表达,差异有统计学意义(P<0.001)。CK18主要表达于细胞质,在癌组织中有94.50%(189/200)的病例表达阳性(图1C);在癌旁组织中有25.00%(50/200)的病例表达阳性,差异有统计学意义(P<0.001)。CK19主要表达于细胞质,在癌组织中有8.00%(16/200)的病例表达阳性(图1D);在癌旁组织中有3.00%(6/200)的表达阳性,差异有统计学意义(P=0.028)。CK20主要表达于细胞质,在癌组织中有79.50%(159/200)的病例阳性表达(图1E);在癌旁组织中有11.00%(22/200)的病例表达阳性,差异有统计学意义(P<0.001)。详见表1。
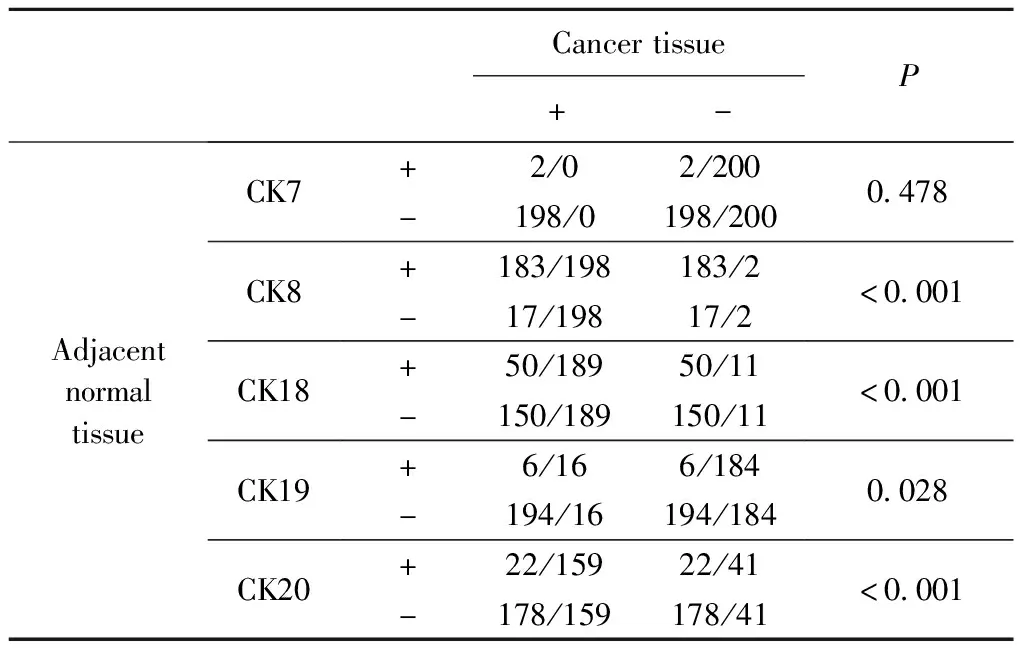
表1 结直肠癌癌组织和癌旁正常组织中CK7、8、18~20的表达
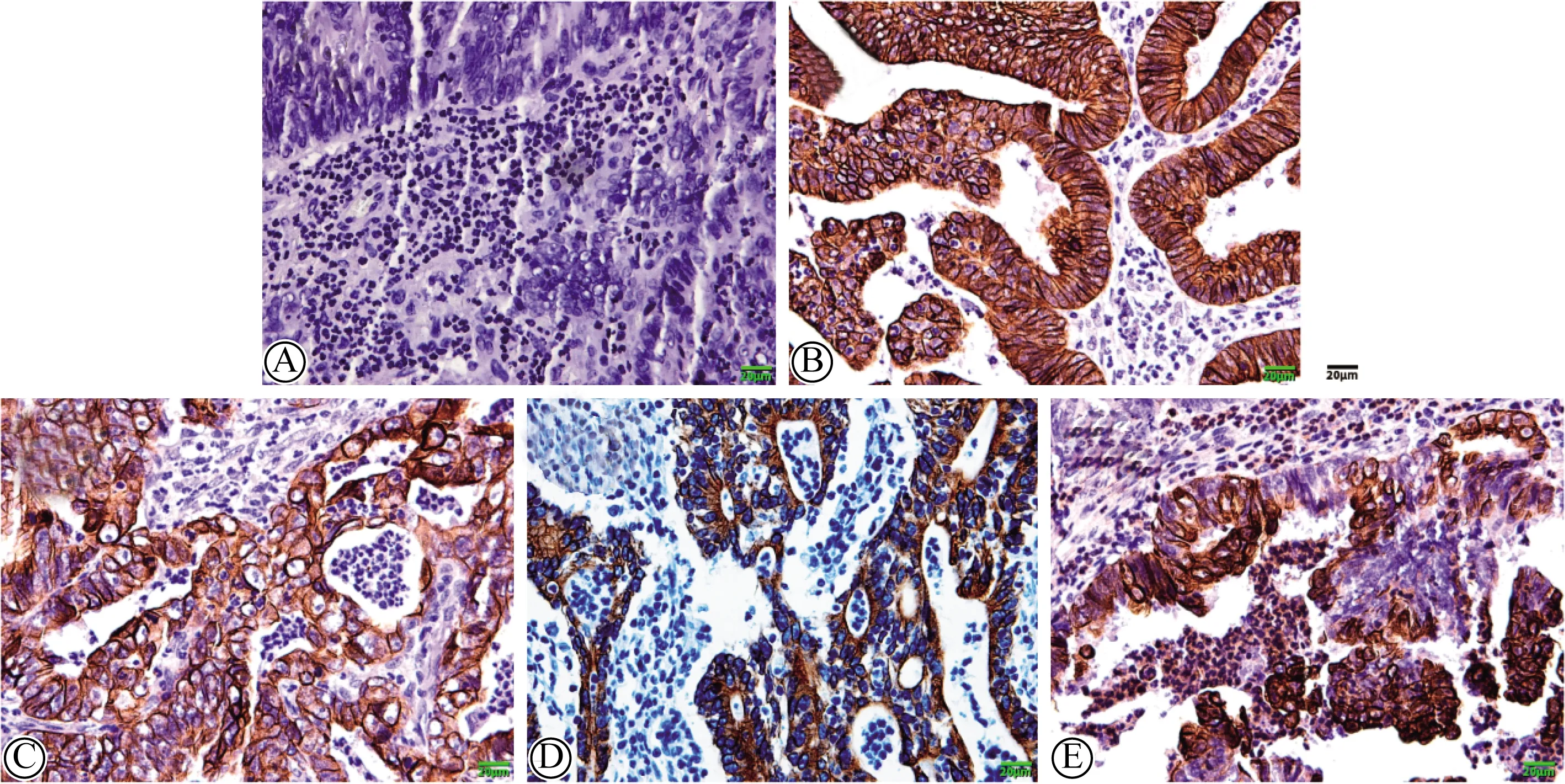
图1 CK7、8和CK18~20在结直肠腺癌组织中的表达
2.3 CK7、8、18~20的表达与结直肠癌患者临床病理特征的关系
CK7在癌及癌旁组织中均缺乏表达,差异无统计学意义,与患者临床病理特征不相关。CK8和CK18~20的表达与患者的性别、年龄、肿瘤部位、肿瘤大小、远处转移及TNM分期无关。CK8与肿瘤的浸润深度相关(P=0.048),当肿瘤穿透固有肌层到达浆膜下层时,CK8的阳性表达率更高。CK19与肿瘤有无发生淋巴结转移相关(P=0.027),发生淋巴结转移的肿瘤患者,CK19的阳性表达率更高。CK20与肿瘤的分化程度相关(P=0.010),在中高分化的肿瘤组织中,CK20阳性表达率更高。详见表2。
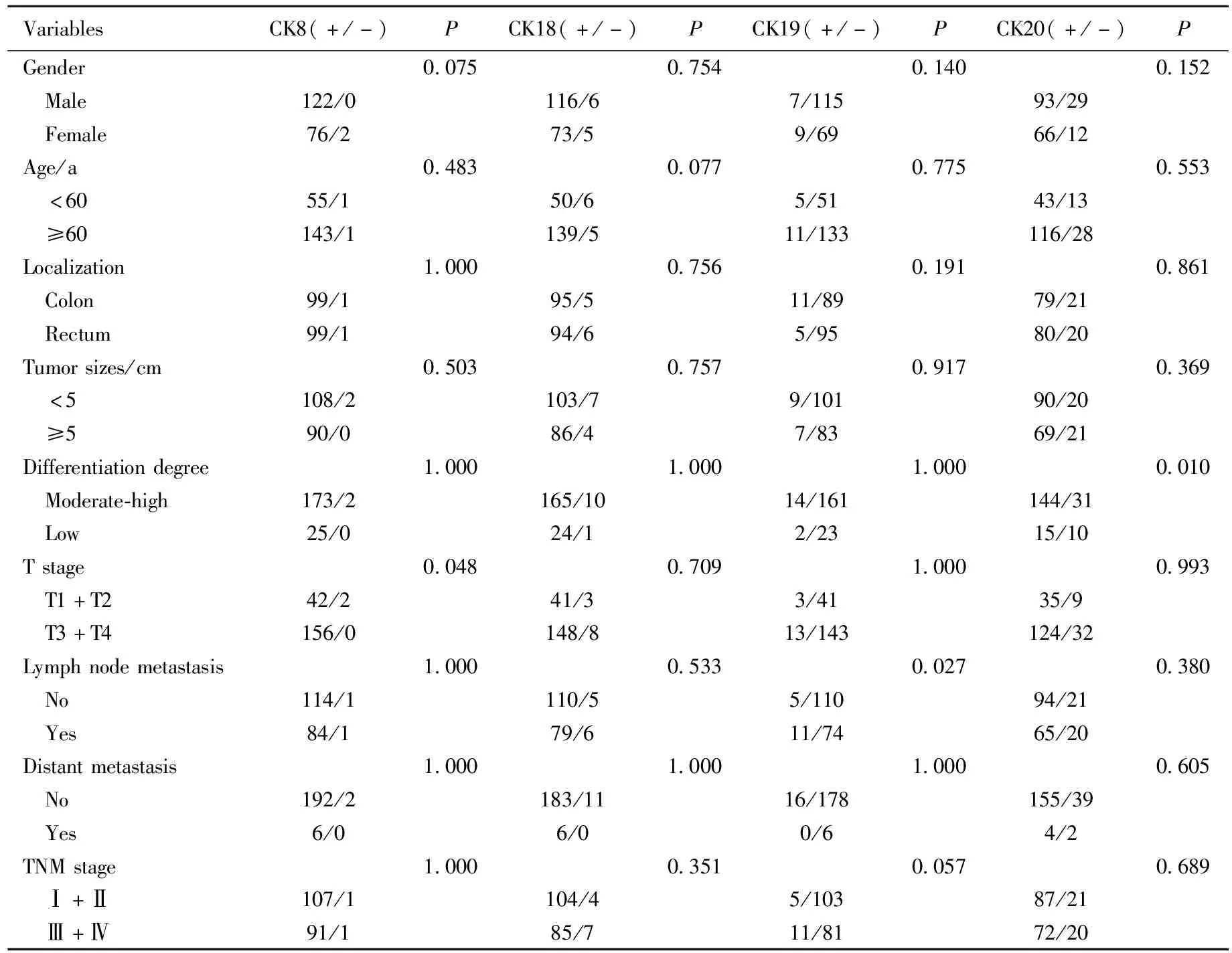
表2 结直肠癌患者癌组织中CK8、18~20的表达与临床病理特征的关系
2.4 结直肠癌危险因素的Logistic回归分析
以结直肠癌为因变量纳入条件Logistic回归分析,单因素结果显示,CK8、CK18~20阳性为患结直肠癌的危险因素。多因素Logistic回归分析结果显示,CK18和CK20阳性为患结直肠癌的独立危险因素。详见表3。
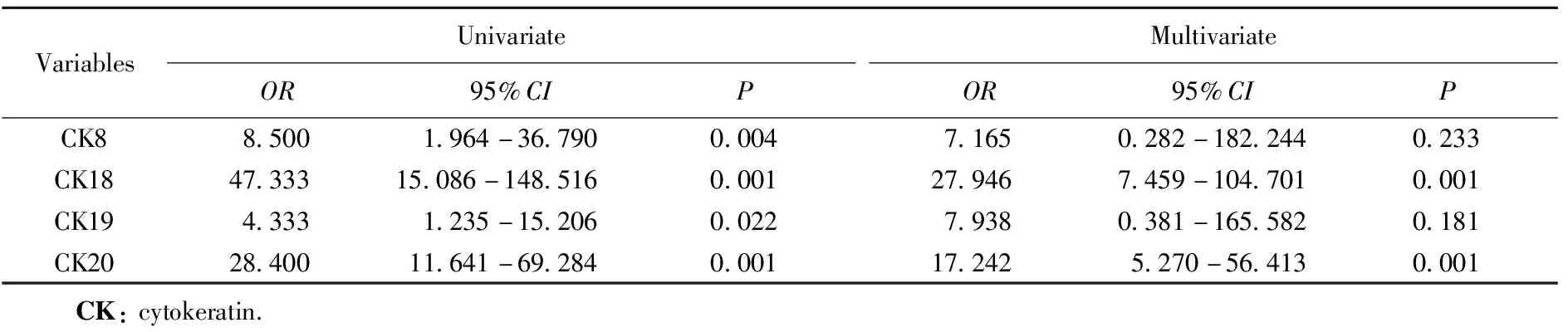
表3 结直肠癌危险因素的Logistic回归分析
3 讨论
细胞角蛋白是临床上常见的肿瘤标志物之一, 其与上皮细胞化生、恶变、肿瘤转移等病变有关[9-10]。CK根据等电点的不同分为酸性(Ⅰ型)和碱性(Ⅱ型)形式,Ⅰ型细胞角蛋白(CK9~CK20)相对分子质量小,呈酸性; 而Ⅱ型细胞角蛋白(CK1~CK8)相对分子质量较大,呈碱性。
本研究显示CK7在结直肠癌和癌旁组织中都缺乏表达,但有研究[11]显示在部分结直肠癌亚型中有表达,比如在BRAF突变的微卫星稳定型(microsatellite stable,MSS)结直肠癌中,有39%的病例表达CK7。目前关于CK8在结直肠癌中的研究较少,本研究发现CK8在结直肠癌组织中的表达阳性率高于癌旁组织且与肿瘤的浸润深度成正相关。但也有研究显示[12],CK8在结直肠癌中的低表达与肿瘤细胞发生上皮间质转化(epithelial-mesenchymal transition,EMT)有关,其低表达提示肿瘤具有更强的侵袭性且预后更差,并且CK8的表达与肿瘤的浸润、分化和淋巴结转移无关,造成这种差异的原因可能和本研究病例数目过少有关。在本研究中,CK18在结直肠癌组织中的表达阳性率高于癌旁组织,与肿瘤患者的临床病理特征关联性不高。也有研究[13-14]显示CK18过表达可促进PI3k-AKT信号通路及EMT,加快结直肠癌细胞的生长和侵袭转移,从而与癌症患者的生存率降低相关,可作为大肠癌患者预后的指标。有报道[15]称CK19作为敏感标志物可提高大肠癌的早期诊断,在本研究中也发现CK19在结直肠癌组织中的表达阳性率高于癌旁组织,同时其表达与肿瘤患者发生淋巴结转移成正相关,因此其高表达对于诊断和判断患者预后具有一定的参考意义。CK20在胃肠上皮细胞以及由这些细胞衍生的肿瘤中都有表达[16-17]。本研究结果显示,CK20在结直肠癌组织中的表达阳性率显著高于癌旁组织,并且其表达阳性率随着肿瘤分化程度的降低而降低。也有研究[18]显示,结直肠癌患者血清中CK20 mRNA的表达明显升高,可作为结直肠癌诊断的特异性血清标志物。
综上所述,CK7在结直肠癌癌组织和癌旁组织中都缺乏表达;CK8、18~20在癌组织中的表达高于癌旁组织,其在结直肠癌发生发展过程中可能起到一定的促进作用,并且其表达上调对于结直肠癌的诊断也具有一定的指导意义。笔者还发现CK18、CK19和CK20在癌组织中的表达分别与肿瘤的浸润深度、有无淋巴结转移和分化程度相关。因此CK在结直肠癌的发生、浸润和分化中可能起到一定的作用,从而对临床上判断结直肠癌的恶性程度起到一定参考意义。但因本研究病例数目较少,且未深入探究CK与结直肠癌患者预后的关系,具有一定的局限性,后期将会扩大样本量,探究其在结直肠癌患者预后中的作用及其机制。
