筑巢能力障碍小鼠模型筛选及神经病理变化
2022-06-29肖福川陈柏安
肖福川 吴 娜 张 静,3 陈柏安,3 卢 静,3*
(1.首都医科大学基础医学院实验动物学学系,北京 100069;2.首都医科大学基础医学院神经再生修复研究北京市重点实验室,北京 100069; 3.首都医科大学实验动物部, 北京 100069)
认知障碍是危害老年人健康的主要疾病之一[1],因其病程长、难逆转、暂无有效治疗方案,经常导致患者日常生活自理能力减退[2],并伴有各种神经精神症状和障碍,给患者家庭和社会带来极大负担[3]。目前对散发性认知功能障碍的根本病因尚不明确[1],对散发性认知障碍的治疗方法也缺乏针对性。
筑巢行为实验常用来评估认知障碍小鼠的日常活动[4]。该实验在对小鼠施加最小压力的同时,可以评估其精细动作的灵活性、认知和情绪状态[5]。对小鼠来说,高质量的巢穴可以保温、御敌,是一个保持安全感的重要场所[6]。小鼠的筑巢质量主要受遗传背景、环境温度、母性经验以及是否有幼仔等因素影响[7-9]。此外,小鼠的筑巢行为可分为集体筑巢和个体筑巢,集体筑巢反映的是小鼠的社会交互行为[10],而个体筑巢则反映了小鼠的执行功能。小鼠筑巢行为的机制目前尚不清楚,有研究者[11]推测其可能受到许多脑区和神经递质活动的控制。
临床上,认知障碍多是随着年龄的增长自然发生的,而不是外加诱导剂或者手术等方式导致的,所以研究与人类自发性认知障碍更相似的动物模型及其神经病理特征能更好地为探究自发性认知障碍疾病的病因和防治提供条件。
1 材料与方法
1.1 材料
1.1.1 实验动物
C57BL/6小鼠(000664-JAX)购于北京华阜康生物科技股份有限公司,实验动物许可证号:SCXK(京)2019-0008。本研究使用15月龄的C57BL/6小鼠39只,包括20只雌性和19只雄性,在首都医科大学实验动物部屏障环境[SYXK(京)2015-0012]饲养,经首都医科大学实验动物伦理委员会批准(批准号:AEEI-2015-020)。
1.1.2 主要试剂与仪器
筑巢所用的压缩纸片是由中生北动(北京)科技发展有限公司定制,规格为7.5 cm×8 cm,3 g/片。突触的标志物突触后密度蛋白95(postsynaptic density protein 95, PSD95;货号:PA5-85749)抗体购自美国Thermo公司;神经元树突的标志物微管相关蛋白2(microtubule-associated protein 2, MAP2; 货号:ab8130)抗体、神经元轴突的标志物神经丝蛋白重链(neurofilament heavy chian,NFH;货号:ab8135)抗体、神经元的标志物神经元核抗原(neuronal nuclei,NeuN; 货号:ab104224)抗体、星形胶质细胞的标志物胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP;货号:ab53554)抗体均购自英国Abcam公司;小胶质细胞的标志物离子钙接头蛋白1(ionized calcium bindingadaptor molecule 1, IBA1; 货号:011-27991)抗体购自日本和光纯药工业株式会社; 抗荧光淬灭封片剂(货号:P0126)、DAPI(货号:C1002)购于上海碧云天生物技术有限公司;EDTA抗原修复液、PBS缓冲液购自北京基谱生物科技有限公司;无水乙醇、二甲苯购于中国医药集团有限公司;全自动脱水机(SYD-T2070)、石蜡包埋机(SYD-B-F)、病理取材台(SYD-9804)、烘烤漂片机(SYD-PK)购自沈阳誉德电子仪器有限公司;石蜡切片机(Leica RM2016)购于德国莱卡公司;载玻片及盖玻片(10127105P-G)购于江苏世泰实验器材有限公司;温控摇床(TS-2000A)购于海门市其林贝尔仪器制造有限公司;倒置荧光显微镜(Nikon Eclipse Ti-SR)购于日本尼康公司;全景扫描仪(Pannoramic MIDI)购于匈牙利3D HISTECH公司。
1.2 方法
1.2.1 筑巢
将实验小鼠单独饲养,移除所有的环境强化物品,在每个笼子里放一个3.0 g的方形压缩棉片(Nestlets)。48 h后,用筑巢五分评级量表[4]评估筑巢情况,具体评分标准详见表1。称量所有未使用的Nestlets质量,精确到0.1 g(约Nestlets质量的4%)。

表1 筑巢实验评分标准(方法)[4]
1.2.2 免疫荧光染色
将实验组(15月龄野生型小鼠)中筑巢障碍的小鼠与筑巢表现良好的小鼠,进行麻醉、心脏灌注后取脑,使用4%(质量分数)多聚甲醛液将组织固定,脱水包埋后进行切片,厚度为4 μm。脱蜡、抗原修复后加5%(体积分数)的正常山羊封闭血清室温孵育 20 min。弃去封闭血清后,加入一抗(稀释比为1∶250)孵育过夜。滴加与一抗相应种属的二抗覆盖切片(兔二抗bs-0295G-FITC和羊二抗bs-0294D-cy3 稀释比均为1∶400),避光室温孵育60 min。加入DAPI染液,避光室温孵育10 min。用抗荧光淬灭封片剂封片。取景拍照。
1.2.3 分组方法
1.3 统计学方法

2 结果
2.1 老龄小鼠筑巢能力障碍的模型筛选
根据筑巢结果,15月龄WT小鼠评分为2.52±0.41。本实验中小鼠实际筑巢情况(图1)证明了本研究所采用的筑巢5分法的可操作性。筛选出了7只(17.9%)发生筑巢障碍的小鼠,其中有1只小鼠在实验过程中死亡,以及5只(12.8%)筑巢能力良好的小鼠。

图1 筑巢实验结果
2.2 筑巢能力障碍的老龄小鼠突触表达水平
免疫荧光结果显示,小鼠脑内PSD95标记的突触呈绿色圆点状,筑巢能力障碍组小鼠脑内颞叶区突触的免疫荧光强度与筑巢能力良好组相比降低,差异有统计学意义(P<0.01),而海马组间区差异无统计学意义(P>0.05)(图2)。
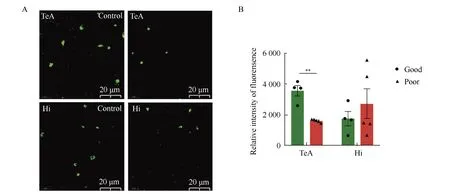
图2 筑巢功能障碍组和良好组小鼠脑内PSD95表达
2.3 筑巢能力障碍的老龄小鼠神经元树突表达水平
免疫荧光结果显示,小鼠脑内MAP2标记的神经元树突呈绿色长丝状,筑巢能力障碍组小鼠脑内颞叶区神经元树突的免疫荧光强度与筑巢能力良好组相比差异有统计学意义(P<0.05),而海马区组间差异无统计学意义(P>0.05)(图3)。
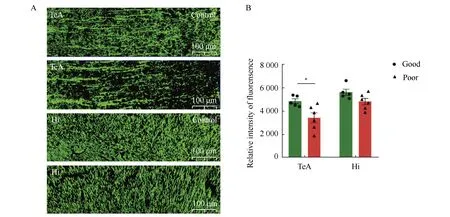
图3 筑巢功能障碍组和良好组小鼠脑内MAP2表达
2.4 筑巢能力障碍的老龄小鼠神经元轴突表达水平
免疫荧光结果显示,小鼠脑内NFH标记的神经元轴突呈绿色丝状,筑巢能力障碍组小鼠脑内颞叶区和海马区NFH的免疫荧光强度与筑巢能力良好组相比差异均无统计学意义(P>0.05)(图4)。
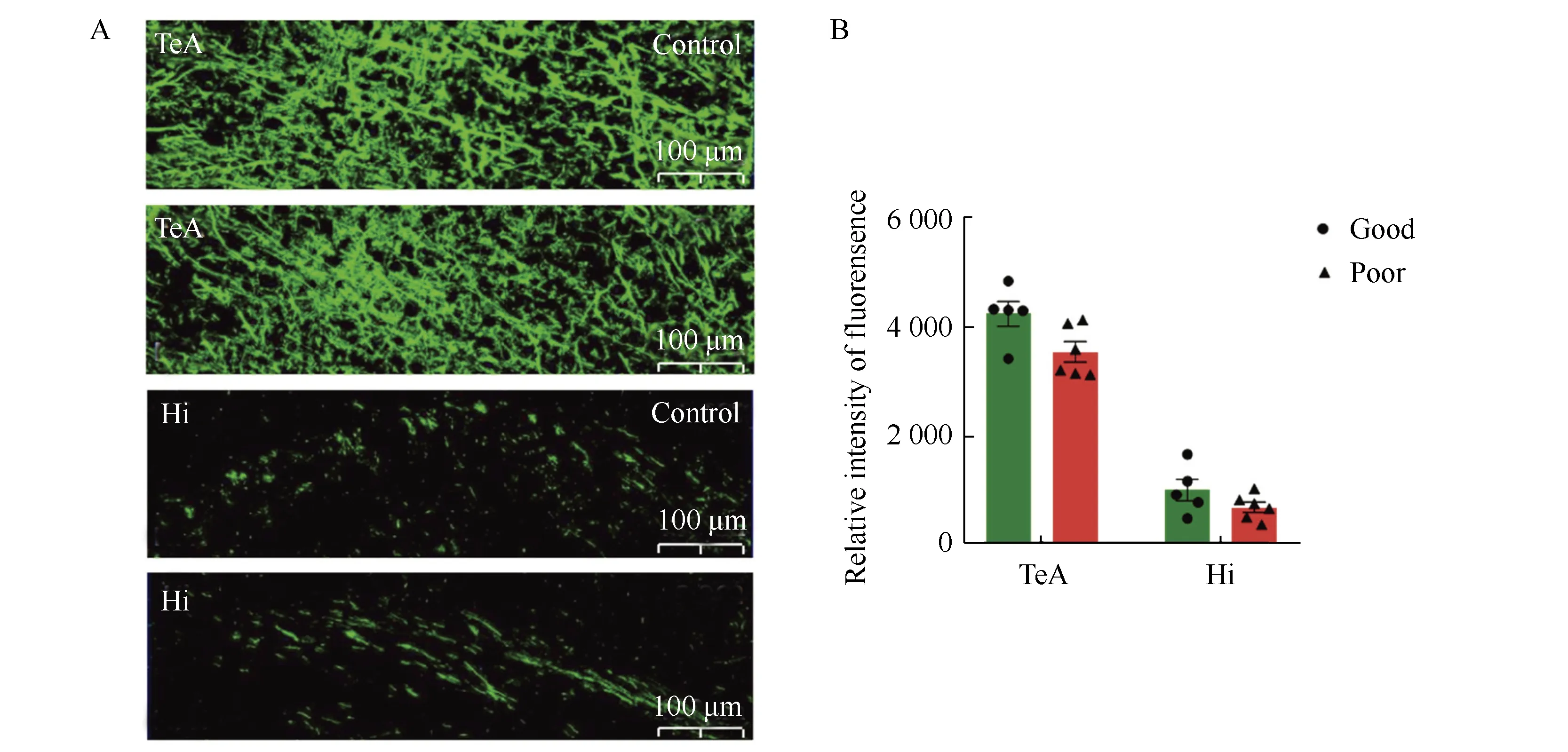
图4 筑巢功能障碍组和良好组小鼠脑内NFH表达
2.5 筑巢能力障碍的老龄小鼠神经元数量
免疫荧光结果显示,小鼠脑内神经元标记物NeuN主要表达在细胞核上呈红色圆形,筑巢能力障碍组小鼠脑内颞叶区和海马区神经元(NeuN)的阳性细胞个数与筑巢能力良好组相比差异均无统计学意义(P>0.05)(图5)。
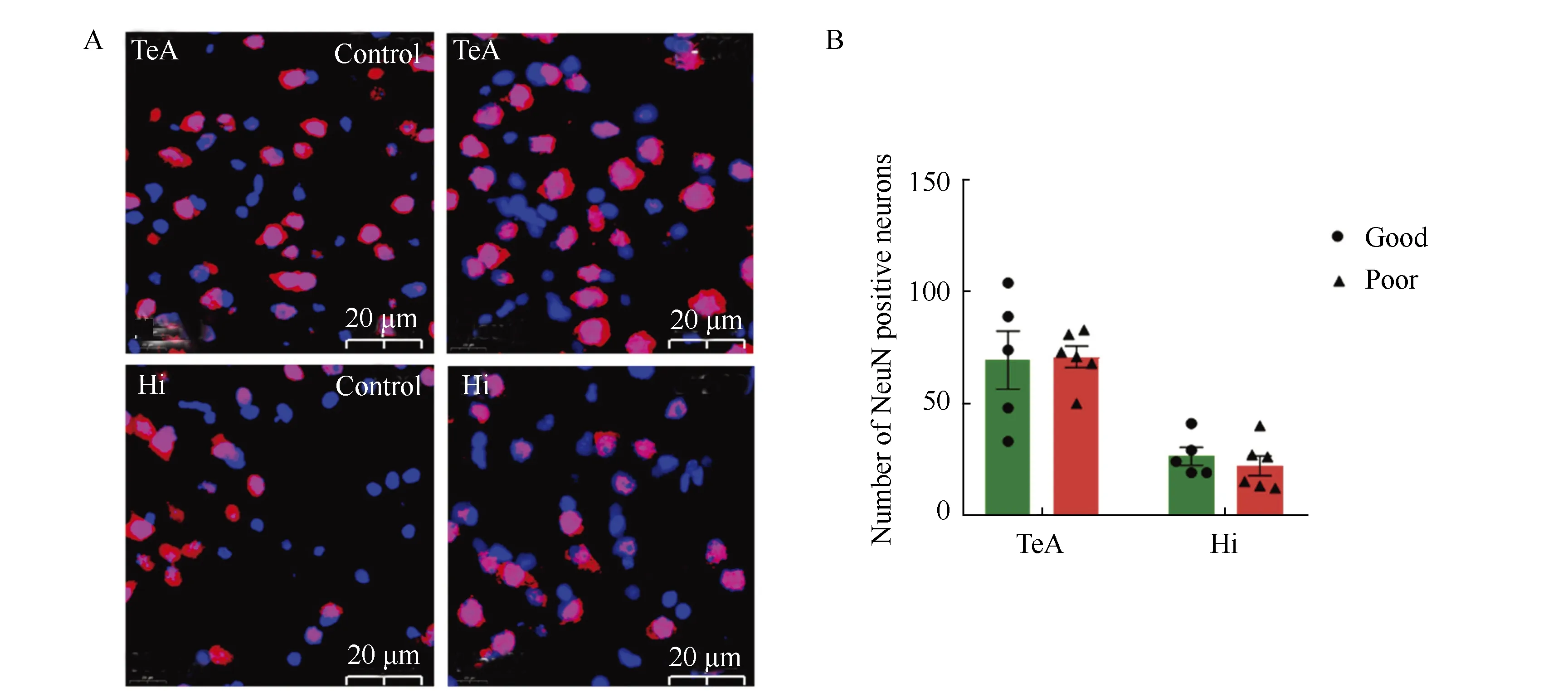
图5 筑巢功能障碍组和良好组小鼠脑内NeuN表达
2.6 筑巢能力障碍的老龄小鼠小胶质细胞数量
免疫荧光结果显示,小鼠脑内小胶质细胞标记物IBA1主要表达在细胞膜上,筑巢能力障碍组小鼠脑内颞叶区和海马区IBA1的阳性细胞个数与筑巢能力良好组相比差异均无统计学意义(P>0.05)(图6)。
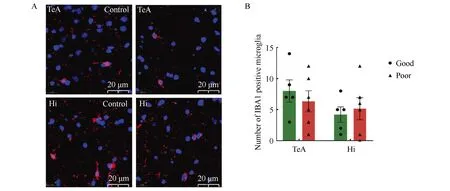
图6 筑巢功能障碍组和良好组小鼠脑内IBA1表达
2.7 筑巢能力障碍的老龄小鼠星形胶质细胞数量
免疫荧光结果显示,小鼠脑内星形胶质细胞标记物GFAP主要表达在细胞膜上,发生筑巢能力障碍组小鼠脑内颞叶区和海马区星形胶质细胞的阳性细胞个数与筑巢能力良好组相比差异均无统计学意义(P>0.05)(图7)。
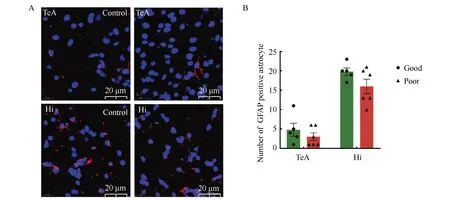
图7 筑巢功能障碍组和良好组小鼠脑内GFAP表达
3 讨论
随着人们生活质量的提高,人口老龄化的现象越来越严重,年龄相关性疾病,尤其是认知功能障碍极大地影响了人们的生活质量,引起了人们的关注[12-13]。但是,自发性认知障碍的原因目前尚不清楚,老年群体中出现散发性的认知障碍个体的机制也有待研究。认知包括记忆、语言、视空间、执行、计算和理解判断等多方面,个体筑巢实验可用于评估小鼠日常活动的执行能力[14]。本研究通过个体筑巢实验筛选出了自然发生筑巢障碍的老龄小鼠,并通过免疫荧光染色分析了自然发生筑巢障碍小鼠脑内认知相关的神经病理学变化特征。
小鼠的遗传背景、生长及饲养环境、筑巢材料及实验方法等因素均可影响个体筑巢实验结果[11]。本研究选用了遗传背景相近的15月龄近交系野生型小鼠作为实验对象,在相同的实验条件下,实验组小鼠表现出了筑巢能力的差异。为了探索这一现象的原因,以实验组为标准,从实验组中筛选出了7只自然发生筑巢障碍的小鼠(17.9%),以及5只筑巢表现良好的小鼠(12.8%),该发病率与国内临床上认知功能障碍的流行病学调查结果(20.8%)[15]相近。这个结果提示,通过筑巢实验筛选出自然发生筑巢障碍的小鼠模型可用于研究自发性认知功能障碍。
PSD位于神经元兴奋性突触后膜,参与突触后信号转导和整合,可调节突触谷氨酸受体的定位[16]。PSD95是指相对分子质量为95 000的突触后致密蛋白,是PSD的主要成分[17]。PSD95本身无蛋白酶活性,主要是通过不同结构域与相关受体及信号分子结合,形成信号复合物发挥作用,具有参与突触连接的形成、维持突触的可塑性等多种生物学功能,与神经退行性疾病的发生、发展有关[18]。本研究通过免疫荧光分析发现自然发生筑巢障碍的老龄小鼠颞叶区的突触的免疫荧光强度较筑巢良好组减少,差异有统计学意义(P<0.01),而海马区突触差异无统计学意义。氧化应激、离子型谷氨酸受体介导的兴奋性毒性作用及线粒体功能障碍等均可能导致颞叶区突触可塑性降低[19],但具体原因目前尚未阐明,还需深入探究。
神经元树突和轴突复杂的形状决定了细胞可以建立的突触连接,具有重要作用。它与细胞分子成分选择性地分布到轴突或树突的特定区域有着千丝万缕的联系[20]。微管是神经元树突中的主要骨架蛋白,参与维持细胞形态及物质运输等过程[21]。MAP2是一种定位于神经元树突的微管相关蛋白[22]。本研究通过免疫荧光分析发现自然发生筑巢障碍的老龄小鼠颞叶区的神经元树突的免疫荧光强度较筑巢良好组减少,差异有统计学意义(P<0.05),推测其可能出现的原因是DNA损伤的异常修复或能量代谢障碍[23],有待进一步的研究。而海马区神经元树突呈现减少趋势,但是差异无统计学意义。这个结果提示,筑巢反映的认知障碍可能与颞叶所负责的情感活动有关,而不是海马区负责的短期学习记忆。
NFH是轴突的主要成分之一,是神经元轴突的标志物[24]。NeuN是一种神经元核抗原,可识别神经元的胞体,通常用作神经元的标记[25]。IBA1为小胶质细胞的标志物,是一种离子钙结合衔接分子。在机体受到损伤或者感染时,正常情况下处于静息状态的小胶质细胞被激活活化为具有免疫功能的细胞,此时,IBA1会上调[26]。GFAP是一种胶质纤维酸性蛋白,是活化的星形胶质细胞的标志物,参与细胞骨架的构成并维持其张力强度[27]。在本研究中,自然发生筑巢障碍的15月龄C57BL/6小鼠脑内颞叶区和海马区的神经元轴突的免疫荧光强度、神经元、小胶质细胞以及星形胶质细胞的阳性细胞个数均差异无统计学意义(P>0.05)。可初步认为,筑巢实验筛选出的筑巢障碍模型,未发生神经元轴突的损伤以及神经元的凋亡,并且自发性筑巢障碍的原因可能不是小胶质细胞和星形胶质细胞异常所引起的神经炎症反应。
综上所述,通过筑巢实验可以筛选出老龄小鼠自然发生筑巢障碍的模型,该筛选方法简单易学,实验周期短,不会引起实验动物应激,具有良好的可操作性和重复性。本研究中筑巢障碍组老龄小鼠颞叶区突触和神经元树突的显著减少提示突触可塑性的降低可能是导致发生自发性筑巢障碍的原因,但具体的机制还需进一步的研究。
