生产工艺对小儿氨酚黄那敏颗粒质量的影响
2022-06-29王红梅赵婉婷张轶华
王红梅,靳 玲,赵婉婷,张轶华△
(1.四川省交通运输厅公路局医院,四川 成都 611731; 2.河北省药品医疗器械检验研究院,河北 石家庄 050011)
小儿氨酚黄那敏颗粒为非处方药,适用于缓解儿童普通感冒及流行性感冒引起的发热、头痛、四肢酸痛、打喷嚏、流鼻涕、鼻塞、咽痛等症状,为复方制剂,现行标准包括国家药品标准[WS-10001-(HD-0214)-2002 和WS-10001-(HD-0214)-2002-2006]和注册标准(YBH12082005 和YBH00342007)。制剂中马来酸氯苯那敏含量虽极低,但其混合均匀程度直接影响制剂质量,而现行标准中均未对其含量均匀度进行控制。已有文献报道了本品及类似制剂质量标准的研究[1-6],亦有研究对药品的处方工艺进行优化考察[7-10],但同时进行2 项研究的报道较少。为此,本研究中建立了高效液相色谱(HPLC)法测定小儿氨酚黄那敏颗粒中马来酸氯苯那敏的含量,计算含量均匀度,并比较干混工艺及喷雾工艺对药品质量的影响,以为企业提高产品的内在质量提供依据。现报道如下。
1 仪器与试药
1.1 仪器
Dionex Ultimate 3000 型高效液相色谱仪(美国Dionex 公司);XS105 型电子天平(瑞士Mettler Toledo公司)。
1.2 试药
小儿氨酚黄那敏颗粒430批[规格均为每袋含对乙酰氨基酚125 mg、马来酸氯苯那敏0.5 mg、人工牛黄(或体外培养牛黄)5 mg],共涉及140家企业,涵盖全国31 个省市自治区;马来酸氯苯那敏对照品(中国食品药品检定研究院,批号为100047-200606,按C16H19ClN2•C4H4O4计,含量为99.7%);乙腈为色谱纯,其余试剂为均分析纯,水为超纯水。
2 方法与结果
2.1 色谱条件
色谱柱:Diamonsil C18柱(200 mm×4.6 mm,5 μm);流动相:磷酸盐缓冲液(取磷酸二氢铵11.5 g,加水适量使溶解,加磷酸1 mL,用水稀释至1 000 mL)- 乙腈(75∶25,V/V);流速:1.0 mL/min;检测波长:262 nm;柱温:30 ℃;进样量:10 μL。
2.2 溶液制备
取马来酸氯苯那敏对照品10 mg,精密称定,置100 mL容量瓶中,加流动相溶解并定容,摇匀,作为对照品贮备液;精密量取10 mL,置50 mL容量瓶中,加流动相定容,摇匀,作为对照品溶液。取样品1 袋,内容物置乳钵中,加流动相适量,研磨,用流动相分次转移至25 mL 容量瓶中,振摇,加马来酸氯苯那敏溶解并用流动相定容,摇匀,滤过,取续滤液,作为供试品溶液。按小儿氨酚黄那敏颗粒处方(以1袋计)和工艺制备缺马来酸氯苯那敏的阴性样品,并按供试品溶液制备方法制成阴性对照品溶液。
2.3 方法学考察
系统适用性试验:精密吸取对照品溶液、供试品溶液各适量,按2.1项下色谱条件进样测定,记录色谱图。供试品溶液色谱中,在与对照品溶液色谱相应位置有吸收峰。理论板数按马来酸峰、氯苯那敏峰计均不低于3 000,分离度均大于1.5,基线分离良好。详见图1。
线性关系考察:取对照品贮备液,逐级稀释成质量浓度分别为0.100,0.050,0.020,0.010,0.005 mg/mL的系列对照品溶液,分别精密吸取10 μL,按2.1项下色谱条件进样测定,记录峰面积。以氯苯那敏质量浓度(X,μg/mL)为横坐标,峰面积(Y)为纵坐标进行线性回归,得回归方程Y=8 442.6X-9 999(r=0.999 7,n=5)。结果表明,氯苯那敏质量浓度在0.005~0.1 mg/mL 范围内与峰面积线性关系良好。

1.氯苯那敏A.对照品溶液 B.供试品溶液 C.阴性对照品溶液图1 高效液相色谱图1.ChlorphenamineA.Reference solution B.Test solution C.Negative reference solutionFig.1 HPLC chromatograms
检测限和定量限确定:取2.2 项下对照品溶液适量,逐级稀释,按2.1项下色谱条件进样测定,记录峰面积。以信噪比(S/N)为3∶1和10∶1时分别计算检测限及定量限。结果氯苯那敏检测限为2.0 ng,定量限为6.2 ng。
精密度试验:取2.2项下供试品溶液适量,按2.1项下色谱条件连续进样6 次,记录峰面积。结果氯苯那敏峰面积的RSD为0.58%(n=6),表明方法精密度良好。
稳定性试验:取供试品溶液适量,分别于室温下放置0,1,2,4,8,12,24 h 时进样测定,记录峰面积,计算含量。结果氯苯那敏峰面积的RSD为0.61%(n=7),表明供试品溶液在室温下放置24 h内基本稳定。
重复性试验:取样品内容物适量,共6 份,精密称定,按2.2 项下方法制备供试品溶液,按2.1 项下色谱条件进样测定,记录峰面积,并计算含量。结果氯苯那敏含量的RSD为0.23%(n=6),表明方法重复性良好。
加样回收试验:取样品(A 厂,批号为20101107)内容物适量,共9 份,分别精密加入对照品贮备液4,5,6 mL,各3 份。依法制备供试品溶液,再按2.1 项下色谱条件进样测定,外标法计算回收率。结果见表1。

表1 加样回收试验结果(n=9)Tab.1 Results of the recovery test(n=9)
2.4 样品含量均匀度测定
430 批样品中,有370 批含量均匀度符合2020 年版《中国药典(四部)》规定(A+ 2.2S< 15.0),合格率为86.05%;不合格样品的A+ 2.2S集中在16.0~46.2。以本次抽验抽到批次较多的2 家企业为例,共抽到B 企业样品15 批,含量均低于90%;C 企业样品26 批,其中5 批含量在88%左右,其余批次含量均大于90%。结果见图2。
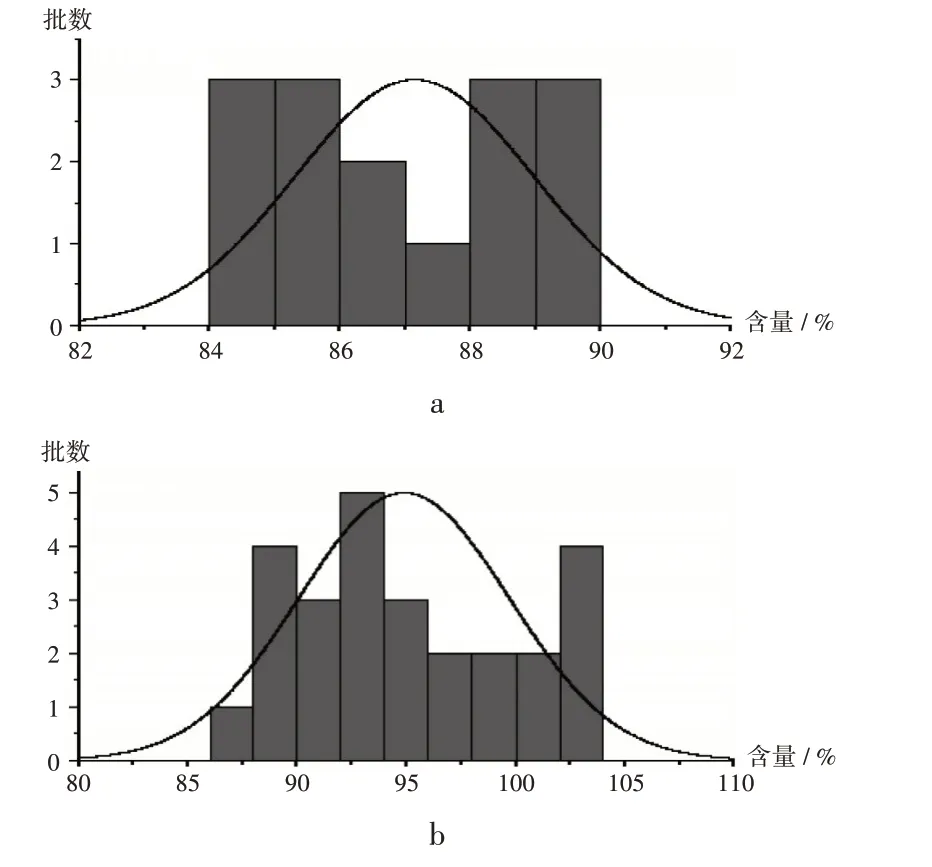
a.B企业 b.C企业图2 马来酸氯苯那敏含量测定结果直方图a.Manufacturer B b.Manufacturer CFig.2 Histogram of content determination of chlorpheniramine maleate
2.5 工艺研究
选取采用2种生产工艺的企业各6家共90批次样品(见表2),对其产品进行数据分析,见图3。可见,喷雾工艺能很好地解决制剂中马来酸氯苯那敏均匀度问题。
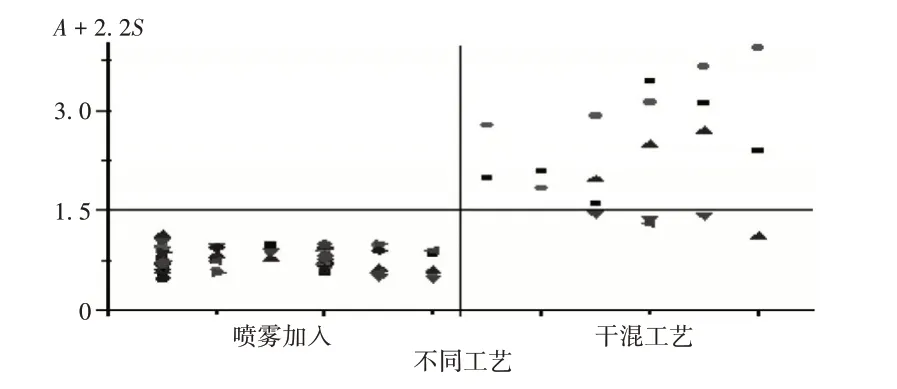
图3 两种不同工艺马来酸氯苯那敏含量均匀度测定结果对比图Fig.3 Comparison of content uniformity of chlorphenamine maleate prepared by two different technologies
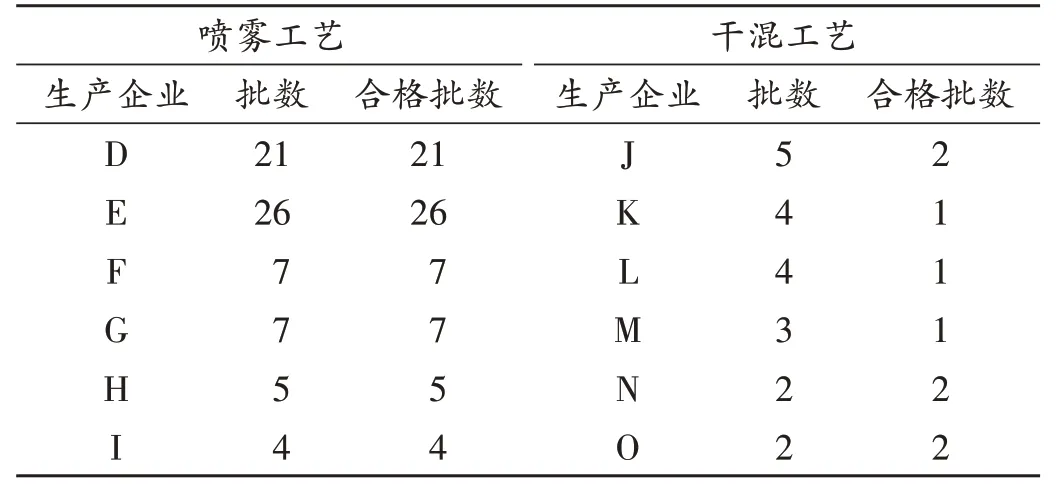
表2 两种不同工艺的样品合格情况Tab.2 Qualification of samples prepared by two different technologies
3 讨论
目前,部分企业在生产投料时随意性较大,按本研究中建立的方法进行检测,430 批样品合格率仅为86.05%。故应在现行标准中增加马来酸氯苯那敏的含量均匀度检查项,以提高制剂质量。
前期实地调研结果表明,干混工艺很难将处方中含量较少的马来酸氯苯那敏混合均匀,即部分生产工艺缺陷是造成该成分在制剂中均匀度差的主要原因。本研究中涉及企业的生产工艺主要分2种:一是干混工艺,即将马来酸氯苯那敏和其他原辅料直接混合后制粒;二是喷雾工艺,即将马来酸氯苯那敏先溶于10%糖浆,再雾喷至其他原辅料的干混粉末中制粒。本研究结果显示,喷雾工艺制备的样品中,马来酸氯苯那敏的含量均匀度明显优于干混工艺。因此,建议生产企业可考虑喷雾工艺以优化生产工艺,提升药品的内在质量。
