18F-AlF 标记的多肽分子探针在PET 肿瘤显像中的研究进展
2022-06-29韩静雅陈旸赵妍赵新明
韩静雅 陈旸 赵妍 赵新明
1 河北医科大学第四医院核医学科,石家庄 050011;2 河北医科大学第四医院肿瘤内科,石家庄 050011
PET 是核医学领域较先进的分子影像学技术,可从分子水平动态观察受体、基因表达和细胞代谢等的变化情况。正电子放射性核素显像剂与PET 技术结合可实时、定量地对病变相关生物靶点进行分析,将肿瘤生物学行为可视化。近年来,尽管11C、68Ga、64Cu、89Zr 及124I 标记的正电子分子探针在临床中的应用逐渐增多,但18F 标记的分子探针具有较高的显像灵敏度及空间分辨率,故更适合用于PET肿瘤显像。
1 18F 标记多肽分子的常用方法
目前,18F 标记多肽分子主要有3 种方法:18F 标记辅基法、点击化学标记法和18F-氟化铝(18F-AlF)络合标记法[1]。而18F 亲核取代反应不适合多肽类分子标记。
1.1 18F 标记辅基法
用于18F 标记的辅基主要有2 种:胺反应辅基及硫醇反应辅基[1]。胺反应辅基2-18F-氟丙酸对-硝基苯酯(nitrophenyl 2-[18F]fluoropropionate,18F-NFP)、N-琥珀酰亚胺-4-18F-氟苯甲酸酯(N-succinimidyl-4-[18F]fluorobenzoate,18F-SFB)可用于精氨酸-甘氨酸-天冬氨酸(Arg-Gly-Asp, RGD)及肽类的18F 标记;基于硫醇反应18F 标记的马来酰亚胺的各种辅基,如N-[6-(4-[18F]氟苯亚甲基)氨基氧己基]马来酰亚胺(N-[6-(4-[18F]fluorobenzylidene) aminooxyhexyl] maleimide,18FFBAM)、N-2-(4-[18F]氟苯甲酰氨基)乙基马来酰亚胺(N-[2-(4-[18F]fluorobenzamido)ethyl]maleimide,18F-FBEM)、18F-FDG-马来酰亚胺己基肟(maleimidehexyloxime,MHO),可用于含半胱氨酸或半胱氨酸残基的肽类标记。但基于辅基的标记过程复杂,反应时间长,标记率低,且引入的辅基较大,影响标记物的活性。
1.2 点击化学标记法
基于点击化学的18F 标记简便,适合快速标记大量化合物,极具应用前景。点击化学在分子影像学中应用较为广泛的有铜催化的叠氮和端炔的环加成反应(Cu-catalyzed azide- alkyne cycloaddition, CuAAC)、[3+2]叠氮-炔烃环加成反应(strain-promoted azide-alkyne cycloaddition, SPAAC)、基于巯基的点击反应和Diels-Alder(D-A)反应[2]。其中,CuAAC 应用最早也最经典,但由于Cu(Ⅰ)催化剂有细胞毒性、易诱发病毒或寡核苷酸降解,限制了其临床应用。近年来,点击化学在分子影像学领域进展迅速,但需多步骤合成,部分标记产物的产率及体内稳定性尚不理想,还需要进一步完善。
1.3 18F-AlF 络合标记法
18F-AlF 络合物之间氟键能量高、热力学性质稳定,且标记过程简便、反应迅速、产率高、稳定性好,易于临床推广。18F-AlF 标记的螯和基团主要有DTPA、1, 4, 7, 10-四氮杂环十二烷-1, 4, 7, 10-四乙酸(1, 4, 7, 10- tetraazacyclododecane-1, 4, 7, 10-tetraacetic acid,DOTA)和1, 4, 7-三氮杂环壬烷-1, 4, 7-三乙酸(1, 4, 7-triazacyclononane-1, 4, 7-triacetic acid,NOTA)等,与DTPA 相比,以NOTA 为螯和基团的标记物稳定性更好;与DOTA 相比,NOTA 可避免DOTA 多余的供体原子竞争氟化物与Al3+的配位[3],更适于Al3+的配位(图1),故NOTA 与18F-AlF 的连接更稳定,更利于标记。但18F-AlF-NOTA 的标记方法需在高温条件下进行,不适于标记热敏分子。Cleeren 等[4]改变螯和基团,在室温下构建了18F-AlF-约束络合剂(restrained complexing agent,RESCA)-人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)亲合体(PEP04314),突破了18F-AlF-NOTA 需高温反应的限制,制备更简单,可用于18F 标记热敏生物分子的研发。
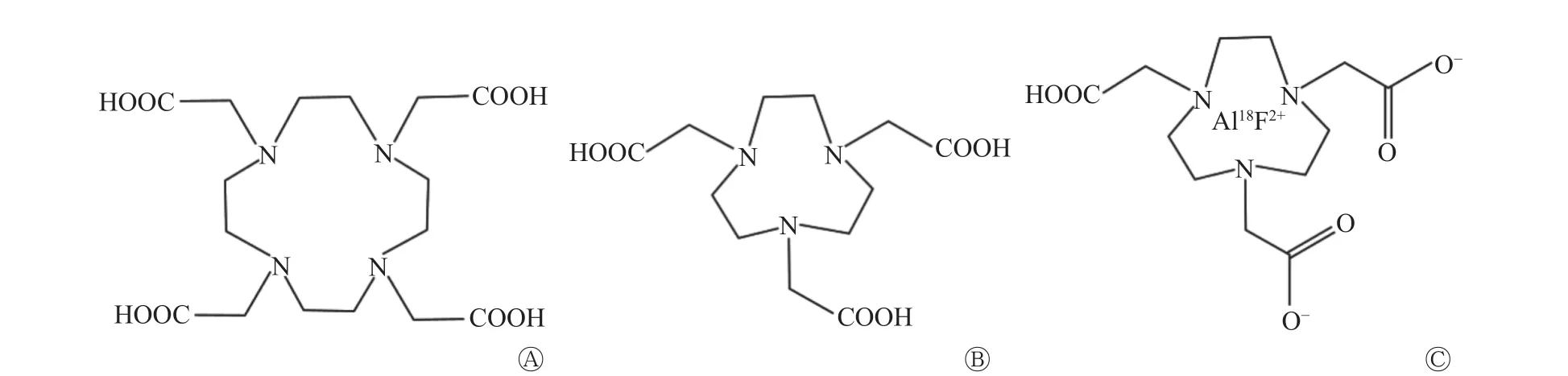
图1 DOTA、NOTA 和18F-AlF-NOTA 化学结构图 A 为DOTA 化学结构图;B 为NOTA 化学结构图;C 为18F-AlF-NOTA 化学结构图。DOTA 为1, 4, 7, 10-四氮杂环十二烷-1, 4, 7, 10-四乙酸;NOTA 为1, 4, 7-三氮杂环壬烷-1, 4, 7-三乙酸;AlF 为氟化铝Figure 1 Chemical structure diagrams of DOTA , NOTA and 18F-AlF-NOTA
2 18F-AlF 标记多肽分子探针的研发
2.1 18F-AlF 标记RGD 的整合素αvβ3 受体及其PET 肿瘤显像
整合素αvβ3 在新生血管内皮细胞和多种肿瘤细胞表面高表达,是肿瘤诊疗中极具潜力的分子靶点。RGD 可特异性地与整合素αvβ3 结合,为RGD 分子探针的研究奠定了基础。Liu 等[5]首先应用18F-AlF 对NOTA-RGD 共轭物进行标记,并用于肿瘤血管显像,结果表明,该标记方法简便,micro-PET 显像显示出较高的T/NT,并且该分子探针在体内的清除速率快,这表明18F-AlF-NOTA 标记方法在临床上具有应用推广的可行性。18F-AlF-阿法肽(Alfatide I)也称18F-AlF-NOTA- PRGD2,其冻干试剂盒的成功研制是整合素αvβ3 受体显像的重大临床突破。Wan 等[6]采用18F-AlFNOTA-PRGD2 进行PET/CT 显像,结果显示,其可以特异性显示肺癌患者整合素αvβ3 的表达,可用于肿瘤诊断及针对新生血管靶向治疗的疗效评价。随后,18F-AlF-NOTAPRGD2 PET/CT 显像在肺癌淋巴结转移、胶质母细胞瘤、食管癌的诊断以及抗血管生成药阿帕替尼的疗效评价中显示出巨大的临床应用潜力[7-8]。
2.2 18F-AlF 标记的胃泌素释放肽类似物及其PET 肿瘤显像
胃泌素释放肽受体(gastrin releasing peptide receptor,GRPR)在多种肿瘤(如前列腺癌、乳腺癌和小细胞肺癌)中高表达,是放射性核素显像及治疗的重要靶点。利用放射性核素标记的GRPR 的配体可与受体特异性结合,进而对肿瘤进行显像。Pan 等[9]评估了GRPR 靶向显像剂18F-AlFNOTA-甘氨酸-甘氨酸-甘氨酸-精氨酸-天冬氨酸-天冬酰胺-D-苯丙氨酸-谷胺酰胺-色氨酸-丙氨酸-缬氨酸-甘氨酸-组氨酸-亮氨酸-氨基乙基(Gly-Gly-Gly-Arg-Asp-Asn-D-Phe-Gln-Trp-Ala-Val-Gly-His-Leu-NHCH2CH3,MATBBN)在前列腺癌PET 显像中的潜力,研究发现,与18F-FDG 相比,18FAlF-NOTA-MATBBN 与前列腺癌细胞PC-3 的结合特异性更强,但其在磷酸盐缓冲液及人血清中的体外稳定性差,存在时间(2 h)较短。Carlucci 等[10]研究发现,GRPR 特异性显像剂18F-AlF-NOTA-4,7-硫化双丙氨酸-蛙皮素和18F-AlFNOTA-2,6-硫化双丙氨酸-蛙皮素可与人前列腺癌细胞PC-3移植瘤特异性结合。并且2 种示踪剂分别在生理盐水和血清中孵育4 h 后,体外稳定性均>90%,体内稳定性均>75%。
2.3 18F-AlF 标记的前列腺特异性膜抗原(prostate-specific membrane antigen,PSMA)及其PET 肿瘤显像
前列腺癌是男性最常见的恶性肿瘤[11], PSMA 在大多数前列腺癌细胞中均特异性高表达,是显像和治疗中的重要靶点。对PSMA 特异性结合分子进行放射性核素标记后可进行核医学显像。近年来,研究较多的PMSA 分子探针有68Ga 标记的PSMA-11、PSMA-617、PSMA-I&T 和三羟基吡啶酮(trishy droxypyridihone,THP)-PSMA 及18F 标记的DCFBC 和PSMA-1007。 但由于68Ga 的半衰期短、能量稍低、成本高以及68Ge/68Ga 发生器提供的剂量有限,其使用受到限制,而18F 标记的PMSA 分子探针的应用却越来越广泛。Boschi 等[12]对18F-AlF-PSMA-11 进行临床前评价,从小鼠PET 生物学分布数据推断了18F-AlF-PSMA-11的吸收剂量,指出肾脏是剂量限制器官,保守估算出人的最大耐受剂量为564 MBq,为临床应用奠定了基础。Liu等[13]完成18F-AlF-PSMA-北京肿瘤医院(Beijing Carcinoma Hospital,BCH)的制备,并进行安全性检测,在前列腺癌细胞荷瘤裸鼠中进行显像的基础上完成临床转化,结果表明,18F-AlF-PSMA-BCH 的制备简单,安全性好, micro-PET显像可清楚地区分小鼠前列腺22RV1 肿瘤(PSMA 阳性)和前列腺PC-3 肿瘤(PSMA 阴性);并在11 例前列腺癌患者中探测出37 个PSMA 高表达病灶,成功完成18F-AlFPSMA-BCH 分子探针的临床转化。后续该探针逐渐应用于临床,对前列腺癌患者的精准诊疗具有较好的临床应用价值。
2.4 18F-AlF 标记的生长抑素类似物(somatostatin analogs,SSAs)及其PET 肿瘤显像
生长抑素(somatostatin, SST)由神经内分泌细胞、免疫细胞及炎症细胞产生,在脑、胰腺及胃肠道等器官中分布较为广泛。SSAs 主要有奥曲肽(octreotide, OC)、兰瑞肽及伐普肽等。SST 及SSAs 的生物学活性主要是通过靶向细胞膜上的生长抑素受体(somatostatin receptors, SSTR)介导发挥作用。SSTR 是一种细胞膜糖蛋白,在神经内分泌肿瘤、中枢神经系统肿瘤、乳腺癌、肺癌和其他组织的肿瘤中均高表达。放射性核素标记的SSAs 可用于SSTR 表达阳性的肿瘤的显像[14]。
神经内分泌肿瘤(neuroendocrine tumors,NETs)的发病率逐年升高,大多数NETs 分化良好、生长缓慢、葡萄糖代谢水平很低,18F-FDG 显像特异性欠佳,早期诊断较为困难。该肿瘤高表达SSTR(尤其是SSTR-2),其靶向PET 显像剂发展迅速。近年来,68Ga 标记SSAs 的技术不断发展,已取代111In-DTPA-OC 成为SSTR 显像的“金标准”[14],在临床上得到应用的示踪剂主要有68Ga-1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸-D-苯丙氨酸1-酪氨酸3-苏氨酸8-奥曲肽(68Ga-DOTA-Tyr(3)-octreotate,68Ga-DOTATATE)、68Ga-1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸-酪氨酸3-奥曲肽(DOTA-Tyr(3)-octreotide,DOTATOC)及68Ga-1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸-1-萘丙氨酸3-奥曲肽(DOTANal(3)-octreotide,DOTANOC)。然而因68Ge/68Ga 发生器的日产量较低,68Ga 标记SSAs PET 显像的临床应用受到限制。近年来18F 标记的SSAs 的临床应用逐渐开展。Long等[15]在Ⅰ期临床试验中将[18F]AlF-NOTA-OC与18F-FDG 显像进行对比,结果表明,18F-AlF-NOTA-OC 在安全性、生物学分布特性及剂量学研究中显示出明显优势,且肿瘤摄取及T/NT 均较高。Pauwels 等[16]通过前瞻性试验对18F-AlFNOTA-OC 的安全性、剂量测定、生物学分布、药代动力学和靶向性进行研究,并在6 例NETs 患者中将其与68Ga-DOTATATE 显像进行比较,结果表明,18F-AlF-NOTA-OC安全性、耐受性良好,显示出较好的体内分布、药代动力学性质及肿瘤靶向性,对病变的检出率与68Ga-DOTATATE相当。鉴于18F 适宜的半衰期及较高的空间分辨率,18F-AlFNOTA-OC 有望成为诊断NETs 的显像剂。
2.5 18F-AlF 标记的HER2 亲合体及其PET 肿瘤显像
HER2 是酪氨酸激酶受体蛋白,在肿瘤细胞分化、增殖、肿瘤转移和预后中起着关键作用。放射性核素标记的HER2 亲合体可以与HER2 高表达肿瘤靶向特异性结合,从而实现实时监测原发灶、转移灶和治疗过程中HER2 的动态变化,对HER2 阳性肿瘤的诊断、治疗及疗效监测具有重要意义[17-20]。Heskamp 等[21]报道了NOTA(5)-ZHER2:239的18F-AlF 一步标记法及其在人卵巢癌细胞SKOV3 荷瘤裸鼠体内分布的研究,结果显示,与68Ga 和111In 标记的HER2 亲合体相比,18F-AlF-NOTA(5)-ZHER2:239在血液中的清除速率更快,肿瘤/血液比值更高,其显像性能更具优势且不易脱标。Glaser 等[22]对比分析氟化硅受体方法(18F-silicon-fluoride acceptor approach,18F-SiFA)、18F-AlF-NOTA 和4-18F-氟苯甲醛3 种方法标记ZHER2:2891亲合体的PET/CT 显像效果,结果显示,与其他2 种标记方法相比,18F-AlF 标记的ZHER2:2891在肾脏中的浓聚较明显,且在HER2 表达阳性的荷瘤裸鼠显像中显示出较高的肿瘤/肌肉和肿瘤/肝脏比值,更适于肿瘤显像。Xu 等[23]研究HER2 特异性显像剂18F-AlF-NOTA-马来酰亚胺(maleimide, MAL)-MZHER2:342在不同HER2 表达水平的肿瘤细胞荷瘤裸鼠中的显像效果,结果表明,18F-AlF-NOTA-MAL-MZHER2:342合成简便,药代动力学性质良好,在HER2 阳性的人卵巢癌细胞SKOV3 及人乳腺癌细胞JIMT-1 荷瘤裸鼠中的显像效果较好,是极具临床应用潜力的HER2 靶向分子探针。
2.6 18F-AlF 标记的成纤维细胞活化蛋白抑制剂(fibroblast activation protein inhibition, FAPI)及其PET 肿瘤显像
肿瘤相关成纤维细胞 (cancer-associated fibroblast, CAF)及胞外纤维细胞是实体肿瘤的重要组成成分。CAF 在90%以上的肿瘤中高表达,其通过分泌成纤维细胞活化蛋白(fibroblast activation protein, FAP)促进肿瘤生长和转移[24]。放射性核素标记的FAPI 已用于多种肿瘤的显像研究。Kratochwil 等[25]用68Ga-FAPI-04 对80 例肿瘤患者行PET/CT显像,结果显示,该分子探针检测出28 种肿瘤的原发灶或转移灶,这为肿瘤的无创诊断、分期及放射性配体治疗开辟了新的应用前景。随后,68Ga、64Cu、225Ac 和99Tcm等放射性核素标记的FAPI 相继在国内外科研及临床工作中不断被研发[26-27]。18F 适宜的半衰期使其在实际大规模生产应用中具有更强的可行性。Giesel 等[28]分别用18F-AlF、68Ga 标记NOTA-FAPI 74 并对10 例肺癌患者进行PET/CT 显像,结果表明,18F-AlF-NOTA-FAPI 74 PET/CT 图像的对比度和空间分辨率更高,并且对患者的辐射剂量低,更适于临床应用。虽然18F-AlF 标记的FAPI 在多种肿瘤中的显像效果较好,但鉴于伤口愈合过程中成纤维细胞活化、慢性炎症相关基质重塑以及肝和肺纤维化等原因,其诊断及疗效评价的特异性会降低。另外,18F-AlF 标记的FAPI 的临床应用成本较高,在获得美国国家食品药品监督管理局批准过程中程序复杂,故在短期内并不能取代18F-FDG 成为广谱肿瘤显像剂以广泛应用于临床[29]。
3 小结与展望
18F-AlF 标记的PET 显像剂的开发与应用备受关注,部分已在临床研究中显示出精准的肿瘤检测效果。18F-AlF络合标记方法简便易行,在合适的pH 值、温度及有机溶剂条件下能一步完成,临床应用可行性强。除NOTA 螯合基团外,还有多种分子结构适用于18F-AlF 络合物的标记(如RESCA),突破了需高温条件标记的限制,显示出较好的临床应用前景。除肿瘤显像外,18F-AlF 标记多种正电子显像剂在心血管疾病及感染性病变中的应用也在进一步探索,具有良好的发展潜力。
利益冲突 所有作者声明无利益冲突
作者贡献声明 韩静雅负责综述的选题与撰写;陈旸、赵妍负责综述的审阅;赵新明负责综述的选题指导与审阅、最终版本的修订
