疫苗佐剂单磷酸脂质A的合成及在疫苗中应用进展
2022-06-28汪绪龙马晓雪周成凯
汪绪龙, 李 雪, 马晓雪, 周成凯, 隋 强*
疫苗佐剂单磷酸脂质A的合成及在疫苗中应用进展
汪绪龙1,2, 李 雪2, 马晓雪1, 周成凯1, 隋 强1*
(1. 上海工程技术大学 化学化工学院,上海 201620;2. 中国医药工业研究总院,上海 201203)
简单介绍了单磷酸脂质A(monophosphoryl lipid A)的来源及化学结构,单磷酸脂质A是革兰氏阴性菌外膜上脂多糖内层脂质A的部分结构。总结了单磷酸脂质A常用的两条合成路线并分析优缺点,指出路线2为最佳的合成方法,其巧妙的选取Nap作为保护基,用DDQ干净高效地脱除了Nap保护基,避免使用催化氢化,相比路线1更加适合工艺放大研究。化学合成与生物提取相比,避免了糖异质及纯度低的问题。最后总结了单磷酸脂质A作为佐剂在各类疫苗中的应用,为其进一步研究提供参考。
单磷酸脂质A;脂多糖;合成;Nap;佐剂;疫苗
单磷酸脂质A(Monophosphoryl Lipid A)是革兰氏阴性菌细胞壁中脂多糖(Lipopolysaccharide,LPS)中的最内层脂质A部分[1]。LPS是一个复杂分子,由三个结构区域组成:脂质A(Lipid A,内毒素)、非重复核心寡糖和-抗原(图1左),可以有效地引发机体产生炎症反应,导致各种生理病理效应[2-4]。LPS结构中的疏水部分脂质A是一种很强的免疫刺激剂,含有数条脂肪酰基链,能被Toll样受体4(TLR4)和髓样分化因子(MD-2)蛋白受体所识别,从而刺激相应的免疫细胞,如巨噬细胞、树突细胞等,产生免疫反应[5-7]。脂质A的骨架结构为-D-GlcN-(1→6)-D-GlcN,并含有1,4ʼ-二--磷酸基团,会过度激活先天性免疫应答,从而导致败血性休克等症状,副反应强烈。研究表明,去掉1位的磷酸基团,即为单磷酸脂质A(图1右),其毒性降低且保留了免疫活性[8-11]。Ribi等研究了单磷酸脂质A的致死性,发现其毒性仅为LPS的0.08%,证明了单磷酸脂质A的低毒性与安全性,很大程度上避免了由LPS引起的副反应[12]。研究发现,单磷酸脂质A能刺激免疫细胞并产生细胞因子,如TNF-(肿瘤坏死因子-)、IFN-(干扰素-)、IL-6(白细胞介素-6)等,进一步证明单磷酸脂质A作为佐剂的有效性,为其作为疫苗佐剂奠定 基础[13]。
目前,单磷酸脂质A在疫苗治疗中已作为佐剂投入市场,与疫苗配合使用能够显著增强抗体反应和T细胞调节免疫反应[14]。上文已简单介绍了单磷酸脂质A的来源和结构,下文将重点分析总结单磷酸脂质A的化学合成方法,最后介绍单磷酸脂质A作为佐剂在疫苗中的应用,为单磷酸脂质A类化合物作为佐剂在其他疫苗中的应用提供参考。
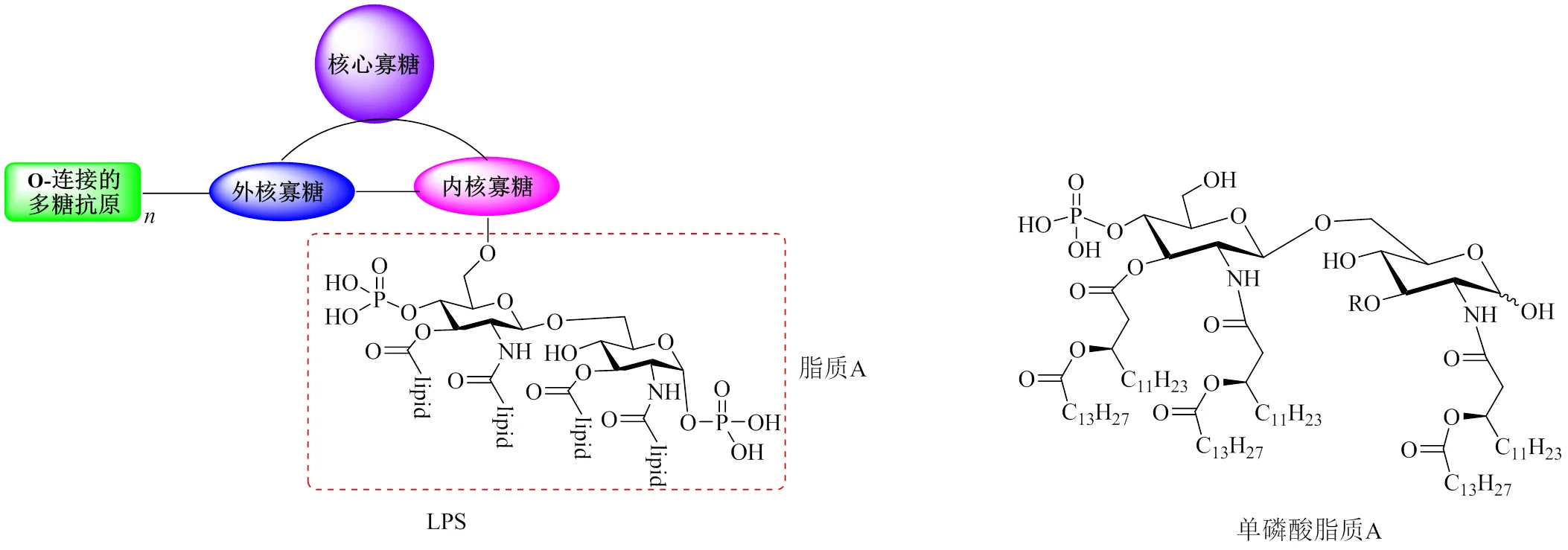
图1 LPS(左)和单磷酸脂质A(右)的一般结构
1 单磷酸脂质A合成路线综述
1.1 单磷酸脂质A合成所存在的问题
目前大部分单磷酸脂质A来源依靠于生物发酵提取,即先从细菌中提取,后经化学酸解得到。该方法的缺点是成本高,同时,通过培养的革兰氏阴性菌分离得到的单磷酸脂质A具有糖异质性问题[15]。例如:SJ-19a类脂质A在酸水解步骤中,会发生化学降解从而导致脂质A的异质性[16]。因此,采用化学合成的方法获得明确结构的单磷酸脂质A是十分必要的。
1.2 单磷酸脂质A的逆合成分析及目标化合物的合成
图2为单磷酸脂质A的逆合成分析图。

图2 单磷酸脂质A的逆合成分析
由图2可知,单磷酸脂质A类化合物的合成可概括为:1)糖受体与糖供体的制备,2)糖苷化形成二糖并连接相应的脂肪链,3)脱除保护基得到终产物。
单磷酸脂质A的合成路线1和合成路线2如图3所示。单磷酸脂质A两种合成路线对比如表1所示。

图3 单磷酸脂质A的合成路线1和合成路线2

表1 单磷酸脂质A两种合成路线对比
由图3与表1可知,对比分析了两种单磷酸脂质A的合成路线。路线1:糖供体1和糖受体2经糖苷化反应、Alloc保护、选择性开环、安装磷酸基团、脱除Troc保护基、连接脂肪链、脱除Alloc和TDS保护基,最后氢化脱除Bn得到目标化合物7[17]。该路线使用Bn为永久性保护基,需采用Pd/C在氢气条件下脱除,此步杂质多,后三步收率仅为68%。而且因为单磷酸脂质A为两亲性结构,氢化脱除时会形成胶束使得苄基脱除较为困难,从而导致终产物纯化方式复杂,如需要使用多个不同组分的混合溶剂作为流动相才能冲出产物[18]。
路线2:糖供体8和糖受体9经糖苷化反应、脱Troc保护基、连接脂肪链、脱Fmoc保护基、连接脂肪链、脱TDS和Allyl保护基,最后用DDQ将Nap脱除得到目标化合物12[19]。路线2采用了Nap代替Bn来保护糖环上的羟基和脂肪链上羟基,改用DDQ氧化脱除Nap,避免了催化氢化[20-21]。此方法大幅度提高了收率,且后处理较为简单。路线2反应步骤较少,能耗少、收率高,反应条件温和、易于操作,相比路线1更加适合工艺放大研究。
2 单磷酸脂质A在疫苗中的应用
2.1 含单磷酸脂质A的AS佐剂系统
由于单一佐剂有其使用的局限性,因此现有疫苗中大多会添加两种以上的佐剂组成佐剂系统[22-23]。目前含有单磷酸脂质A的AS佐剂系统见表2。

表2 常用的AS佐剂系统
QS21:从皂树树皮中提取的三萜糖苷类物质;CpG:TLR样9配体
佐剂系统不同的配伍会影响到佐剂的免疫应答效果和副作用。Burny等[24]对部分佐剂系统的免疫原性进行比较,将AS系列、铝佐剂分别与HBV抗原结合后接种于人体,其适应性和体内免疫反应的效果为:AS01>AS03>AS04>Alum,与四价HPV疫苗组合接种于人体后,AS01系统的特异性免疫抗体浓度最高[25]。
2.2 已上市含单磷酸脂质A的疫苗
另外在已上市的疫苗中,单磷酸脂质A也展现出了其强大的免疫增强效应(见表3)。

表3 已上市的含MPLA佐剂疫苗
FendrixTM:GSK研制的乙肝疫苗,该疫苗由乙肝病毒(HBV)表面抗原和AS04佐剂系统组成,用于预防和治疗由感染乙型肝炎病毒(HBV)引起的乙型肝炎。相比于传统铝佐剂乙肝疫苗,注射FendrixTM可以快速诱导更高水平的抗体滴度并且长时间维持保护机体的状态。注射部位出现严重疼痛、肿胀和发红的人数相对减少了5%[27]。
CervarixTM与 GardasilTM:宫颈癌主要是由感染两种高危型病毒株(HPV-16/18型)导致的,CervarixTM是由GSK研制的宫颈癌二价疫苗,由HPV L1表位的病毒样颗粒(VLP)与AS04系统组成;GardasilTM是由默克研发的宫颈癌四价疫苗,也含有AS04佐剂,除含有HPV-16/18型外,还含有HPV-6/11型,这两种疫苗均用于预防人类乳头状瘤病引起的子宫颈癌等疾病[28]。
ShingrixTM:由GSK研制的带状疱疹疫苗,使用AS01佐剂系统[29]。在没有广泛接种痘疫苗时,北美近90%的人群得过水痘带状疱疹(VZV),约 20%的成年人会在其一生中发展为带状疱疹。2018年,VZV糖蛋白E佐剂亚单位疫苗(ShingrixTM)被批准用于成年人预防带状疱疹[27]。
MosquirixTM(RTS,S/AS01):由GSK研制的疟疾疫苗,其组分包括重组恶性疟原虫环子孢子蛋白(RTS)、乙型肝炎表面抗原(S)和AS01。在针对儿童(5至17个月)和婴儿(6至12周)的III期研究中,疫苗对儿童的有效性高于婴儿,是第一个针对恶性疟原虫的疫苗[29-30]。
3 总结与展望
本文简单介绍了单磷酸脂质A类化合物的来源、结构以及含单磷酸脂质A的AS佐剂系统。单磷酸脂质A具有比传统铝盐佐剂更强的免疫活性、有效性和安全性,列举了其作为佐剂在上市疫苗中的应用。重点分析了两条化学合成单磷酸脂质A的路线,其中路线2更适于工艺研究,选取Nap作为保护基,最后用 DDQ 干净高效地脱除了Nap保护基,避免使用催化氢化,大幅提高了收率。但是,目前单磷酸脂质A的全合成依旧停留在毫克级别,还未大规模生产以商业化应用。因此,希望本文分析总结的单磷酸脂质A的合成方法,对其今后合成工艺研究以及工业化生产提供参考和帮助。
[1] Johnson D A, Sowell C G, Keegan D S,. Chemical synthesis of the major constituents of salmonella minnesota monophosphoryl lipid A[J]. Journal of Carbohydrate Chemistry, 1998, 17(9): 1421-1426.
[2] 张晓音, 吴旻, 李雨萌, 等. 脂多糖的效应及其机理研究进展[J]. 动物医学进展, 2015, 36(12): 133-136.
[3] Rietschel E T. Bacterial endotoxin: Chemical constitution, biological recognition, host response, and immunological detoxification[J]. Curr Top Microbiol Immunol, 1996, 216: 39-81.
[4] 何明洪, 朱德康, 陈华萍, 等. 脂质A参与免疫反应的结构基础研究进展[J]. 细胞与分子免疫学杂志, 2011, 27(001): 112-114.
[5] Alexander C, Zhringer U. Chemical structure of lipid A. The primary immunomodulatory center of bacterial lipopolysaccharides[J]. Trends in Glycoscience and Glycotechnology, 2010, 14(76): 69-86.
[6] Park B S, Dong H S, Kim H M,. The structural basis of lipopolysaccharide recognition by the TLR4-MD-2 complex[J]. Nature, 2009, 458(7242): 1191-1195.
[7] 刘兴, 冯文莉, 康格非. 脂多糖受体的研究进展[J]. 国际检验医学杂志, 2001, 22(3): 134-135.
[8] 赵虎, 孔宪涛. 单磷酸类脂A的免疫调节作用[J]. 国际免疫学杂志, 1992, (1): 1-4.
[9] Jiang Z H, Budzynski W A, Qiu D,. Monophosphoryl lipid A analogues with varying 3-O-substitution: Synthesis and potent adjuvant activity[J]. Carbohydrate Research, 2007, 342(6): 784-796.
[10] Salkowski C A, Detore G R, Vogel S N. Lipopolysaccharide and monophosphoryl lipid A differentially regulate interleukin-12, gamma interferon, and interleukin-10 mRNA production in murine macrophages[J]. Infection & Immunity, 1997, 65(8): 3239-3247.
[11] 郭忠武, 王千里, 唐寿初. 单磷酸化的脂质a衍生物: CN,102596220[P]. 2012-07-18.
[12] Qureshi N, Takayama K, Ribi E. Purification and structural determination of nontoxic lipid A obtained from the lipopolysaccharide of Salmonella typhimurium[J]. Journal of Biological Chemistry, 1982, 257(19): 11808-11815.
[13] Evans J T, Cluff C W, Johnson D A,. Enhancement of antigen-specific immunity via the TLR4 ligands MPL adjuvant and Ribi.529[J]. expert review of vaccines, 2003, 2(2): 219-229.
[14] Casella C R, Mitchell T C. Putting endotoxin to work for us: Monophosphoryl lipid A as a safe and effective vaccine adjuvant[J]. Cellular & Molecular Life Sciences, 2008, 65(20): 3231-3240.
[15] Pieretti G, Cipolletti M, D D’Alonzo,A combined fermentative-chemical approach for the scalable production of pure E. coli monophosphoryl lipid A[J]. Applied Microbiology & Biotechnology, 2014, 98(18): 7781-7791.
[16] Almostafa M, Allehyane B, Egli S,. Tandem mass spectrometry determination of the putative structure of a heterogeneous mixture of Lipid As isolated from the lipopolysaccharide of the gram-negative bacteria aeromonas liquefaciens SJ-19a[J]. Rapid Communications in Mass Spectrometry, 2016, 30(8): 1043-1058.
[17] Maiti K K, De Castro M, El‐Sayed A B M A,. Chemical synthesis and proinflammatory responses of monophosphoryl lipid A adjuvant candidates[J]. European Journal of Organic Chemistry, 2010, 2010(1): 80-91.
[18] Zamyatina, A, Sekljic H, Brade H,. Synthesis and purity assessment of tetra- and pentaacyl lipid A of chlamydia containing (R)-3-hydroxyicosanoic acid[J]. Tetrahedron, 2004, 60(52): 12113-12137.
[19] Verpalen E, Brouwer A J, Boons G J. Synthesis of monophosphoryl lipid A using 2-naphtylmethyl ethers as permanent protecting groups[J]. Carbohydrate Research, 2020, 498(108152): 1-8.
[20] Xia J, Abbas S A, Locke R D,. Use of 1,2-dichloro 4,5-dicyanoquinone (DDQ) for cleavage of the 2-naphthylmethyl (NAP) group[J]. Tetrahedron Letters, 2000, 41(2): 169-173.
[21] Gaunt M J, Yu J, Spencer J B. Rational design of benzyl-type protecting groups allows sequential deprotection of hydroxyl groups by catalytic hydrogenolysis[J]. Cheminform, 1998, 29(46): 4172-4173.
[22] 全文静, 徐静, 李树香. 含单磷酸脂质A及其类似物佐剂的研究进展[J]. 国际生物制品学杂志, 2021, 44(2): 109-114.
[23] 于永利. AS系列佐剂[J]. 微生物学免疫学进展, 2017, 45(1): 1-6.
[24] Wivine B, Andrea C, Viviane B.. Different adjuvants induce common innate pathways that are associated with enhanced adaptive responses against a model antigen in humans[J]. Frontiers in Immunology, 2017, 8(943): 1-17.
[25] Damme P V, Leroux-Roels G, Simon P,. Effects of varying antigens and adjuvant systems on the immunogenicity and safety of investigational tetravalent human oncogenic papillomavirus vaccines: Results from two randomized trials[J]. Vaccine, 2014, 32(29): 3694-3705.
[26] Lindemann M, Zaslavskaya M, Fiedler M,. Humoral and cellular responses to a single dose of fendrix in renal transplant recipients with non-response to previous hepatitis B vaccination[J]. Scandinavian Journal of Immunology, 2017, 85(1): 51-57.
[27] Reed S G, Carter D, Casper C,. Correlates of GLA family adjuvantsʼ activities[J]. Seminars in Immunology, 2018, 39: 22-29.
[28] Einstein M H, Levin M J, Chatterjee A,Comparative humoral and cellular immunogenicity and safety of human papillomavirus (HPV)-16/18 AS04-adjuvanted vaccine and HPV-6/11/16/18 vaccine in healthy women aged 18-45 years: Follow-up through Month 48 in a Phase III randomized study[J]. Human Vaccines & Immunotherapeutics, 2014, 10(12): 3455-3465.
[29] Lacaille-Dubois M A. Updated insights into the mechanism of action and clinical profile of the immunoadjuvant QS-21: A review[J]. Phytomedicine: International Journal of Phytotherapy and Phytopharmacology, 2019, 60: 1-12.
[30] RTS S C T P. Efficacy and safety of RTS,S/AS01 malaria vaccine with or without a booster dose in infants and children in Africa: Final results of a phase 3, individually randomised, controlled trial[J]. The Lancet, 2015, 386(9988): 31-45.
Progress in the Synthesis of Vaccine Adjuvant Monophosphoryl Lipid A and Its Application in Vaccines
WANG Xu-long1,2, LI Xue2, MA Xiao-xue1, ZHOU Cheng-kai1, SUI Qiang1*
(1. School of Chemistry and Chemical Engineering, Shanghai University of Engineering Science, Shanghai 201620, China;2. China State Institute of Pharmaceutical Industry, Shanghai 201203, China)
This paper briefly introduced the source and chemical structure of monophosphoryl lipid A, which is part of the structure of lipopolysaccharide inner layer lipid A on the outer membrane of Gram-negative bacteria. Two common synthetic routes of monophosphoryl lipid A were summarized, and their advantages and disadvantages were analyzed. It is pointed out that route 2 is the best synthetic method, which cleverly selected Nap as the protecting group. The Nap protective group was removed cleanly and efficiently with DDQ to avoid the use of catalytic hydrogenation, which was more suitable for process amplification research than route 1. Compared with biological extraction, chemical synthesis avoided the problems of sugar heterogeneity and low purity. Finally, the application of monophosphoryl lipid A as adjuvant in various vaccines was summarized, so as to provide reference for the further research of monophosphoryl lipid A.
monophosphoryl lipid A; lipopolysaccharide; synthesis; 2-naphtylmethyl; adjuvant; vaccine
2021-12-20
“重大新药创制”科技重大专项(2013ZX09301302-X-5)。
汪绪龙(1995~),男,安徽六安人,硕士;主要从事药物合成研究。
隋强(1977~),男,研究员,硕士生导师;主要从事糖疫苗佐剂研究。
R186.3
A
1009-220X(2022)03-0001-07
10.16560/j.cnki.gzhx.20220308
