自身免疫性胃炎23例临床病理分析
2022-06-28沈国菊王代文肖华静司晓凤徐嘉忆
沈国菊,王代文,肖华静,司晓凤,徐嘉忆
自身免疫性胃炎(autoimmune gastritis, AIG)又称为自身免疫性化生性萎缩性胃炎(autoimmune metaplasia atrophic gastritis, AMAG),既往曾被称为A型胃炎。AIG是一种由抗体攻击壁细胞所引起的疾病,常见于老年女性患者。有学者认为AIG是恶性贫血的早期状态,25%~40%的AIG患者后期发生了恶性贫血[1]。目前,AIG的确切病因尚未明了,有观点认为[2]遗传和环境因素似乎起决定性作用。AIG患者发生胃癌的风险是普通人的3倍,但罹患胃溃疡的风险较低,这是由于AIG患者胃黏膜壁细胞的数量减少甚至缺如,胃酸产生较少,甚至无胃酸分泌。该病主要累及壁细胞,因此取材部位的准确性非常关键。本文回顾性分析23例AIG的临床表现、病理学形态、内镜下特征及免疫表型,旨在提高临床和病理医师对AIG的认识水平。
1 材料与方法
1.1 临床资料收集攀枝花市中心医院2016年10月~2021年1月存档的23例AIG的临床资料,并对患者进行随访,所有病理切片均经两位病理专家再次阅片,确认。
1.2 免疫组化所有标本采用罗氏全自动免疫组化染色仪(BenchMark ULTRA)进行免疫组化染色,标记CgA(MX018)、Gastrin(兔多抗)及Ki-67(MIB1)。实验步骤严格按试剂盒说明书进行。所用一抗均购自北京中杉金桥生物公司。采用标本自身组织作为内对照。
2 结果
2.1 临床特征本组23例AIG患者均无特异性临床症状,多表现为腹痛、腹胀等腹部不适、消化不良等,其中16例为女性,7例为男性,年龄34~70岁,中位年龄54岁,发生于胃体17例,胃底7例(其中1例为胃体、胃底均有)。5例伴有不同程度的贫血,6例合并幽门螺杆菌(helicobacter pylori, HP)感染,2例伴甲状腺疾病。
2.2 内镜下特征23例的内镜下部位均包含胃底、胃体、胃窦等部位,活检组织1~3块不等,部分为黏膜切除标本,内镜下13例伴黏膜隆起,多为息肉状广基隆起(直径0.2~3.5 cm),10例呈慢性浅表性炎改变。
2.3 病理特征胃体/胃底黏膜活检结果表现为黏膜慢性炎伴壁细胞不同程度缺失(23例),呈“胃窦化”(图1A),程度不等的肠化(20例)(图1B),“假幽门腺样”化生(17例)及胰腺腺泡细胞化生(3例)(图1C)。23例患者中7例伴发增生性息肉(直径0.2~3.5 cm),5例伴腺上皮低级别上皮内瘤变,1例伴高级别上皮内瘤变,1例伴幽门腺腺瘤(图1D),1例伴胃腺癌,1例伴多灶神经内分泌肿瘤(图1E、2A)。而胃窦黏膜活检结果则显示大致正常的黏膜或慢性炎改变。
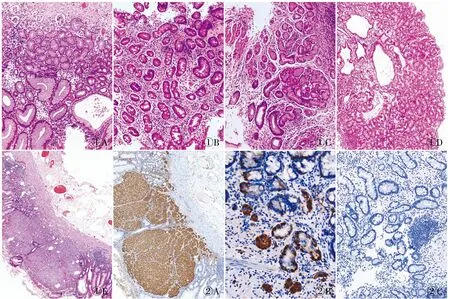
图1 A.胃底自身免疫性胃炎壁细胞明显减少,呈“胃窦化”;B.胃底自身免疫性胃炎示显著肠化;C.泌酸细胞减少,灶性见胰腺腺泡细胞化生;D.胃体自身免疫性胃炎伴发幽门腺腺瘤;E.多灶神经内分泌肿瘤 图2 A.神经内分泌肿瘤CgA呈阳性,EliVision两步法;B.CgA染色示神经内分泌细胞呈线性/结节性增生,EliVision两步法;C.Gastrin呈阴性,EliVision两步法
2.4 免疫表型CgA示胃黏膜腺体内或固有层内神经内分泌细胞呈线状或小团状、微结节状增生(图2B);胃体/胃底Gastrin呈阴性(图2C)或散在阳性,胃窦Gastrin染色呈增生性改变;Ki-67呈增殖区阳性。
2.5 治疗及随访本组7例伴增生性息肉、5例伴低级别上皮内瘤变、1例伴高级别上皮内瘤变、1例伴幽门腺腺瘤、1例伴多灶神经内分泌肿瘤患者均行内镜下黏膜切除术或黏膜下切除术,1例伴腺癌的患者行根治术。随访12~48个月,患者均存活。
3 讨论
AIG是一种渐进性的慢性炎症性病变,导致胃体、胃底黏膜的泌酸腺萎缩和取代性化生,胃酸减少甚至缺乏。AIG多见于白人,尤其是北欧人及其后裔,总体发病率约2 000人/10万,好发于老年女性[3];亦有研究结果显示,AIG也可发生于儿童,常被低估[4]。目前,国内关于AIG的报道较少。2017年Zhang等[5]报道了320例AIG,患者平均年龄60.6岁,女性占64.4%。2020年武鸿美等[6]报道了14例AIG,多为中老年人,平均年龄为55岁,女性多见(占85.7%)。本组23例患者均为中老年人,女性16例,占69.6%,与文献报道基本一致。
目前,人们对AIG的病因知之甚少,有观点认为[2]遗传和环境因素起决定性作用。也有研究[7]认为其与HP感染具有相关性,通过模拟机制分析其可能的机制是:在易感人群中,HP可介导产生抗壁细胞/抗内因子抗体。张贺军等[8]报道的AIG患者HP感染率为19.3%。本组23例患者中6例合并HP感染(26%),推测HP感染与AIG的发生有一定的相关性。
AIG主要累及壁细胞,化生和萎缩的改变只见于胃底和胃体部。因此,如果仅从患者的胃窦和胃体部取材,那么胃窦活检组织中一般无法查见明显的炎症以及化生、萎缩表现。而胃体活检组织则可查见广泛的壁细胞缺失及化生,在部分病例中可见一些壁细胞的残余细胞巢正在被慢性炎症细胞破坏。在萎缩较重的区域,残留的相对正常黏膜组织在内镜下有时会呈息肉样外观,相反在病变区域,黏膜表现为平坦、菲薄。所有病例均可见化生性改变,最常见的为肠上皮化生及“假幽门腺样”化生,其次为胰腺腺泡细胞化生,在胃底、胃体黏膜活检中若查见化生性改变,提示有AIG的可能,因为此特征在50%的AIG中可发现,而在其他胃炎中则较少见。其形态与胃窦黏膜非常相似,呈“胃窦化”,但其不分泌促胃液素,而真正的胃窦黏膜组织会分泌促胃液素。因此,这类患者行Gastrin染色通常呈阴性或散在阳性,该结果可用于排除取材部位不准确的可能(如内镜医师取材胃窦部误标记为胃体)。患者由于广泛的壁细胞缺乏而处于低胃酸状态,触发负反馈机制引起胃窦G细胞增生并产生丰富的促胃液素来刺激胃酸分泌,其副作用是促胃液素刺激导致神经内分泌细胞增生。因此,胃体、胃底组织的CgA染色会显示神经内分泌细胞呈线性或结节状增生,如果这种情况持续存在,其结果是导致神经内分泌肿瘤的形成。因此,AIG的主要诊断线索包括胃底、胃体黏膜活检出现以下特征[7]并且胃窦黏膜活检结果显示正常:(1)壁细胞缺失;(2)肠上皮化生;(3)“假幽门腺样”化生;(4)胰腺腺泡细胞化生;(5)Gastrin染色呈阴性或散在阳性;(6)CgA染色示神经内分泌细胞呈线性或结节状增生。
AIG患者常合并增生性息肉、幽门腺腺瘤等。美国门诊数据显示,约1.3%的门诊患者有增生性息肉,占所有胃息肉的15%~20%[9]。AIG基础上形成的增生性息肉,患者以老年女性多见,多为多发息肉,带蒂或无蒂,多分布在近端胃[10]。幽门腺腺瘤则比较少见,约30%是来源于AIG的患者,约1/3的患者有转变为癌的可能性[11]。因此,AIG被认为是一种癌前病变。本组病例中7例伴发增生性息肉,5例合并低级别上皮内瘤变,1例合并高级别上皮内瘤变,1例合并高~中分化腺癌,1例合并幽门腺腺瘤,1例合并多发神经内分泌肿瘤,与文献报道结果相符。AIG也常伴发其他自身免疫性疾病,常见的有I型糖尿病、自身免疫性甲状腺炎、缺铁性贫血、白癜风等[12],本组有2例伴甲状腺疾病。
AIG会引起多种病变,早期诊断及治疗对防止其进展有重要意义,然而其发病隐匿且无特异性表现,早期诊断较难。AIG患者因泌酸腺体的缺失,胃酸分泌减少甚至缺乏,而胃酸也是吸收无机铁所必需的,因此,缺铁症常见于AIG患者,而且通常先于维生素B12缺乏症出现,主要在年轻女性中发现。因此,慢性缺铁性患者,特别是那些对口服铁治疗效果不佳的患者,应评估是否存在AIG[13]。AIG若进展到组织学特征充分显露时较易诊断,但在其泌酸腺未完全缺失时,病理组织学检查要辨识AIG比较困难。其明显特征之一是神经内分泌细胞增生。有学者[7]总结在黏膜泌酸腺未完全缺失时的组织学特征,支持AIG诊断的组织学特征有:(1)同时存在黏膜固有层深部或弥漫的淋巴细胞/浆细胞浸润和灶性腺体的破坏;(2)上皮细胞化生性改变;(3)壁细胞假性肥大;(4)神经内分泌细胞呈现线性、结节状或更严重的增生。
目前AIG尚无法治愈,主要为对症治疗。疾病早期以预防为主,补充维生素B12可以缓减巨幼细胞贫血及改善神经系统症状,但并不能阻止AIG的进展[14]。对于有HP感染的患者,行根除HP治疗可以降低胃炎恶化的发生概率[15]。对于已发展为神经内分泌肿瘤的患者,欧洲神经内分泌肿瘤学会建议:对于病变直径不足1 cm的患者可选择随访或内镜下摘除;而1 cm以上的患者则根据其分期情况和淋巴结转移情况,决定其手术方式[16]。针灸、穴位敷贴配合口服中药治疗也可获得显著疗效[17]。研究显示,内镜下切除神经内分泌肿瘤的患者可获得长期无瘤生存[18]。患者行内镜切除后至少每2年随访1次,一般建议每3年内镜下随诊1次,重点关注胃黏膜的萎缩程度以及癌前病变情况。
综上所述,AIG较少见,无特异性临床症状,常合并其他自身免疫性疾病。对长期胃部不适的中老年患者要引起警惕,尤其是伴有贫血的患者。当内镜及组织学检查存在胃体、胃底黏膜萎缩、上皮化生以及神经内分泌细胞增生等表现时,要高度关注是否存在AIG。胃体、胃底与胃窦黏膜活检对AIG确诊有重要意义。HP感染与AIG发病的相关性尚不明确。目前主要以对症治疗为主。对已确诊或怀疑AIG的患者,应进行长期随访(主要为内镜随访),对存在重度萎缩以及癌前病变患者应加强监测,必要时取黏膜活检辅助评估。
