“美酒”白掌茎尖培养及组培快繁技术
2022-06-28吴贤彬黄明翅宿庆连曾伟达周晓云
吴贤彬,黄明翅,夏 晴,宿庆连,曾伟达,周晓云
(广州花卉研究中心,广东 广州 510360)
“美酒”白掌(Spathiphyllum kochii ‘mojo’)是白掌的一个栽培品种,其花叶具有较高的观赏价值,且株型娇小、耐阴,又具有净化室内空气的功效[1],适合家庭及办公场所摆放,深受广大消费者的喜爱,其市场前景广阔。
茎尖培养并进行组培快繁是获得优质种苗的重要途径,该技术已应用于部分作物[2-3]、果蔬[4-5]、花卉[6-8]种苗的繁殖生产中。目前。关于白掌组培快繁的研究报道较多,常用叶片、叶柄、顶芽、茎段、花梗、花序等组织或器官作外植体,表面消毒难度均较高,污染率介于10%~87%之间[9],外植体损耗大,且经过多代培养后,易产生内生细菌而影响其后续增殖及成苗质量。白掌茎尖被叶柄紧密包裹,受环境污染的影响较小,但剥取困难。目前,关于白掌茎尖离体培养和快繁的研究鲜有报道。因此,研究“美酒”白掌茎尖离体培养技术,对提高其外植体利用率、生产优质种苗具有重要的现实意义。
1 材料与方法
1.1 供试材料
选取广州花卉研究中心生长健壮、无病虫害的2年生“美酒”白掌。
1.2 试验方法
1.2.1 茎尖消毒 将整株切下,留茎段(带4~5片叶柄)约5 cm,冲洗、晾干。用0.6%含氯消毒溶液(以君鸿牌消毒粉配制,其有效氯质量分数为18%~21%)振荡清洁40 min,期间换1次消毒液;再用去离子水冲洗干净,在无菌条件下剥去2片叶柄,加入0.1% HgCl2溶液再分别浸泡消毒4、8和12 min;用灭菌去离子水冲洗6次,吸干水分,剥取直径1~2 mm茎尖,测量其基部直径,并培养于1/2MS+0.6 mg/L 6-BA+0.1 mg/L IBA培养基上,每处理10个茎尖,3次重复。培养30 d后统计其污染茎尖数,并计算污染率;40 d后测量茎尖基部直径,计算茎尖生长量。计算公式如下:
污染率(%)=污染茎尖数/茎尖总数×100%
茎尖生长量(mm)=培养后茎尖基部直径(mm)-培养前茎尖基部直径(mm)
1.2.2 茎尖培养 将灭菌茎尖培养在不同基本培养基(MS、1/2MS、1/4MS)、含不同浓度细胞分裂素(6-BA、KT)、含不同浓度生长素(NAA、IBA、IAA)培养基中,每处理接种6个茎尖,3次重复。培养40 d后测量茎尖基部的直径,并计算茎尖生长量。测量后转接至1/2MS+0.6 mg/L 6-BA+0.1 mg/L IBA培养基继续培养,直至分化出丛生芽。
1.2.3 丛生芽增殖培养 将丛生芽以单芽、双芽、三芽和四芽的团块接种培养在不同基本培养基(MS、3/4MS、1/2MS),并添加0.6 mg/L 6-BA和0.02 mg/L NAA的培养基中,每瓶培养基4个芽团,每处理5瓶,3次重复。培养40 d后统计其丛生芽数,并计算丛生芽增殖率。
将丛生芽以单芽形式培养在分别含6-BA(0.6、1.0、1.5 mg/L)与生长素(0.02、0.05 mg/L NAA,0.1 mg/L IBA)的9种3/4MS培养基上,每瓶4个单芽,每处理5瓶,3次重复。培养40 d后统计其丛生芽数,并计算丛生芽增殖率。计算公式如下:
丛生芽增殖率(%)=培养后丛生芽总数/接入芽总数×100%
1.2.4 生根培养 当植株达到3 cm高,并且具有3片叶时,将切除根的植株培养在分别添加0.5 mg/L生长素(NAA、IBA、TRP)的1/2MS培养基中诱导生根。每瓶10株,每处理5瓶,3次重复。培养15、30 d后各统计1次生根植株数,计算生根率。计算公式如下:
生根率(%)=生根植株数/接入植株数×100%
1.2.5 移栽 生根培养30 d后,将生根苗的瓶盖拧松,放置在温室内炼苗7 d;取出苗并洗净,移栽于填满泥炭基质(0~20 mm)的72孔穴盘中,在温室温度为(26±2) ℃、空气相对湿度约为80%的条件下栽培;分别于培养7、35 d时测量株高及统计叶片数,计算其株高生长量及叶片的增加数。
切取株高大于4 cm,且具有3片叶以上、2条根的丛生芽带根单株,在同样条件下栽种、管理与测量,计算株高生长量及叶片增加数。计算公式如下:
株高生长量(mm)=培养35 d的株高(mm)-培养7 d的株高(mm);
叶片增加数=培养35 d的叶片数-培养7 d的叶片数
1.3 培养条件
茎尖在光强6 μmol/(m2·s)条件下培养7 d后,转入光强为25~30 μmol/(m2·s)的条件下培养。光照时间为10 h/d,温度为(24±2) ℃,空气相对湿度为60%。
丛生芽增殖、生根均在光强为25~30 μmol/(m2·s)的条件下培养。其他条件同茎尖培养。
1.4 数据分析
数据以平均数±标准误(SE)表示,采用Excel 2016、SPSS 19软 件 进 行 统 计 分 析,应 用Duncan’s法进行多重比较。
2 结果与分析
2.1 茎尖消毒
由表1可知,茎尖经0.6%含氯消毒溶液浸泡40 min后,再用0.1% HgCl2分别消毒4、8和12 min,表面菌类基本被杀灭,同时茎尖均存活,仅4 min处理的出现1个污染,说明该消毒方法有效;但随着消毒时间的增加,茎尖生长逐渐减缓,表明0.1% HgCl2消毒时间长对茎尖生长有一定的抑制作用,但差异不显著。因此,选择0.1% HgCl2消毒4 min,这样既能有效杀灭茎尖表面的菌类,同时也对茎尖生长的影响较小。

表1 0.1% HgCl2不同消毒时间对茎尖生长的影响
2.2 茎尖培养的影响因素
2.2.1 基本培养基对茎尖生长的影响 由表2可知,培养于MS和1/2MS上的茎尖生长量显著大于培养于1/4MS上的,且培养于1/2MS上的茎尖生长量最大,为3.66 mm。这表明不同浓度基本培养基对茎尖生长量有显著影响,适合于茎尖生长的基本培养基是1/2MS,高浓度或低浓度都不利于茎尖的生长。

表2 基本培养基对茎尖生长的影响
2.2.2 细胞分裂素对茎尖生长的影响 由表3可知,适量的6-BA和KT均适合“美酒”白掌茎尖生长,但对茎尖生长量的影响差异不显著。在1/2MS+0.6 mg/L KT+0.1 mg/L IBA培养基上,其茎尖生长量最大,为3.22 mm,与0.2 mg/L 6-BA和KT处理相比,更能促进茎尖生长。

表3 细胞分裂素对茎尖生长的影响
2.2.3 生长素对茎尖生长的影响 由表4可知,培养在1/2MS+0.6 mg/L KT+0.1 mg/L IBA上的茎尖获得了最大生长量,达到2.81 mm,显著大于培养在1/2MS+0.6 mg/L KT+0.1 mg/L NAA 上的。这表明IAA、IBA在促进茎尖生长方面优于NAA,且低浓度IBA也优于高浓度IBA。将所有茎尖培养在1/2MS+0.6 mg/L 6-BA+0.1 mg/L IBA培养基上2个周期(80 d),大部分茎尖可以分化出丛生芽。

表4 生长素对茎尖生长的影响
2.3 丛生芽增殖的影响因素
2.3.1 基本培养基与接种不同芽团对丛生芽增殖的影响 由表5可知:在3/4MS上培养的丛生芽增殖率最高,平均为3.41,且以双芽接种的最高(4.04);在不同基本培养基上接种单芽和双芽的平均增殖率分别为3.41和3.38,显著高于接种四芽的;单芽接种于MS上的高于另外3种芽团类型,且与3/4MS上的差异不显著。由此表明,不同浓度基本培养基与接种不同芽团对“美酒”白掌丛生芽增殖具有显著的影响,且其丛生芽增殖以单芽接种培养于MS上或双芽接种培养于3/4MS上较为合适。
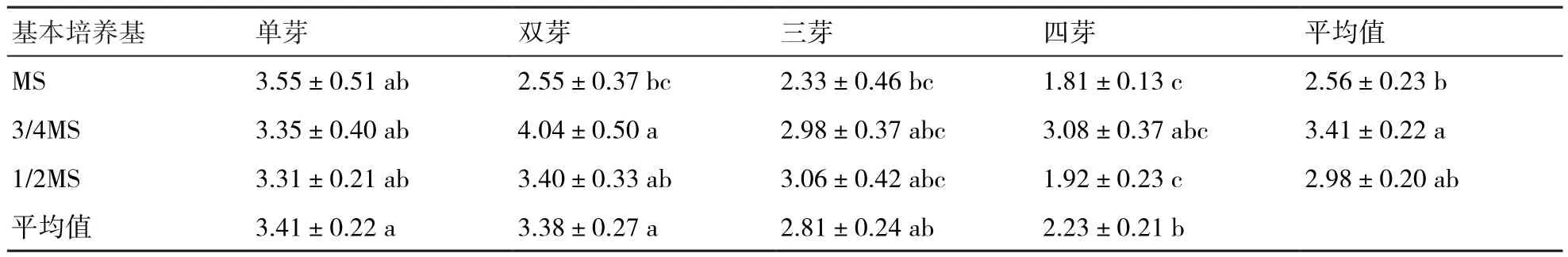
表5 基本培养基与接种不同芽团对丛生芽增殖率的影响
2.3.2 生长调节剂对丛生芽增殖率的影响 由表6可知,培养于1.5 mg/L 6-BA上的丛生芽增殖率最高,平均为3.31,显著高于培养在另外2个浓度水平的处理。培养于IBA上的丛生芽增殖率为3.07,略高于培养在NAA上的,但不同浓度及类型生长素对丛生芽增殖影响差异不显著。结果表明:不同浓度6-BA与生长素配比对“美酒”白掌丛生芽增殖具有显著影响。培养在3/4MS+1.5 mg/L 6-BA+0.1 mg/L IBA培养基上的丛生芽,其增殖率最高,为3.49,优于或显著优于其他配比下的培养基。

表6 6-BA与生长素配比对丛生芽增殖率的影响
2.4 生长素对生根的影响
由表7可知,不同生长素及生根时间对丛生芽生根的影响不同。在3种生根培养基上,培养15 d后的丛生芽生根率均超过50%,30 d后的生根率可达90%以上。生根培养15 d后,TRP诱导丛生芽的生根率最高,为66.43%,显著高于NAA的培养基,但生根培养30 d,差异不显著,说明TRP更有利于丛生芽生根。
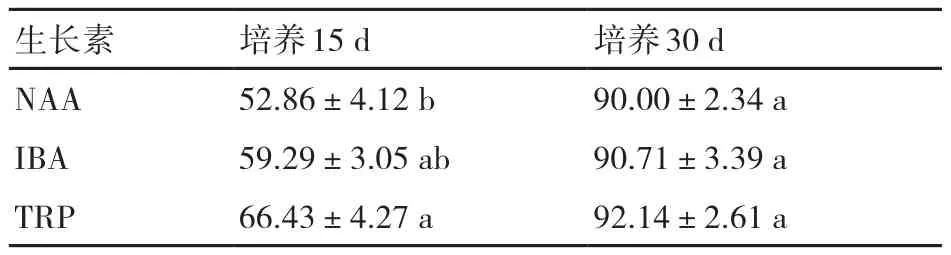
表7 生长素对生根率的影响 %
2.5 生长素对移栽后组培苗生长的影响
由表8可知,用IBA生根的苗移栽35 d后其株高生长量最大,为1.38 cm;与应用NAA(1.04 cm)、TRP(0.84 cm)生根,以及带根丛生芽单株(0.90 cm)直接移栽的差异显著。经生根培养的组培苗移栽35 d后均长出2片新叶,显著高于直接移栽的。结果表明:应用IBA、NAA生根,对组培种苗移栽初期(35 d)株高和长新叶均有一定的促进作用。

表8 生长素对移栽后组培苗生长的影响
3 结论与讨论
建立白掌快繁体系所用外植体有花序[10-12]、顶芽[13-15]、侧芽[16-18]、茎段[19-20]、叶片和叶柄[21],其污染率低的有10%,高的可达87%,损耗了大量的外植体。增加消毒时间可降低污染率,但会影响其存活率、生活力[9]。本试验采用1~2 mm的茎尖建立“美酒”白掌的无菌系,茎尖消毒成功率达到97%以上,充分利用、节省了外植体。在建立无菌系的过程中,用顶芽、侧芽诱导丛生芽相对于用叶片、叶柄诱导愈伤组织产生不定芽更容易,且变异率更低[16]。叶片和花梗难以诱导出芽,而侧芽和茎段是最合适的外植体[22]。刘晓青等[23]认为芽诱导产生丛生芽的增殖方式具有遗传稳定性高的优点。在本试验中,茎尖培养120 d后即诱导出丛生芽,经多代增殖培养,未发现可见变异,可见芽增殖方式的遗传稳定性较高。
在白掌快繁体系中,顶芽(茎尖)、腋芽常见的初代培养配方是MS+1.5~2.0 mg/L 6-BA+0.1~0.2 mg/L NAA[13-19]。本试验发现,培养1~2 mm的茎尖,KT优于6-BA,且低浓度就能让茎尖较好地生长;观察发现长大的茎尖能很好地诱导出丛生芽而不产生愈伤,这有利于降低后期芽增殖产生变异的可能。
白掌生根使用IBA、NAA或两者搭配,生根率在95%以上,两者混合生根优于IBA,且IBA的生根效果又优于NAA[16]。本试验得出了类似结论,并发现TRP的生根效率优于IBA、NAA,但移栽后,小苗在株高生长量及叶片数增加上均不如IBA和NAA,其原因有待进一步试验研究。
白掌在增殖过程中根芽同步生长,可省去生根过程,缩短组培周期,节省生产成本[24-25]。本试验发现,“美酒”白掌在增殖过程中能根芽同步,带根丛生芽单株在温室栽培条件下移栽存活率可达100%。对组培生根苗和带根丛生芽单株进行移栽比较发现,移栽35 d内,生根苗的生长速度显著快于带根丛生芽单株小苗。可见,白掌在组培过程中省去生根过程,能节省成本,但会显著影响组培苗移栽后初期的生长,其可能原因是丛生芽单株移栽初期,小苗未能适应环境的改变。若在增殖末期增加1~2周的时间,以炼苗环境条件来培养增殖芽,则带根丛生芽单株可能达到生根苗移栽的相似效果,从而实现缩短其组培生产周期、节约生产成本且不影响苗生长的目标。
