瑞戈非尼通过抑制Wnt信号通路调控肝癌进展的分子机制
2022-06-27陈建南吴进盛于莉余华军
陈建南 吴进盛 于莉 余华军
(1儋州市人民医院药剂科,海南 儋州 571700;2海南医学院第一附属医院肿瘤姑息治疗科)
肝细胞癌是原发性肝癌的主要形式,由于其5年生存率较低,是导致肝癌死亡的第二大原因〔1〕。肝细胞癌作占世界范围内总肝癌病例的70%~85%〔2〕。世界范围内每年新诊断的肝癌的患者超过780 000例〔3〕。肝细胞癌的发生和恶性进展依赖于遗传、环境和生活方式因素之间复杂的相互作用〔4〕。肝细胞癌通常发生在慢性肝损伤的环境中,进而导致炎症、肝细胞再生、肝基质重构、纤维化和肝硬化,其中肝硬化是肝细胞癌最重要的危险因素〔5〕。
目前肝细胞癌的治疗方案包括肝部分切除、肝移植和局部区域治疗〔6〕。对于无法再获得治疗的晚期肝细胞癌患者多激酶抑制剂索拉非尼是一线治疗药物,其可以较好地维持肝脏功能〔7〕。然而,对于临床上索拉非尼耐药的患者,在瑞戈非尼被美国食品药品监督管理局(FDA)批准前,一直没有有效的治疗方案〔8〕。瑞戈非尼作为一种多靶点激酶抑制剂,主要适用于先前接受索拉非尼治疗且耐药的肝细胞癌患者〔9〕。瑞戈非尼是首个也是唯一一个能够显著改善肝细胞癌患者总生存期的二线治疗药物〔10〕。对于多吉美治疗期间疾病出现进展的肝细胞癌患者,在接受瑞戈非尼治疗后,总生存期得到统计学意义和临床意义的改善〔11〕。
Wnt信号通路在进化中高度保守,普遍存在于脊椎动物和无脊椎动物中,调节细胞的增殖、分化及死亡,在维持机体正常生长和代谢等方面发挥重要作用〔12〕。经典的Wnt信号通路包括蓬乱蛋白受体家族的激活及β-catenin在细胞核中水平上调,从而导致细胞的异常增殖。目前众多癌细胞中均发现了Wnt信号持续活化〔13〕,其中,Wnt信号通路的失控与肝细胞癌的发生亦密切相关〔14〕,瑞戈非尼作为首个获批用于肝细胞癌的二线治疗的新药,瑞戈非尼的靶点包括c-RAF、突变型b-RAF、血管内皮生长因子受体和成纤维细胞生长因子受体等生长信号和血管生成因子反应的重要中介〔10〕。由于Wnt信号通路在肝细胞癌中异常激活,本研究旨在探究瑞戈非尼处理是否可通过调控Wnt信号通路而发挥抗癌作用。
1 材料和方法
1.1试剂和材料 瑞戈非尼由拜耳公司(大中华区)提供,雄性野生型C57BL/6小鼠购买自上海斯莱克生物有限公司,二乙基亚硝胺(DEN,货号:N0725) 和青/链霉素(货号:N03294)自Sigma Aldrich公司,小鼠饲料(货号:D12450Bi)购买自Research diet公司,β-catenin抗体(货号:AB30482)、糖原合成酶激酶(GSK)-3β抗体(货号:AB11291)、重组蛋白A/G-琼脂糖凝胶珠(货号:D39492)购买自上海煊翎生物有限公司。
1.2小鼠肝癌模型的构建 雄性野生型C57BL/6小鼠饲养在(23±3)℃,湿度35%±5%,12 h/12 h的暗/光循环的房间里(早上6∶30开灯),自由进水和饲料。肝癌模型是在4周龄野生型C57BL/6小鼠的腹腔注射25 mg/kg的DEN溶液,对照组注射同剂量的生理盐水,每组20只,1次/w,连续注射4 w,然后小鼠正常饲料连续饲养24 w。
1.3瑞戈非尼药物处理 在DEN处理20 w后,将对照组和肝癌模型组随机分为2个亚组,每组10只,即对照组,瑞戈非尼处理组,肝癌模型组,肝癌瑞戈非尼处理组4组,其中瑞戈非尼处理组、肝癌瑞戈非尼处理组每天灌胃给予瑞戈非尼10 mg/kg,对照组给予同体积的生理盐水,每天给药一次,连续给药4 w。给药期间,定期检测小鼠体重。给药结束后1%戊巴比妥钠麻醉动物,小鼠心尖取血,取出肝脏,称量肝脏重量,测量肿瘤相关参数,并将肝脏组织取材后立即放入液氮冷冻,然后放入-80℃保存。所有动物实验按照动物保护与使用委员会批准的方案进行。
1.4检测肿瘤相关参数 计数肝脏中肿瘤的数量,用游标卡尺测量不同肿瘤结节的最长直径并统计不同直径肿瘤的数量,测量肿瘤的最长直径和最短直径及肿瘤的高度,根据V=长×宽×高×π/6计算肿瘤的体积,并统计4组之间的肿瘤相关指数的差异。
1.5苏木素-伊红(HE)染色 用4%多聚甲醛固定液固定肝脏组织,样品脱水处理,石蜡浸蜡包埋,然后切片,用石蜡切片进行HE染色,经过二甲苯脱蜡和不同浓度乙醇水化,苏木素染色液染色5 min,冲洗去多余的染色液,伊红染色液染色30 s,脱水、透明、封片后显微镜下观察拍照,观察各组小鼠肝脏组织的基本形态。
1.6免疫组化染色 石蜡切片经过二甲苯脱蜡和不同浓度乙醇水化,然后高温加热抗原修复,山羊血清封闭液,室温封闭30 min,加入β-catenin抗体,室温静置2 h,然后加入二抗,室温静置1 h,苏木素复染30 s,脱水透明最后中性树胶封片,显微镜下观察结果,观察β-catenin在各组小鼠肝脏切片中的表达量。
1.7Realtime PCR技术 提取总RNA,Trizol室温裂解细胞,氯仿分离去除蛋白,取水相加入异丙醇萃取RNA沉淀,用75%酒精(DEPC水配制)洗涤沉淀,晾干残留乙醇,将沉淀溶于适量DEPC水中,检测RNA纯度及浓度。用M-MLV逆转录系统进行反转录,得到cDNA。使用Applied Biosystems公司的SYBR Green PCR system,以actin为内参,进行基因的实时荧光定量PCR (qRT-PCR)比较相关基因表达差异。
所使用的引物合成于上海生工有限公司,序列如下:小鼠actin:正向 5′-AGCTCGATCGATCGCTCG-3′,反向 5′-GTCTCGTCGCTCGCTATCTGG-3′;小鼠β-catenin:正向 5′-CAGCGCTGTCGCTGCAG-3′,反向 5′-ACGCTGCTAACCACCGCCTCTGG-3′;小鼠G1/S-特异性周期蛋白(cyclin)D1:正向 5′-ATATGTGTCGATGTGA-3′,反向 5′-ACCCCTCGCTCGCTA-GACCA-3′;小鼠基质金属蛋白酶(MMP)9:正向 5′-ACACCGTCGTGACGGTTC-3′,反向 5′-CCG-GGCTGAATCCCGGACAAT-3′。
1.8CO-IP技术 肝脏组织用研磨仪在添加了蛋白酶抑制剂的CO-IP裂解液裂解,置于冰上30 min后,4℃,20 000 r/min离心15 min,收集上清,每个IP反应中加入2 μg GSK-3β抗体,4℃温和旋转2 h。然后加入蛋白G/A 琼脂糖凝胶珠使其终浓度为2.5%(V/V),4℃旋转2 h。4℃,3 000 r/min离心3 min收集琼脂糖凝胶珠,并用IP洗液洗3次。洗后的珠子加入SDS上样缓冲液并煮沸10 min,随后12 000 r/min,室温离心5 min,上清用于免疫印迹检测,检测GSK-3β和β-catenin的蛋白结合水平。
1.9数据统计 采用Graphpad Prism6.0软件进行two-way ANOVA检验。
2 结 果
2.1各组小鼠状态及体重的变化 4组小鼠在实验过程中均未出现死亡。表1小鼠体重监测表可以看出,DEN处理的肝癌模型组给药8 w后体重明显低于对照组(P<0.001),且给予瑞戈非尼干预后,肝癌瑞戈非尼处理组小鼠体重开始缓慢上涨,肝癌瑞戈非尼处理组体重明显高于肝癌模型组(P<0.01)。
2.2肿瘤相关指标比较 肝癌模型组的肝脏重量/体重比,肝脏肿瘤数量,肿瘤的最大直径及最大肿瘤体积均显著高于对照组(P<0.001)。肝癌瑞戈非尼处理组的肝脏重量/体重比,肝脏肿瘤数量,肿瘤最大直径及最大肿瘤体积均显著低于肝癌模型组(P<0.01)。见表2。
2.3各组肝脏HE染色 对照组和单纯的瑞戈非尼处理组肝脏组织结构清晰,可以看到肝小叶轮廓清楚完整,肝细胞索排列整齐,肝窦清晰可见,未有显著的增生和凋亡现象。肝癌模型组可以看到肝癌组织排成细梁状的假小叶状结构,癌细胞呈多边形,体积明显增大,核质比增大,核染色加深,胞质嗜酸性增强。而给予瑞戈非尼处理后,肝癌组织体积变小,癌细胞形状较肝癌模型组略规,部分细梁状排列,假小叶状结构较肝癌模型组减少。见图1。
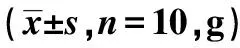
表1 各组体重监测

表2 各组肿瘤相关指标及cyclinD1、MMP9表达比较
2.4各组肝脏Wnt/β-catenin信号通路表达 瑞戈非尼可显著逆转肝癌组织中cyclinD1、MMP9的高表达,差异有统计学意义(P<0.01)。见表2。
2.5各组肝脏组织中β-catenin的亚细胞定位 对照组和瑞戈非尼处理组β-catenin主要是分布于细胞质,且在肝脏组织中表达较少。与对照组比较,肝癌模型组组织中β-catenin的表达水平显著升高(1.02±0.13 vs 2.65±0.43,P<0.01),且β-catenin以核内分布为主。与肝癌模型组比较,当给予瑞戈非尼处理后,小鼠肝癌组织中β-catenin明显减少(1.45±0.27,P<0.05),见图2。
2.6瑞戈非尼调控β-catenin和GSK3β的结合 与对照组比较,肝癌模型组小鼠肝脏中GSK-3β和β-catenin蛋白的相互作用减弱(1.13±0.21 vs 0.47±0.13;P<0.05),β-catenin蛋白增加进而入核增加;而给予瑞戈非尼后,相较于肝癌模型组GSK-3β和β-catenin蛋白表达明显增加(2.14±0.58,P<0.001),见图3。

图1 小鼠肝脏HE染色

图2 各组肝脏β-catenin的表达及定位(免疫组化)
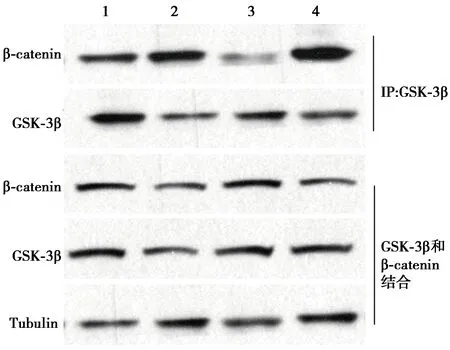
1~4:对照组、瑞戈非尼处理组、肝癌模型组、肝癌瑞戈非尼处理组图3 瑞戈非尼对β-catenin和GSK-3β结合的调控
3 讨 论
近年来,我国肝癌的发病率呈上升趋势,复发率较高。传统的辅助治疗、放疗和化疗研究进展缓慢,严重影响肝癌患者的生存率,因此寻找更有效的靶向药物势在必行〔2,3〕。越来越多的研究表明,肝细胞癌的发生与癌基因的过表达和肿瘤微环境有关〔15〕。目前在体研究显示瑞戈非尼可抑制肿瘤发生,肿瘤血管生成,转移和肿瘤免疫〔16〕。此外瑞戈非尼作用于肿瘤细胞中的多个激酶包括血管内皮生长因子受体1~3、血管生成素受体2、血小板衍生生长因子受体β、成纤维细胞生长因子受体、原癌激酶等,通过抑制肿瘤微环境抑制肿瘤血管生成〔17〕。
Wnt/β-catenin通路与肝细胞癌的生长和侵袭密切相关的信号转导通路,Wnt/β-catenin通路的异常激活在肝癌肿瘤进展中具有关键作用。Wnt蛋白质结合跨膜受体(Fizzled),激活经典Wnt/β-catenin途径,Wnt信号的激活可以抑制β-catenin“蛋白降解复合体”的形成,β-catenin不再进入降解途径而是转移到细胞核内,β-catenin在细胞核内累积,与TCF/LEF转录因子家族相互作用从而激活特定基因的转录表达,如cyclinD1、MMP9的转录表达,促进肿瘤细胞的增殖和迁移〔18,19〕。
本研究结果发现瑞戈非尼处理可改善肝癌小鼠的体重,减少肝脏肿瘤数量,肿瘤的最大直径及最大肿瘤的体积。体外细胞学实验结果显示瑞戈非尼对HepG2细胞的增殖及活性具有显著的抑制作用。分子水平检测发现瑞戈非尼主要通过促进GSK-3β和β-catenin的蛋白相互作用,促进β-catenin降解复合体的形成,抑制肝癌组织细胞核内β-catenin的累积,逆转肝癌组织中cyclinD1、MMP9的高表达,最终抑制肝脏癌细胞的增殖和侵袭。据报道,肿瘤细胞来源的经典的Wnt/β-catenin信号通路可促进M2型巨噬细胞极化,导致肝脏癌细胞的迁移、转移、生长和免疫逃逸〔18〕。
综上,肝细胞癌组织中的Wnt/β-catenin通路过度激活是肝细胞癌预后不良的标志之一。抑制Wnt/β-catenin通路的过度激活是瑞戈非尼治疗肝细胞癌的一个重要靶点。瑞戈非尼负性调控肝细胞癌细胞中Wnt/β-catenin信号通路的激活抑制细胞增殖和侵袭。这一发现为瑞戈非尼的抗癌机制提供了一个新的理论依据,同时也证实了肝癌的治疗靶点Wnt/β-catenin通路在肝细胞癌发病中的重要作用。
