长链非编码RNA NEAT1在急性缺血性脑卒中的诊断价值
2022-06-27郑海建王翎刘广岚潘旭东
郑海建 王翎 刘广岚 潘旭东
(1连云港市赣榆区人民医院 扬州大学医学院附属医院神经内科,江苏 连云港 222100;2苏州大学附属第一医院全科医学科)
急性缺血性脑卒中(AIS)占全部脑卒中的60%~85%,是脑卒中最常见的一种类型,AIS的发病机制是一个多环节、多因素、多机制的恶性级联过程,其中脑缺血再灌注损伤(I/R)及其炎症反应是引起神经损伤的重要因素。目前AIS的诊断主要依靠神经影像技术,但由于昂贵的成本和侵袭性并不适合所有患者〔1〕,因此,探索无创高敏感性生物标志物用于AIS的早期诊断至关重要。长链非编码RNA核富集丰富的转录本(LncRNA NEAT)1与许多细胞内调节因子相互作用,在心、脑血管病病理过程中发挥关键作用,在I/R过程中表达上调,LncRNA NEAT1能通过诱导凋亡途径直接相关的下游因子而造成细胞损伤,参与脑卒中的病理过程〔2〕。本研究分析LncRNA NEAT1在AIS中的诊断价值,可以为该病的诊断及预后评估提供理论参考。
1 对象与方法
1.1研究对象 病例组:选自2019年8月至2020年4月就诊于连云港市赣榆区人民医院神经内科住院的AIS患者83例(AIS组),其中男46例、女37例,年龄在40~90岁;入组标准:①发病72 h内;②患者诊断均符合中国急性缺血性脑卒中诊治指南(2014)诊断标准〔3〕,而且经头颅CT或磁共振成像(MRI)检查发现相对应的责任病灶;③MRI证实AIS。排除标准:①既往脑卒中病史;②存在急性炎症、肿瘤、严重心脏、肝、肾及血液系统疾病;③手术及外伤史;④弥漫性肌肉疾病史;⑤自身免疫性疾病。对照组(NC组):选取同期就诊于医院门诊体检者40例,其中男19例、女21例,年龄40~90岁。纳入及排除标准:体格检查中无脑血管病证据和(或)头颅MRI/CT检测正常者,排除患严重肝、肾疾病、恶性肿瘤及自身免疫性疾病。
1.2标本采集与检测 受试者均隔夜禁食12 h,于清晨安静状态下留取空腹静脉血5 ml,标本用无菌试管留取,枸橼酸钠抗凝。室温放置2 h后,以5 000 r/min离心10 min后,分离血浆,取血浆冻存于-80℃冰箱待检。5 ml注入生化专用的试管,分离血清,西门子ADvia2400全自动生化分析仪检测生化指标,包括空腹血糖(GLU)、总胆固醇(TC)、三酰甘油(TG),低密度脂蛋白胆固醇(LDL-C),高密度脂蛋白胆固醇(HDL-C)。检测条件符合实验室质控标准,检测结果可靠。
1.3血浆LncRNA NEAT1及IL-8测定 采用实时荧光定量聚合酶链反应(qRT-PCR)检测血浆LncRNA NEAT1表达,试剂盒由美国Applied Biosystems公司提供,检测仪型号ABI-7300;酶联免疫吸附试验(ELISA)检测血浆白细胞介素(IL)-8;试剂盒由上海富勒生物科技有限公司提供,所有操作按照试剂盒说明书步骤进行。
1.4观察项目、指标、评价标准 神经功能缺损评分用美国国立卫生研究院脑卒中量表(NIHSS)评定〔4〕。
1.5统计学方法 采用SPSS19.0软件进行t检验、χ2检验、秩和检验、Pearson相关分析,非正态分布资料采用Spearman非参数统计分析。用受试者工作特征(ROC)曲线评估血浆LncRNA NEAT1对AIS的诊断效能。
2 结 果
2.1两组一般特征及AIS危险因素比较 两组比较性别、高血压史、糖尿病史、冠心病史、吸烟史、饮酒史、TC、LDL-C、GLU差异无统计学意义(P>O.05)。两组年龄、TG、HDL-C、IL-8比较差异有统计学意义(P<0.05)。见表1。
2.2两组血浆LncRNA NEAT1比较 AIS组血浆LncRNA NEAT1表达量高于NC组,差异有统计学意义(P<0.001)。见表1。
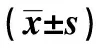
表1 两组的基本信息比较
2.3AIS组血浆LncRNA NEAT1与NIHSS及一般资料的相关性 血浆LncRNA NEAT1与NIHSS (r=0.460,P=0.000)、IL-8(r=0.324,P=0.003)呈正相关,与年龄(r=0.168,P=0.130)、TC(r=0.038,P=0.734)、TG(r=-0.120,P=0.280)、LDL(r=0.109,P=0.325)、HDL-C(r=-0.065,P=0.559)、GLU(r=-0.011,P=0.918)均无显著相关性。
2.4ROC曲线分析 LncRNA NEAT1对AIS患者的诊断价值较大,最佳诊断界值为0.019,约登指数为0.486,ROC曲线下面积(AUC)为0.747,95%CI为0.657~0.837。
3 讨 论
AIS主要是由于颈动脉或椎动脉血栓栓塞而导致血流突然中断或减少,血氧及营养物质不能满足神经细胞正常功能需求,导致神经细胞的缺血、坏死,进而引起神经功能障碍的临床症状综合征。AIS的病理生理过程复杂,I/R在缺血性脑血管病急性期的各个环节中起着重要作用。再灌注对于缺血性脑组织恢复正常功能是必不可少的,但它可能导致继发性损伤;由于脑缺血恢复血液再灌注后,包括再灌注时氧自由基爆发、兴奋性氨基酸毒性、炎症反应、细胞凋亡等一系列级联反应使得神经损伤和功能障碍反而进一步加重;首先,脑缺血后早期再灌注损伤可加重缺血程度而导致二次缺血损伤的病理生化级联反应〔5〕。其次,在脑缺血发作后几分钟到几小时内,常驻细胞的激活会引发一系列炎症事件。而炎症带来的脑继发性损伤的治疗时间窗较动脉闭塞后的原发性损伤更长〔6〕。第三,脑I/R损伤的发病机制中氧化应激起重要作用。由于氧自由基过量产生引起的氧化应激可诱导核因子(NF)-κB信号通路激活,导致促炎症因子释放〔IL-8,IL-6和肿瘤坏死因子(TNF)-α〕,从而导致血脑屏障破坏和血管性水肿而加重脑卒中的临床症状〔7〕。
LncRNA NEAT1是心脑血管疾病病理过程中的关键因素。I/R损伤小鼠模型中观察到LncRNA NEAT1对心肌炎性反应有促进作用,并用抑制LncRNA NEAT1可敲低动脉粥样硬化相关事件〔8〕。针对I/R损伤小鼠模型中研究表明,LncRNA NEAT1促进氧葡萄糖剥夺/复氧(OGD/R)损伤和小胶质细胞的神经炎症损害,并能增强血管内膜的厚度或血管闭塞后通过调节血管平滑的表型转化使细胞过度凋亡,参与AIS的病理过程,表明LncRNA NEAT1可能是AIS诊断和治疗靶标〔2〕。本研究结果表明AIS患者体内血浆中LncRNA NEAT1表达明显增加,此指标的高表达参与了AIS的发生和发展。且LncRNA NEAT1对AIS的诊断有一定的准确性,其诊断效能中等。
LncRNA NEAT1高表达可增加AIS严重程度,LncRNA NEAT1高表达可能会增强脑微循环功能障碍,通过调节β-catenin信号通路,导致正常脑血管发生生理、病理性改变,从而增加疾病的严重程度;并且lncRNA NEAT1还可通过促进内膜增厚或血管闭塞调节血管平滑肌细胞的表型转化及上皮细胞过度凋亡,从而增强动脉粥样硬化病变并加重AIS的严重程度〔9〕;本研究结果发现:AIS患者血浆LncRNA NEAT1的表达与NIHSS评分呈显著正相关,表明LncRNA NEAT1的表达量可以用于AIS病情严重程度的预测或判断,其表达量越高,疾病的严重程度越重。
NEATl可作为脯氨酸/谷氨酰胺富集剪切因子负性调节因子使炎症因子如IL-8表达增加,从而在炎症反应中起重要的作用,在AIS的炎症反应中,报道最多的细胞因子是TNF-α、IL-10、IL-8、IL-20和转化生长因子(TGF)-β,其中IL-8和TNF-α可加剧脑损伤,而TGF-β和IL-10 却可能有神经保护作用,促炎症因子的增加与低水平抗炎症因子都会引起更大的坏死区和严重的临床后果〔10〕。本研究提示LncRNA NEAT1与AIS的炎症水平和病情进展有关。LncRNA NEAT1高表达可能会加速疾病的发展,它可通过调节并促进炎症反应而定位一些靶基因或途径在脑卒中的发生、发展中起作用。国内有研究报道〔11〕老年动脉硬化性脑卒中患者早期主要是发生促炎反应,随着梗死时间的延长,人体通过诱导大量外周血调节性T细胞而抑制促炎因子的表达,抑制过度的炎症反应,调节免疫平衡。
综上所述,血浆LncRNA NEAT1对AIS有一定的早期诊断价值,诊断效能较好,可作为一种新型生物标志物,有助于判断疾病的炎症水平及严重程度。
