子痫前期孕妇HIF-1a基因rs11549467G/A位点多态性和血清HIF-1a及VEGF水平表达与病情严重程度的相关性分析
2022-06-27凌秀婷施俊柱刘国栋钟伟传
冯 健,凌秀婷,施俊柱,刘国栋,钟伟传
(1.深圳市龙华区中心医院检验科,广东深圳 518110;2.深圳市龙华区人民医院检验科,广东深圳 518109)
子痫前期(Preeclampsia,PE)是妊娠期特有的一种疾病,主要表现为高血压和蛋白尿,其病因和发病机制目前尚未完全阐明,有研究认为,可能与胎盘微血管缺氧有关[1-2]。缺氧诱导因子-1a(hypoxia inducible factor-1a,HIF-1a)是存在于多种细胞内的一种转录因子,缺氧情况下可上调促红细胞生成素、血管内皮生长因子(vascular endothelial growth factor,VEGF)等多种靶基因的转录。有研究表明,HIF-1a基因多个位点存在多态性,且与多种疾病的发生、发展有密切关系[3],但与PE的发生是否有关未见报道。而VEGF是HIF-1a调节的一种下游因子,主要由滋养细胞分泌的一种促血管生成因子。有研究表明,VEGF在促进血管生成和维持血管内皮功能等方面发挥着重要的作用,但其在PE孕妇中的表达仍存在很大争议[4-6]。为此,本研究对深圳市龙华区PE孕妇和非PE健康孕妇HIF-1a基因rs11549467G/A位点多态性和HIF-1a及VEGF水平表达与病情严重程度的相关性进行了对比分析,探讨其在PE发病中的作用机制,现报道如下。
1 材料与方法
1.1 研究对象 选取2020年1月~2021年3月在深圳市龙华区中心医院和人民医院妇产科确诊的PE孕妇103例作为PE组,年龄22~45(31.65±9.72)岁;孕周21~36(28.01±6.34)周。其中轻度PE孕妇61例,重度PE孕妇42例。纳入标准:①符合美国妇产科医师学会(American College of Obstetricians and Gynecologists,ACOG)发布的《妊娠期高血压和子痫前期指南(2019版)》中PE诊断标准[7];②孕周≥20周;③产检规律及资料完整者;④单胎者;⑤自愿参与并积极配合者;⑥患者及家属知情同意者;⑦经医院伦理委员会同意批准。排除标准:①伴有实质器官性、免疫性及血液性等基础疾病者;②伴有慢性高血压、心脏病、肝病、肾病及糖尿病者;③多胎者;④甲状腺功能异常者;⑤有免疫治疗史者。同时选取非PE健康孕妇120例作为对照组,年龄20~47(30.92±10.25)岁;孕周20~38(28.76±7.05)周,体检均未见明显异常。两组年龄、孕周差异无统计学意义(P>0.05)。
1.2 仪器与试剂 HIF-1a和VEGF酶联免疫吸附试验试剂盒(上海科顺生物科技有限公司),DNA提取试剂盒(深圳亚能生物科技公司),ABI7500 PCR基因扩增仪(美国ABI公司),AE275酶联免疫吸附仪(深圳爱康公司)。
1.3 方法
1.3.1 HIF-1a和VEGF水平检测:采集静脉血3.0~5.0ml,分离血清,采用酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)对HIF-1a和VEGF水平进行检测,操作按仪器及试剂盒说明书进行。
1.3.2 DNA提取:抽取2.0~3.0ml静脉血于EDTA-K2抗凝管内,上下颠倒充分混匀后,采用DNA提取试剂盒提取全血组DNA,并将合格的DNA提取物置于-20℃冰箱内保存备用。
1.3.3 HIF-1a基因rs11549467 G/A位点多态性分析:利用限制性片段长度多态性-聚合酶链反应(restriction fragment length polymor-phism-polymerase chain reaction,RFLP-PCR)技 术 对HIF-1a基因第12外显子rs11549467 G/A位点单核苷酸多态性进行分析,具体操作参照文献[8]。①引物设计:上游引物:5’-AAGGTGTGGCCATTGTA AAAACTC-3’,下游引物:5’-TGACTCAAAGCGAC AGATAAC ACG-3’;②反应体系:总体积50μl,其中10×缓冲液5.0μl,dNTP 1.0μl,上、下游引物各0.5μl ,0.1μg/μl DNA模板1.0μl ,1U/μl Taq DNA聚合酶 0.5μl,加双蒸水至50.0μl ;③扩增:94℃预变性2 min,然后以94℃变性30s→56℃退火1.0min→72℃延伸1min,反复循环30次,最后72℃延伸10min;④酶切:取聚合酶链反应(polymerase chain reaction,PCR)扩增产物10.0μl,Aci I内切酶液2.0μl及去离子水7.5μl,60℃酶切1.0h;⑤电泳:取扩增产物于2g/dl琼脂糖凝胶上电泳分离,凝胶成像系统观察分析电泳结果。
1.4 统计学分析 数据采用统计软件SPSS20.0进行分析。计量结果以均值±标准差(±s)表示,采用t检验比较两组间差异;计数结果以率(%)表示,采用χ2检验比较两组间差异;遗传平衡采用Hardy-Weinberg检验;采用Pearson进行相关性分析。P<0.05为差异有统计学意义。
2 结果
2.1 两组HIF-1a和VEGF水平比较 PE组HIF-1a水平(23.92±5.06pg/ml)明显高于对照组(4.98±1.32pg/ml),而VEGF水平(86.37±20.64pg/ml)明显低于对照组(195.18±35.21pg/ml),差异均有统计学意义(t=13.054 2,P=0.013 7;t=9.147 5,P=0.028 1)。
2.2 不同程度PE孕妇HIF-1a和VEGF水平比较 重度PE孕妇HIF-1a水平(40.86±6.25pg/ml)明显高于轻度PE孕妇(12.06±2.93pg/ml),而VEGF水平(132.84±27.52pg/ml)明显低于轻度PE孕妇(285.72±41.37pg/ml),不同程度PE孕妇差异均有统计学意义(t=10.631 5,P=0.031 9;t=7.194 3,P=0.025 2)。
2.3 电泳图 见图1。PE组和对照组HIF-1a基因rs11549467G/A位点SNP均出现GG,GA和AA 三种基因型,经Hardy-Weinberg平衡检验,两组差异无统计学意义(χ2=1.049 2,P=0.069 5),表明抽样具有代表性。
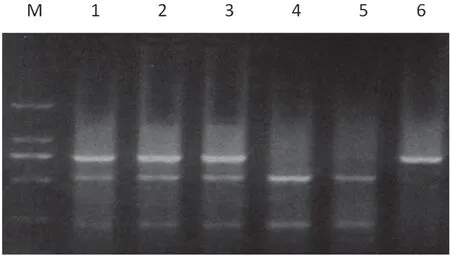
图1 HIF-1a基因rs11549467G/A位点电泳图
2.4 两组HIF-1a基因rs11549467G/A位点多态性比较 见表1。PE组HIF-1a基因rs11549467G/A位点AA基因型和A等位基因频率明显高于对照组,差异有统计学意义(χ2=7.374 5,4.826 7,均P<0.05)。
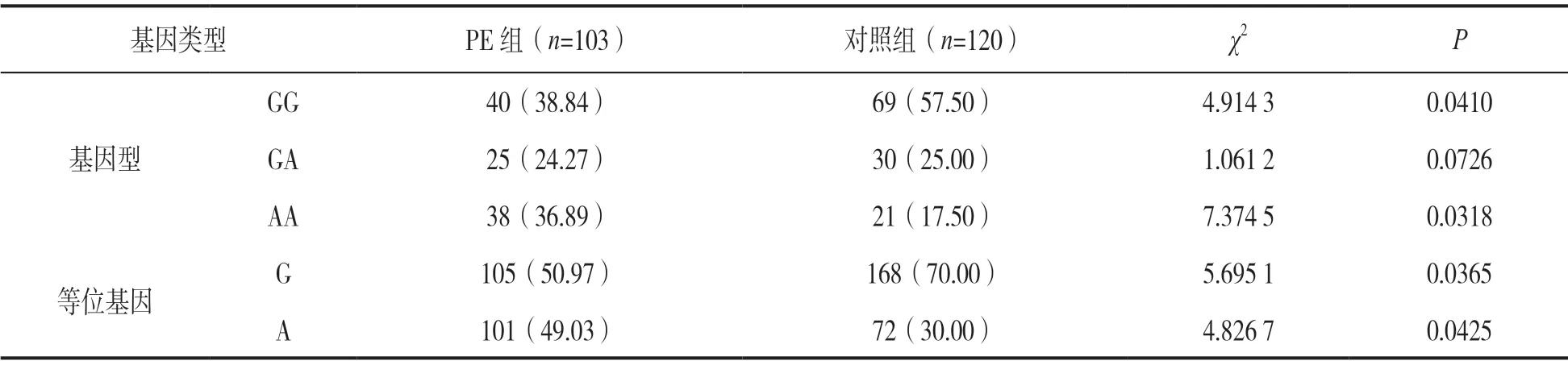
表1 两组HIF-1a基因rs11549467G/A位点多态性比较[n(%)]
2.5 不同程度PE孕妇HIF-1a基因rs11549467G/A位点多态性比较 见表2。重度PE孕妇HIF-1a基因rs11549467G/A位点AA基因型和A等位基因频率明显高于轻度PE孕妇,差异有统计学意义(χ2=4.208 6,4.619 7,均P<0.05)。
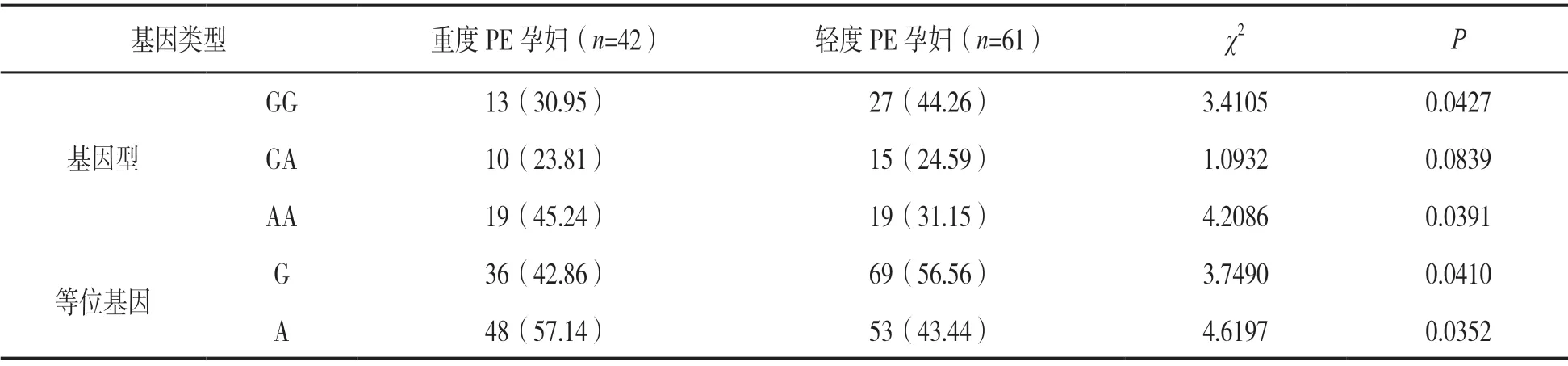
表2 不同程度PE孕妇HIF-1a基因rs11549467G/A位点多态性比较 [n(%)]
2.6 不同基因型PE孕妇HIF-1a水平比较 HIF-1a基因rs11549467G/A位点AA基因型PE孕妇HIF-1a水平(37.96±8.13pg/ml)明显高于GG和GA基因型(15.29±2.45 pg /ml和16.38±2.93 pg/ml),差异均有统计学意义(t=6.904 2,6.157 6,P=0.032 4,0.034 1),而GG和GA基因型差异无统计学意义(t=0.914 5,P=0.071 8)。
2.7 HIF-1a和VEGF水平与病情严重程度相关性分析 经Pearson相关性分析,PE组HIF-1a水平与病情严重程度呈正相关(r=0.617 4,P=0.035 9),而VEGF水平与病情严重程度呈负相关(r=-0.691 3,P=0.0311)。
3 讨论
子痫前期(PE)的基本病理变化为血管内皮细胞受损、全身细小动脉痉挛,全身各系统灌流减少,从而导致全身多器官功能损伤,严重威胁母婴健康,其发病率约为2.0%~8.0%,且约15%的早产是由PE引起,约有10.0%~15.0%的孕产妇死于PE,是导致早产、新生儿患病及孕产妇死亡的主要原因之一[9-10]。但PE病因和发病机制十分复杂,至今仍未阐明,同时PE的发生和进展毫无先兆,且不同患者的临床表现、进展及结局各异,给早期诊断、治疗及预防造成很大困难。因此,及早预测和识别高危者,并及时采取干预措施,对有效降低其发病率和死亡率有重要的临床意义是缺氧情况下缺氧信号转录过程中的一个关键性调节转录因子,在调节机体氧稳态中发挥着重要的作用。有研究表明,PE患者胎盘血管发生不同程度痉挛,导致其血流减少,造成胎盘局部组织缺血和缺氧,从而增加细胞内HIF-1a表达水平,以便提高组织对缺氧的耐受能力[11-13]。本研究结果显示,PE孕妇血清HIF-1a水平明显升高,以重度PE孕妇升高更为明显,且与PE病情严重程度呈正相关,这表明HIF-1a表达与PE的发生及病情严重程度有关。同时也说明了PE发生和发展过程中孕妇胎盘组织可能存在不同程度缺血、缺氧情况,这对PE的病因及发病机制的研究提供重要的参考依据。
VEGF是HIF-1a调节的一种下游因子,其基因转录受HIF-1a水平的调节,其在PE孕妇中的水平表达虽存在很大争议,但可通过不同途径诱导和促进PE甚至高血压的发生。有研究认为,PE患者胎盘缺血、缺氧可引起HIF-1a表达水平上调,导致VEGF水平增加,从而促进血管内皮细胞活化,增加血管通透性,导致高血压。但也有研究表明,VEGF主要由胎盘滋养细胞分泌,胎盘组织缺血、缺氧可引起炎性因子及其代谢产物释放增加,血管内皮细胞功能受损,导致其水平降低,影响滋养细胞分化、内皮细胞增殖和侵袭能力下降及发育受阻,从而进一步加重胎盘缺血缺氧性损伤,诱导和促进PE的发生和发展进程[14-16]。本研究结果显示,PE孕妇血清中VEGF水平明显降低,以重度PE孕妇降低更为明显,且与PE病情严重程度呈负相关,这可能与PE发病中炎性细胞因子及其产物释放增加导致VEGF浓度降低的作用大于HIF-1a对VEGF水平表达上调的作用有关,从而互相作用进一步促进PE发生和发展。
有研究表明,PE发病与滋养细胞侵袭异常、免疫异常、血管内皮损伤、营养及遗传等多种因素有关,是一种多因素、多基因性疾病,其中基因突变在其发生中发挥了重要的作用。HIF-1a是在特异性缺氧状态下发挥活性的一种转录因子,其基因位于14q21~24,由15个外显子和14个内含子组成,其基因多个位点存在多态性,且与多种疾病的发生有密切关系[17-19]。本研究结果显示,PE孕妇HIF-1a基因rs11549467 G/A位点AA基因型和A等位基因频率明显升高,且以重度PE孕妇升高更为明显,这表明PE的发生和发展与HIF-1a基因rs11549467 G/A位点多态性有一定的相关性,其中AA基因型可能是深圳地区PE发病的易感基因。另外,AA基因型PE孕妇HIF-1a水平明显高于其它基因型,这表明其基因多态性可能通过影响其蛋白水平表达而在PE中发挥作用的。
综上所述,PE孕妇HIF-1a水平明显升高,而VEGF水平明显降低,与病情严重程度有关。同时PE孕妇HIF-1a基因rs11549467G/A位点存在多态性,且不同基因型孕妇血清HIF-1a水平存在很大差异。因此,HIF-1a,VEGF水平表达及HIF-1a基因rs11549467G/A位点多态性可能与PE的发生和发展有一定相关性。
