有氧运动对阿尔兹海默症小鼠Notch信号通路甲基化的影响
2022-06-26张业廷付燕李雪袁琼嘉
张业廷 付燕 李雪 袁琼嘉
1中国民用航空飞行学院(四川省广汉市 618307)
2西南民族大学体育学院(成都市 610041)
3成都体育学院(成都市 610041)
许多学者致力于探讨运动干预对阿尔茨海默病(Alzheimer’s disease,AD)有益影响的机制,并已有几种机制被用来解释体育活动对AD的防治作用,包括:运动可减少β-淀粉样蛋白(amyloidβ-protein,Aβ)生成、促进Aβ清除、抑制Aβ斑块沉积和磷酸化Tau的堆积;运动可增加海马、大脑皮质等部位神经营养因子表达,促进血管生成,促进海马神经和突触的发生,加强神经网络的联系,提高突触可塑性等[1-4];运动可增强机体抗自由基能力,抑制其神经毒性等[5]。也有学者开展了运动对AD小鼠成年海马神经发生(adult hippocam-pal neurogenesis,AHN)的研究,AHN是神经干细胞(neural stem cells,NSCs)通过前体细胞和成神经细胞的扩增,以及这些新生神经元与现有神经回路的整合,产生新的功能性成熟齿状颗粒细胞(dentate gran-ule cells,DGCs)的过程。运动后齿状回神经发生的增加与空间记忆的增强有关,而通过局部伽马射线照射海马区域抑制神经发生消除了运动刺激对空间学习记忆的改善作用[6,7]。但是这些研究并没有完全阐明运动如何调控AHN及影响学习记忆的机制。
神经发生贯穿于人的一生,其主要存在的两个脑区分别是海马齿状回(dentate granulosa,DG)的亚颗粒区(subgranular zone,SGZ)和侧脑室的室下区(sub-ventricular zone,SVZ)[8]。神经发生是指成年NSCs通过成神经细胞和中间祖细胞的扩增,以及将新生神经元与固有的神经回路进行整合,产生新的功能性成熟DGCs的过程[9]。与此同时,成年的神经发生会受到外部环境影响和内在遗传因素的严格控制[10]。通过使用转基因小鼠进行研究发现,Notch通路成分在出生后早期和成年大脑的神经生发区内表达,这也支持了Notch信号调节成年后NSCs的可能性[11,12]。Notch信号的抑制是一种已知的诱导神经元分化的条件,它会导致Hes1的下调以及神经元素2(Neurogenin2,Ngn2)和Dll1的持续上调[13]。包括DNA甲基化在内的表观遗传修饰在干细胞功能中起着重要作用,已成为NSCs中外部环境影响和基因表达转录控制的重要环节[14]。DNA的甲基化是由DNA甲基转移酶(DNA methylation,DNMTs)催化的。DNMTs的表达水平通常会随着细胞的分化而降低;然而,DNMT1和DNMT3a即使在成年人的大脑中,包括海马区,仍然表达[15]。有研究结果表明,尽管Notch信号活跃,但其表观遗传沉默仍然导致了神经元分化[16]。与神经生成相关的基因Notch1、RG-MA和AKT1在基因体中获得5-羟甲基胞嘧啶,并在分化过程中上调。目前,还没有研究对胚胎期和成年期Notch信号元件的DNA甲基化水平进行检测。Notch1的低活性降低了组织特异性基螺旋环螺旋(bHLH)基因活性,导致Ngn2等前神经bHLH因子的上调;这些因子会抑制神经祖细胞(neuro progenitor cells,NPCs)的维持,促进神经分化。Notch1、Hes1和Ngn2对NCSs的发展至关重要,因此可能是表观遗传修饰的候选基因。
尽管AD症状背后的确切神经生物学机制仍不清楚,但大脑中与学习和记忆有关的区域,如海马和前额叶皮质,出现了严重的神经元丢失,这在AD大脑中很明显。AHN对学习和记忆功能的影响表明它参与了AD的病程发展,因为不良的记忆功能可以在AD确诊前15年出现[17]。转基因AD小鼠模型显示,海马依赖的学习和记忆任务(如空间学习、物体识别和情境恐惧条件反射)存在缺陷[18]。然而,对AD小鼠海马神经发生的表观遗传学调控机制及Notch1、Hes1和Ngn2的潜在关系尚未完全了解。通过研究三个Notch通路基因启动子的DNA甲基化,我们将探讨运动调控海马神经基因的表观遗传学机制。本研究的问题是运动是否会影响Notch通路基因启动子的DNA甲基化,从而可能在AD引起的神经发生过程中参与调控Notch信号靶基因活性。因此,我们利用甲基化特异性PCR(Methylationspecific PCR,MSP),研究Notch1、Hes1和Ngn2在AD小鼠中的DNA甲基化水平。
1 材料与方法
1.1 实验动物及分组
健康3月龄APP/PS1双转基因AD小鼠,体重25~30 g,购于“南京大学-南京生物医药研究院”,许可证号:苏ICP备10073918号-3。动物的饲养条件:环境清洁安静,室温20℃~28℃,相对湿度为40%~60%,模拟自然光照条件,每日光照12小时,自由摄取动物饲料和饮用纯净水,每周换经过紫外线严格消毒的垫料、食物及饮用水。将小鼠适应性喂养1周后随机分为两组:AD对照组(ADC)、AD运动组(ADE),每组20只。对照组不进行运动,运动组进行为期5个月的有氧运动干预。运动干预后,将所有AD小鼠取材进行相关指标的检测。
1.2 有氧运动方案
在运动训练开始前,所有的运动组小鼠适应跑步机环境10 min,连续两天(第一天5 m/min,第二天8 m/min)。适应结束后,各运动组进行跑台运动,每周5天,每天30 min,持续5个月。在每次训练过程中,以10 m/min的速度开始跑5 min,然后以15 m/min跑20 min,最后以10 m/min的速度跑5 min结束。在这种强度下,当小鼠停止不运动时,不对小鼠进行电刺激,只轻柔地触摸尾巴让小鼠继续运动[19]。
1.3 脑组织取材和相关指标检测
脑组织取材于运动干预结束后24 h~48 h内进行。经心脏快速灌注生理盐水及慢速灌注预冷至4℃的4%多聚甲醛后,用眼科剪、镊子迅速剥开颅骨取出脑组织。每组随机取6只脑组织放入4%多聚甲醛溶液中固定24 h,然后将脑组织依次放入10%、20%、30%的蔗糖溶液中进行梯度脱水5~7 d。在冰冻切片机中根据脑立体定位图冠状面切取海马部位制作厚度为5 μm的切片10张,置于-20℃冰箱中保存备用,用于制作冰冻切片以备免疫荧光观察分析。6只用于提取蛋白(蛋白储存于4℃冰箱)进行免疫蛋白印迹检测。6只用于提取DNA(DNA储存于-20℃冰箱)进行甲基化特异性PCR检测及提取mRNA(mRNA储存于-20℃冰箱)用于检测海马神经发生相关基因的mRNA表达。
1.4 免疫荧光染色观察海马蛋白表达
通过免疫荧光实验检测相关蛋白表达量。取出事先切好保存于-20℃冰箱的冰冻脑组织切片,在4°C环境下于4%多聚甲醛中固定10 min。用PBS清洗两次后,在组织切片上滴加3%的过氧化氢溶液封闭,避光室温孵育25 min,于4°C环境下孵育一抗(表1)过夜。第二天,PBS清洗后,用荧光抗体(1︰100,R&D Sys-tems USA)37°C环境下避光孵育1 h。采用DAPI染色剂进行核染色。利用OLYMPUS显微镜获得荧光图像,每张切片采取20×、40×放大倍数图片,高倍视野均在低倍视野区域内选取,其中在400倍光镜下选取5个互不重叠相同面积的视野进行采集,使用Image-Pro+6.0软件分析荧光强度(AU/μm2)。
1.5 Real-time PCR检测海马神经发生相关基因的mRNA表达
在通风橱内提取海马组织mRNA,加RNAzol入EP管中处理匀浆后的海马组织,再加入DEPC处理水,振荡离心,取出上清液,加入75%浓度乙醇,在室温环境下静置离心,吸净上清液,留下EP管底部白色沉淀物;加入75%浓度的乙醇,离心后吸尽上清液,然后加入DEPC处理水溶解mRNA。将提取的mRNA于当天反转录为cDNA。在PCR管中配置qPCR反应体系,加入12.5μl的Maxima SYBR Green qPCR Master Mix试剂,加入上下游引物(≤5μM)(表2),DNA模板(≈1000 ng),用不含核酸酶的ddH2O配至配至25μl。完全混合预混液,分配至八联管中。将八联管放入CFX96实时荧光定量仪中,按三步法循环方案进行反应。反应结束后,分析PCR产物的融解曲线,确定反应特异性。数据处理采用2-△△CT(Livak)方法。
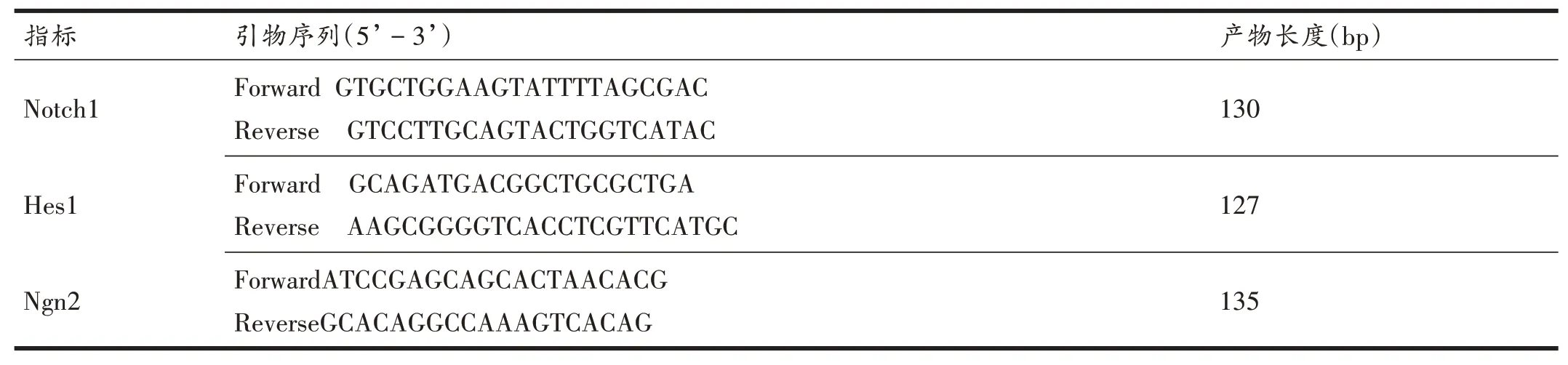
表2 PCR引物序列及扩增产物长度
1.6 Western Blot检测小鼠大脑海马组织相关蛋白表达量
根据小鼠脑组织立体定位图谱,可以用镊子轻松将海马组织剥离大脑,取出海马组织,称重后放入EP管中,加入RIPA裂解液,室温环境下静置30 min,然后将其放入离心机中离心,吸取EP管中上清液,加入5×上样缓冲液,于95℃金属浴中加热5 min~10 min以使蛋白质充分的变性。用湿转方法将蛋白质转至PVDF膜上(15~20 mA电流转膜30 min)。去脂牛奶封闭目的蛋白条带1 h,之后用一抗(表1)分别将带有相应目的蛋白的PVDF膜在4°C环境中孵育过夜。第二天,TBST液洗涤PVDF膜,然后用二抗室温孵育1 h;洗涤后进行化学发光、显影、定影,获得蛋白印迹图像。扫描胶片,利用Gel pro plus软件对内参蛋白和目的蛋白进行光密度(OD)值的分析(蛋白表达量=目的蛋白OD值/内参蛋白OD值)。
1.7 甲基化检测相关基因
将海马组织用注射器反复吹打为细胞悬液,离心后倒除上清液,加缓冲液GA,振荡放置后加入蛋白酶K,震荡混匀再加入缓冲液GB,混匀,70℃放置后加入200μl无水乙醇,将溶液和絮状沉淀都加入一个吸附柱CB3中,离心后倒掉废液,向CB3中加入缓冲液GD,离心后倒掉废液,再向CB3中加入漂洗液PW离心,室温放置以彻底晾干吸附材料中残余的漂洗液,将CB3转入一个干净的离心管中,向吸附膜中间部位滴加TE洗脱缓冲液,离心后将溶液收集到离心管中。将提取的基因组DNA用重亚硫酸盐处理。取0.2 ml PCR管,配制PCR反应体系(表3),PCR引物序列及扩增产物长度见表4(M:甲基化序列引物;U:非甲基化序列引物),PCR扩增条件见表5。反应终产物在2%的琼脂糖凝胶中电泳30 min(5V/cm电压,1×TAE Buffer),最后用凝胶成像系统拍照分析。甲基化百分比=甲基化条带光密度值/(甲基化条带光密度值+非甲基化条带光密度值)×100%。
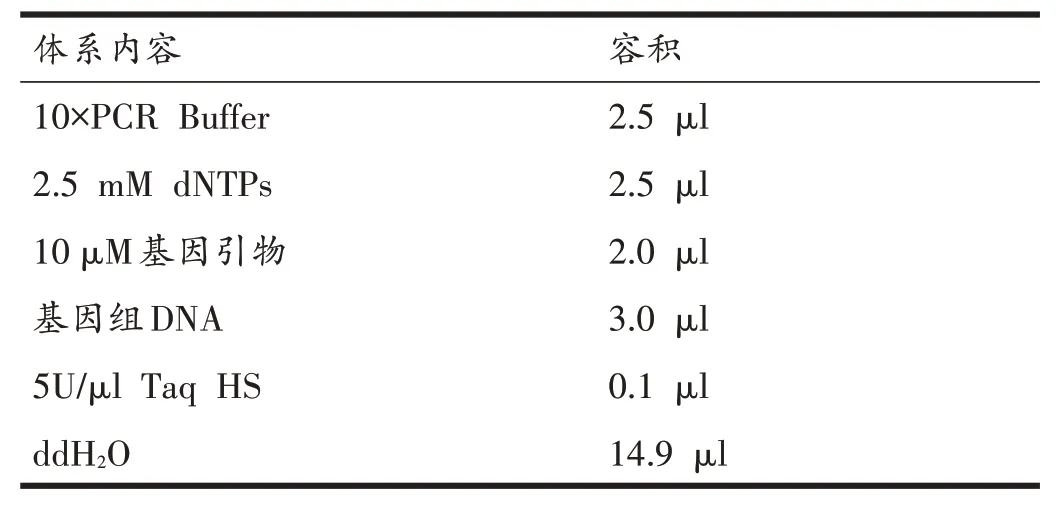
表3 PCR反应体系

表4 PCR引物序列及扩增产物长度

表5 PCR扩增条件
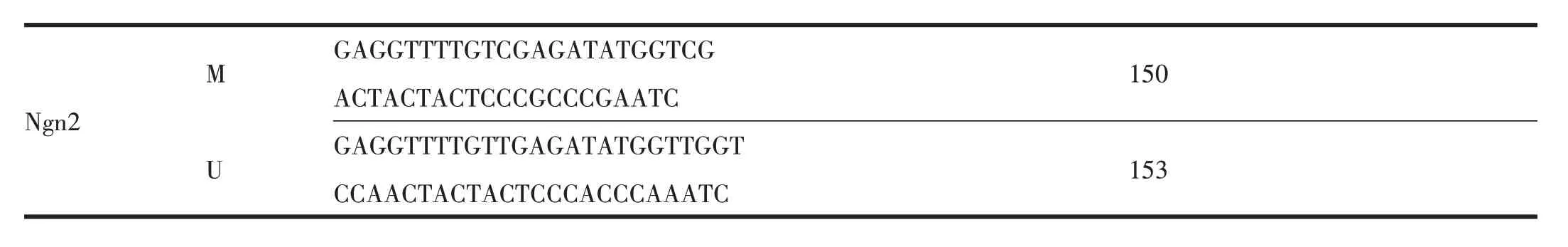
150 Ngn2 M U GAGGTTTTGTCGAGATATGGTCG ACTACTACTCCCGCCCGAATC GAGGTTTTGTTGAGATATGGTTGGT CCAACTACTACTCCCACCCAAATC 153
1.8 统计学分析
所有定量数据用±s表示,并运用SPSS统计分析软件进行分析处理。采用独立样本t检验分析,方差齐性时组间两两比较采用Bonferroni检验,方差不齐性时组间比较采用Tamhane ST2检验。统计显著性水平设定为P<0.05。使用GraphPad Prism 8及Photoshop软件进行图片制作。
2 结果
2.1 小鼠海马Notch1检测结果
由图1可知,ADE组海马Notch1 mRNA表达显著低于ADC组(t=4.496,P<0.01),ADE组海马Notch1蛋白表达显著低于ADC组(t=8.602,P<0.01)。

图1 各组小鼠海马Notch1基因及蛋白表达比较
小鼠海马Notch1表达荧光图见图2,图中蓝色代表DAPI标记的细胞核,红色代表Notch1免疫阳性产物表达。如图3所示,ADE组小鼠海马DG区Notch1阳性细胞数量显著低于ADC组(t=4.193,P<0.01);ADE组小鼠海马DG区Notch1免疫阳性产物荧光强度与ADC组相比没有显著差异(t=1.668,P=0.126)。

图2 各组小鼠海马DG区Notch1表达荧光图
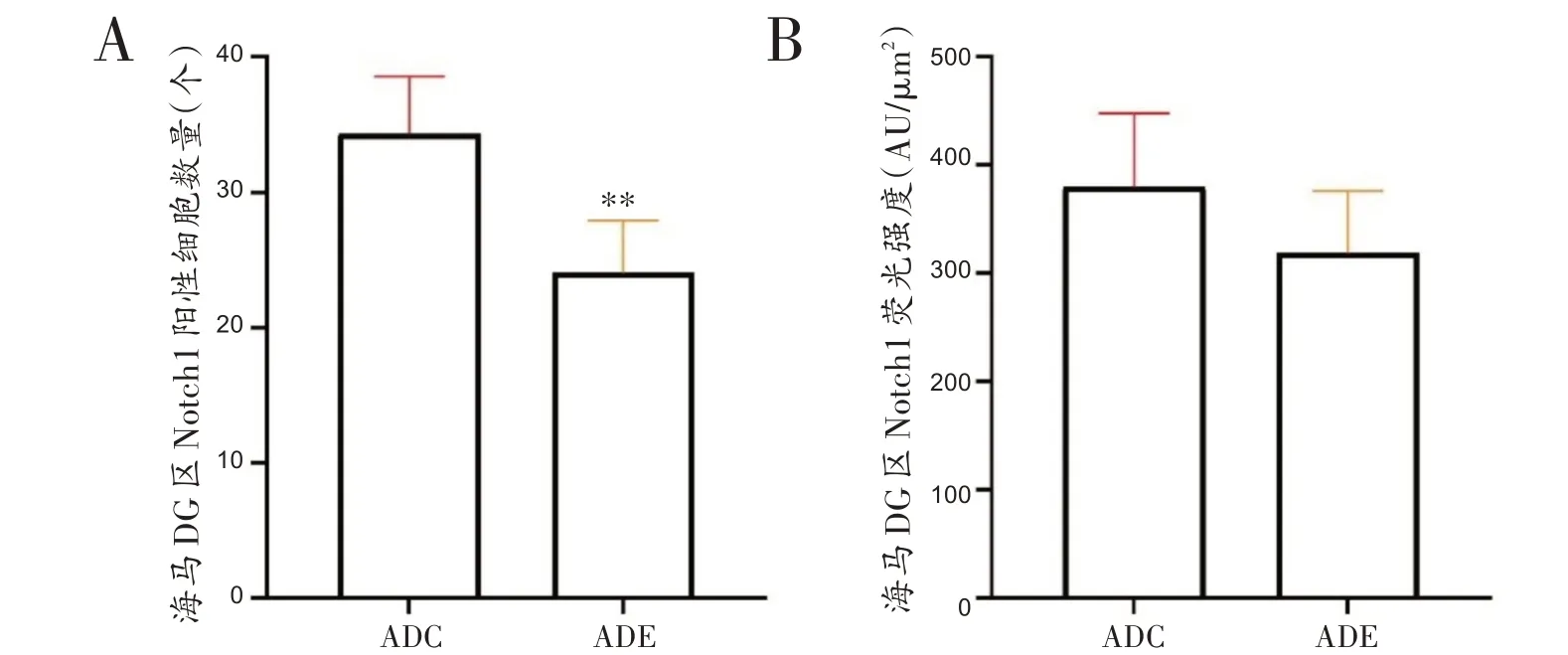
图3 各组小鼠海马Notch1荧光表达比较
2.2 小鼠海马Hes1检测结果
如图4所示,ADE组海马Hes1 mRNA表达显著低于ADC组(t=4.388,P<0.01)。ADE组海马Hes1蛋白表达显著低于ADC组(t=7.906,P<0.01)。
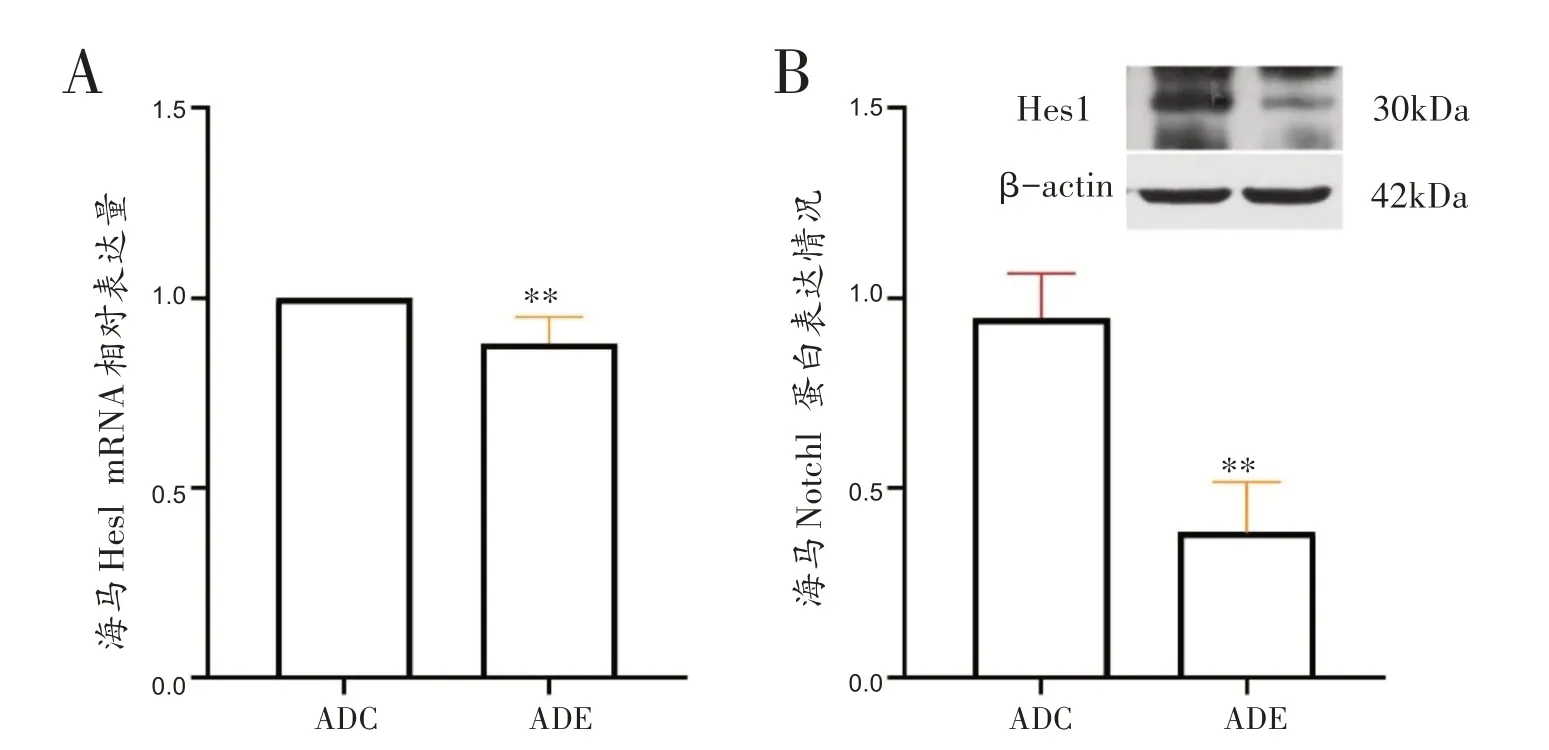
图4 各组小鼠海马Hes1基因及蛋白表达比较
小鼠海马Hes1表达荧光图见图5,图中蓝色代表DAPI标记的细胞核,红色代表Hes1免疫阳性产物表达。如图6所示,ADE组小鼠海马DG区Hes1阳性细胞数量显著低于ADC组(t=5.524,P<0.01);ADE组小鼠海马DG区Hes1免疫阳性产物荧光强度显著低于ADC组(t=2.308,P<0.05)。

图5 各组小鼠海马Hes1表达荧光图

图6 各组小鼠海马Hes1荧光表达比较
2.3 小鼠海马Ngn2检测结果
如图7所示,ADE组海马Ngn2 mRNA表达显著高于ADC组(t=-2.995,P<0.05)。ADE组海马Ngn2蛋白显著高于ADC组(t=-5.934,P<0.01)。
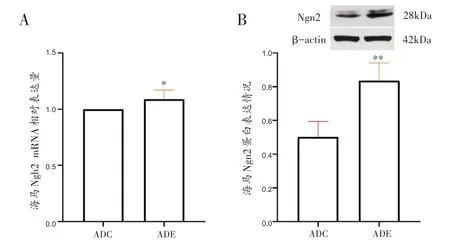
图7 各组小鼠海马Ngn2基因及蛋白表达比较
各组小鼠海马Ngn2表达荧光图见图8,图中蓝色代表DAPI标记的细胞核,红色代表Ngn2免疫阳性产物表达。如图9所示,ADE组小鼠海马DG区Ngn2阳性细胞数量显著高于ADC组(t=-5.176,P<0.01);ADE组小鼠海马DG区Ngn2免疫阳性产物荧光强度显著高于ADC组(t=-2.373,P<0.05)。

图8 各组小鼠海马Ngn2表达荧光图

图9 各组小鼠海马Ngn2荧光表达
2.4 小鼠海马Notch1、Hes1和Ngn2的甲基化检测
ADE组小鼠海马Notch1及Hes1的甲基化率显著高于ADC组(t=-5.679,P<0.01;t=-21.720,P<0.01;图10 A、B、C);ADE组小鼠海马Ngn2的甲基化率显著少于ADC组(t=4.989,P<0.01;图10 A、D)。

图10 各组小鼠海马Notch1、Hes1和Ngn2甲基化检测
3 讨论
Notch信号在海马齿状回颗粒下层的神经发生控制中也起着重要作用[20,21]。基因沉默实验表明,Notch和Notch信号通路组分在调控成年DG神经发生过程中起重要作用。Notch1条件性缺失或激活Notch1过表达对成年DG的神经发生有显著影响[22]。通过激活Notch1表达会使其胞内活性形式NICD增加,NICD复合物形成则激活Notch信号通路增加NSCs,促进干细胞的增殖,并可能导致神经胶质细胞的生成[23]。而NICD复合物会提高Hes1、Hes5等转录抑制基因的表达,进而抑制神经分化发育相关基因(Mammalian achaete-scute homologue-1,Mash1)、Ngn2等促神经元发生相关基因以及Dll1的转录,从而维持NSCs的增殖活力与多能性[24]。抑制Notch信号能够导致Hes1的下调和Ngn2的持续上调,这将不足以刺激神经元分化[13]。例如非二噁英样联苯多氯化物、Notch信号通路抑制剂DAPT等则可以通过抑制Notch1的表达来减少NSCs的增殖并导致其向神经元方向分化[25]。
在AHN中,NSCs是选择继续增殖还是向神经元分化,Notch信号通路则起到了关键的作用。通过调节Notch信号通路可以阻止受损脑区胶质细胞迅速填充以及成年动物脑内NPCs向胶质细胞分化,从而为神经网络的恢复提供有利条件。在体外通过对Notch信号通路的调控可以精确影响NSCs向神经功能细胞分化的过程和比例[26]。而在体内,通过抑制Notch1形成NICD复合物可以降低Notch信号通路转导,进而减少细胞的增殖,并间接促进NSCs向神经元方向分化[27]。Pierre等发现通过提高BCL6表达,增加其与SIRT1的相互作用可以抑制Notch信号通路,从而导致大量的NSCs向神经元细胞分化[16]。
AD患者脑部多存在Notch信号通路异常,但这些信号通路在成熟神经系统中的功能和阿尔兹海默病发病中的作用尚未完全明确[28]。淀粉样前体蛋白(Amy-loid precursor protein,APP)被γ分泌酶(γ-secretase)裂解,产生Aβ,被认为与AD患者的神经变性有关[29]。早老素(PS)是γ分泌酶蛋白水解复合物的催化分子,它的突变是早发型家族性AD的主要原因。除了APP外,γ分泌酶底物还包括Notch1同源物、Notch配体Delta和Jagged以及其他I型膜蛋白,这引起了人们对于抑制γ分泌酶而产生的毒性机制的关注[30]。γ分泌酶对Notch蛋白水解的改变可能参与AD的发病机制[29]。因此,研究AD中Notch信号通路对阐明AD的多种发病机制以及治疗和预防AD具有重要意义。而目前缺乏相应的研究。本研究发现,运动能够降低AD小鼠海马Notch1、Hes1的表达,而增加Ngn2的表达,但是运动通过怎样的机制引起这一变化并不清楚。
表观遗传修饰,包括DNA甲基化,已被证明参与干细胞的中心功能,并作为NSCs细胞外环境影响与基因表达的转录调控之间的重要环节[31]。研究发现,DNA的甲基化是由DNA甲基转移酶(DNMTs)催化的。DNMTs的表达水平通常随着细胞的分化而降低;然而,DNMT1和DNMT3a即使在有丝分裂为主的成年大脑中仍然表达,包括海马区[32]。神经发生相关基因Notch1在基因体中获得5-羟甲基胞嘧啶,并在分化过程中上调[33]。Notch1的低活性降低了组织特异性碱性螺旋-环-螺旋(helix–loop–helix,bHLH)基因活性,导致Ngn2等前神经bHLH因子的上调;这些因子抑制神经祖细胞的维持,促进神经元分化。Notch1、Hes1和Ngn2对于NCSs的发展至关重要,可能是表观遗传修饰的候选基因。有研究表明,DNA甲基化可能参与调控成年神经发生中的Notch信号活性,Notch1、Hes1和Ngn2启动子的DNA甲基化与海马神经发生中的基因抑制有关[34]。出生后改变DNA甲基化,被认为有助于一些复杂疾病的晚发[35]。不同的环境,尤其是应激反应似乎能够改变整个基因组的DNA甲基化过程[36]。然而,Notch1、Hes1和Ngn2在运动对AD小鼠海马神经发生中的表观遗传学调控机制和潜在关系尚不完全清楚。目前,还没有关于运动对AD小鼠海马Notch信号元件的DNA甲基化水平所进行的检测。本研究发现,长期有氧运动后AD小鼠海马Notch1及Hes1的甲基化率显著增加,而其Ngn2的甲基化率则显著减少。因此,长期有氧运动可能通过提高Notch1及Hes1的甲基化率,降低Ngn2的甲基化率,从而降低Notch1及Hes1的表达、提高Ngn2的表达。而这可能是长期有氧运动显著促进AD小鼠海马AHN的增殖及分化过程的重要原因之一。但是,运动对Notch信号元件DNA甲基化水平的改变是如何影响AD小鼠海马AHN过程的,还需要进一步的研究。
4 结论
长期有氧运动可能通过提高AD小鼠海马Notch1及Hes1的甲基化率,降低海马Ngn2的甲基化率,从而降低海马Notch1及Hes1的表达,以及提高海马Ngn2的表达。
