肝细胞癌的抗血管生成免疫联合介入治疗:肝动脉灌注化疗与化疗栓塞疗效的比较
2022-06-25张希昊章馨允曹曼卿张金梁王华琪
张希昊, 章馨允, 曹曼卿, 张金梁, 王华琪, 张 苏, 付 周, 王 鲁, 张 倜
(1.天津医科大学肿瘤医院a.肝胆科,b.乳腺外科,c.妇科肿瘤科,国家肿瘤临床医学研究中心,天津市肿瘤防治重点实验室,天津 300060;2.天津市第三中心医院肿瘤科,天津 300170;3.复旦大学附属肿瘤医院肝脏外科,上海 200032)
肝细胞癌(hepatocellular carcinoma,HCC)发病率居全球恶性肿瘤第6位,死亡率居第4位。近5年中国原发性HCC发病数为42.3万,占全球47%[1]。HCC发病隐匿,早期筛查困难,70%~80%的病人诊断时已是晚期[2]。由于缺乏有效的治疗手段,因此中位生存期仅为4.2~7.9个月[3-4]。对于无手术机会或治疗后复发转移的病人,有效的系统性全身治疗尤为必要。
随着肿瘤以程序性死亡受体1(programmed cell death protein 1,PD-1) 和 PD-配体 1(PD-ligand 1,PD-L1)为靶点的免疫检查点抑制剂(immune checkpoint inhibitor,ICI)兴起[5],国内外 HCC 的一线治疗方案已逐渐由索拉非尼、仑伐替尼这类酪氨酸激酶抑制剂单药转向阿替利珠单抗联合贝伐珠单抗等抗血管生成联合免疫治疗的方案[6-7]。尽管这类联合治疗较索拉非尼显著延长总生存期及无进展生存期,但客观反应率 (objective response rate,ORR)仅为25.1%,疾病控制率(disease control rate,DCR)为65.7%,疗效仍不尽如人意[7]。
临床通常以介入治疗联合系统性全身治疗来改善中、晚期HCC的治疗效果,进一步达到转化治疗的目的。其中肝动脉化疗栓塞术(transcatheter arterial chemoembolization,TACE)是真实世界中全身治疗的主流联合手段[8-9]。近年来,国内学者改进肝动脉灌注化疗(hepatic artery infusion chemotherapy,HAIC),以奥沙利铂为基础的FOLFOX方案HAIC明显提高了中、晚期HCC治疗的ORR,具有较高的手术转化率和安全性[10]。Ⅲ期临床数据证实,对于非晚期大肝癌,单用FOLFOX方案的HAIC疗效全面优于TACE[11]。笔者前期的研究证实HAIC联合抗血管生成药物及ICI治疗HCC疗效显著,手术转化率高[12]。然而,由于HAIC在国内开展时间尚短,目前具体选择哪种介入方式联合抗血管生成和免疫治疗能给病人带来更多获益尚存在较大争议。因此,本研究拟回顾性分析2019年1月至2020年12月在天津医科大学肿瘤医院行介入治疗联合抗血管生成治疗和免疫治疗的中、晚期HCC病例,比较HAIC与TACE介入治疗联合抗血管生成及免疫治疗的疗效差异,为临床提供更多真实世界的证据。
资料与方法
一、一般临床资料
纳入自2019年1月至2020年12月在天津医科大学肿瘤医院初诊的巴塞罗那肝癌(Barcelona clinic liver cancer,BCLC)分期为B期或C期并采用介入治疗联合抗血管生成和免疫治疗的病例93例,男74例,女19例。中位年龄为57(27~78)岁,病人均被告知不同治疗在疗效、安全性及费用上的优缺点,最终由病人决定治疗方案。
二、纳入与排除标准
纳入标准包括:①年龄≥18岁;②临床影像学或病理学诊断为HCC;③至少有一个RECISIT 1.1可测量病灶;④BCLC分期为B期或C期;⑤美国东部肿瘤协作组 (Eastern Cooperative Oncology Group,ECOG)评分 0~1分;⑥肝功能 Child-Pugh分级为A级或B级(<7分)。
排除标准为:①不能完整接受2周期抗血管生成治疗或至少1次免疫治疗;②有实体器官移植病史;③存在自身免疫系统疾病,需行免疫抑制治疗;④心、脑、肺等严重功能障碍;⑤无法控制的消化道出血或凝血功能障碍等;⑥既往接受过奥沙利铂或氟尿嘧啶系统性化疗;⑦失访。
三、分组
(一)HAIC联合组
将微导管置于肝固有动脉或肿瘤供应血管,持续泵入药品,采用FOLFOX化疗方案。包括奥沙利铂(85 mg/m2,2 h);亚叶酸钙(400 mg/m2,2 h);氟尿嘧啶(400 mg/m2推注,10 min;1 200 mg/m2,23 h)。间隔3~8周HAIC 1次,允许根据肝功能及肿瘤状态适时调整用药剂量并延长间隔时间。只要满足联合方案要求,不考虑抗血管生成药物和ICI的品牌。抗血管生成药应用包括口服仑伐替尼8 mg/d,或索拉非尼200 mg,每天2次,或阿帕替尼250 mg/d,或瑞戈非尼40 mg/d,或静脉滴注贝伐珠单抗15 mg/kg,每3周1次。免疫治疗每3周1次,静脉滴注卡瑞利珠单抗200 mg,或信迪利单抗200 mg,或特瑞普利单抗 240 mg,或替雷利珠单抗 200 mg。每 1~2次HAIC治疗后的4~8周内进行1次影像学检查。经2名以上外科医师证实,局部肿瘤情况治疗后满足手术标准(病灶可根治切除,剩余肝脏体积充足)的病人,手术干预,随后继续行抗血管生成治疗及免疫治疗。
(二)TACE联合组
将微导管置于肝动脉或肿瘤供应血管,注入表柔比星或顺铂或洛铂,与明胶海绵及微球栓塞肿瘤动脉,间隔3~8周TACE 1次。根据病人肝功能及肿瘤状态适时调整用药剂量并延长间隔时间。只要满足联合方案要求,不考虑抗血管生成药物和ICI的品牌。抗血管生成药和免疫治疗同HAIC联合组。每1~2次TACE治疗后的影像学检查及后续处理同HAIC联合组。
四、随访和评估
介入治疗停止的标准包括影像学检查结果进展,无法耐受的不良反应,BCLC降期后的手术切除,死亡或病人拒绝继续治疗。疗效及安全性评估采用增强MRI或CT、血常规、肝肾功能、电解质、甲胎蛋白及乙肝病毒检查评估。主要终点为ORR、DCR。因随访时间尚短,故次要终点为中位生存期(overall survival,OS)、中位无进展生存期(progression free survival,PFS)以及不良反应。肿瘤疗效评价依据实体肿瘤评价标准(RECIST 1.1)进行,分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)、疾病进展(progressive disease,PD)。毒副作用评价依据美国国立癌症研究院通用毒性反应5.0标准(NCI-CTC 5.0)进行。随访截止时间为2021年8月。TACE联合组的中位随访时间为11.95个月,HAIC联合组的中位随访时间为12.13个月。
五、统计学分析
采用SPSSv 26软件分析。计数资料采用χ2检验,Kaplan-Meier方法绘制PFS、OS生存曲线,Logrank检验分析组间差异。计算95%CI,双侧检验。P<0.05认为差异有统计学意义。
结 果
一、一般资料
回顾分析2019年1月至2020年12月本中心132例中、晚期HCC接受介入治疗联合抗血管生成及免疫治疗的病人,其中因失访、影像资料不全、严重不良反应、HAIC与TACE交替使用等原因排除39例,93例入组。TACE联合抗血管生成及免疫治疗组50例,HAIC联合抗血管生成及免疫治疗组43例。其中男74例,女19例.中位年龄为57(27~78)岁。HCC的主要病因是乙型肝炎病毒感染,两组病人基线水平差异无统计学意义。BCLC分期,HAIC联合组C期占88.37%,TACE联合组C期占74.00%。HAIC联合组晚期病人比例高,但差异无统计学意义(P=0.080)(见表1)。
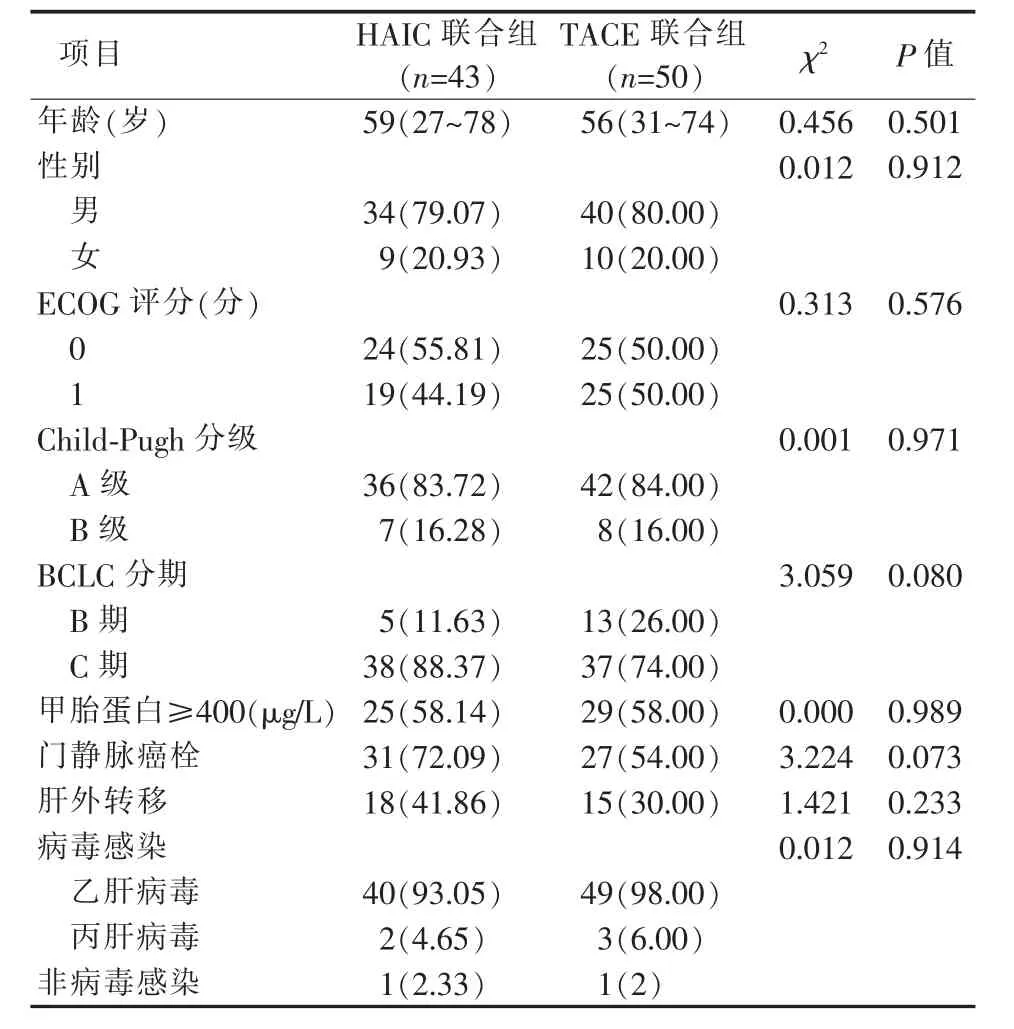
表1 一般资料[n(%)]
二、近期临床疗效
根据RECIST 1.1评价标准,HAIC联合组PR 31例 (72.09%);SD 7例 (16.28%); PD 5例(11.63%)。转化后手术 13例 (30.23%)。ORR 72.09%;DCR 88.37%。TACE联合组 PR 22例(44.00%);SD 8 例(16.00%);PD 20 例(40.00%)。经转化后手术7例 (14.00%)。ORR 44.00%;DCR 60.00%。两组均无CR病例。
HAIC联合组ORR显著高于TACE联合组(72.09%比 44.00%,χ2=7.444,P=0.006);HAIC 联合组DCR也高于TACE联合组 (88.37%比60.00%,χ2=9.468,P=0.002)。另外HAIC联合组手术转化率更高,但未达到统计学差异(30.23%比14.00%,χ2=3.609,P=0.057)(见表2)
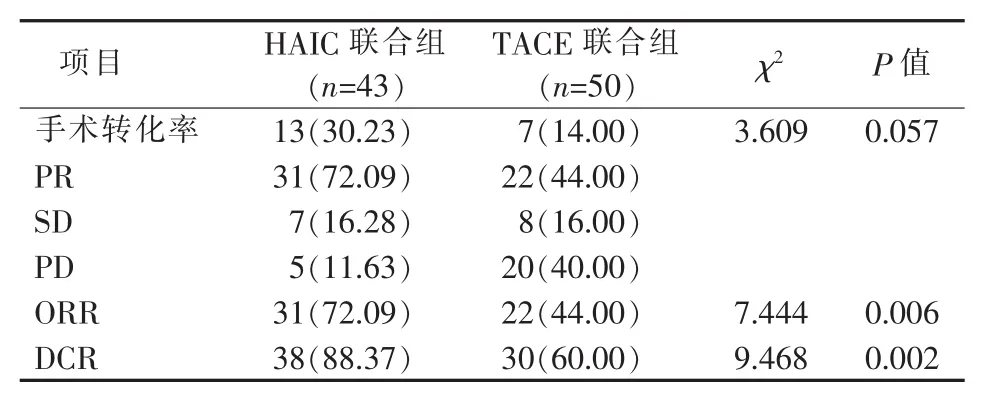
表2 近期疗效评价[n(%)]
三、远期临床疗效
HAIC联合组的中位随访时间为12.13个月,TACE联合组的中位随访时间为11.95个月。行Kaplan-Meier分析及Log-rank检验。HAIC联合组因疗效更佳,中位PFS未达到。TACE联合组的中位PFS 为 11.83 个月(95%CI:4.36~19.31 个月)。 两组差异有统计学意义(χ2=5.663,P=0.017)。同样HAIC联合组中位OS未达到。TACE联合组的中位OS为17.93 个月(95%CI:11.80~24.06 个月)。两组差异有统计学意义(χ2=7.171,P=0.007)。HAIC 与 TACE 相比,在联合抗血管生成与免疫治疗时,显著延长PFS及 OS(见图 1)。

图1 两组PFS及OS对比
四、不良反应
两组总体不良反应发生率差异无统计学意义(P>0.05)。3/4级不良反应,包括消化道出血(HAIC联合组1例比 TACE联合组2例)、胆红素升高(HAIC联合组1例比TACE联合组5例)以及贫血(HAIC联合组1例比TACE联合组1例)。HAIC联合组的3级胆红素升高比例低于TACE联合组,但未达到统计学意义(P=0.14)(见表3)。

表3 常见的治疗相关不良反应[n(%)]
讨 论
TACE是我国中、晚期HCC治疗的主要方法之一。近年来抗血管生成联合免疫治疗成为治疗中、晚期HCC的主流方法。以FOLFOX为方案的HAIC发展迅速,其疗效也逐渐得到肯定[10]。本研究根据RECIST 1.1标准,HAIC联合组与TACE联合组相比,ORR(72.09%比 44.00%)和 DCR(88.37%比60.00%)较高。另外,HAIC联合组手术转化率(30.23%比14.00%)较高,从而达到根治的效果。HAIC、TACE两组的中位随访时间分别为12.13个月、11.95个月。HAIC联合组因疗效较佳,中位PFS、OS未达到,TACE联合组中位PFS和OS为11.83个月和17.93个月。两组PFS和OS差异均有统计学意义。本回顾性研究纳入病例应用的抗血管生成及免疫治疗药物种类多且搭配不一,但作用机制基本一致,更符合真实世界的情况,故未考虑不同抗血管生成药物及ICI对疗效的影响。其中ICI主要为信迪利单抗、卡瑞利珠单抗、特瑞普利单抗和替雷利珠单抗;抗血管生成药物主要为仑伐替尼、索拉非尼、阿帕替尼、瑞戈非尼和贝伐珠单抗。之前的研究表明各类抗血管生成及免疫治疗的不同组合疗效差异未见统计学意义[12]。
目前作为美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南推荐不可切除晚期HCC一线首选的“T+A(阿替利珠单抗联合贝伐珠单抗)组合”的ORR为25.1%,DCR为65.7%[7]。其他两联疗效,如“可乐组合(帕博利珠单抗联合仑伐替尼)”的一线治疗ORR为36%,DCR为88%,中位PFS为8.6个月[13]。“双艾组合(卡瑞利珠单抗联合阿帕替尼)”一线治疗ORR为34.3%,DCR为 80%[14]。本研究 HAIC联合组和TACE联合组的ORR分别为72.09%和44.00%,都有较大程度提高,具有转化意义。此外,本研究纳入病例BCLC分期C期占比更高,DCR也与各项临床研究的结果接近,符合真实世界情况。
本研究发现,相比传统TACE,HAIC在联合其他治疗中发挥更大优势,包括如下。①HAIC联合组ORR更高,更重要的是病人在采用HAIC联合治疗后有更多机会转化并手术切除。这与石明等的研究结果一致[11,15]。②对后续手术影响小。因其未使用栓塞剂,正常肝组织的供血不受影响,肝功能受到保护,术后残肝功能足以耐受手术应激。③不良反应少。两组虽整体不良反应率相当,但TACE之后3级胆红素升高的风险更高,HAIC因未栓塞动脉,因此避免了栓塞综合征、异位栓塞等不良事件的发生,同时发热、腹痛、肿瘤溶解综合征等的发生也较少[16-17]。笔者猜测,HAIC相比于TACE,可能更直接地杀伤肿瘤组织,促进肿瘤相关抗原释放,募集及诱导肿瘤微环境中免疫细胞对肿瘤的杀伤,增强联合治疗的效果[18]。
综上所述,不论是HAIC还是TACE,联合抗血管生成及免疫治疗均安全且可耐受。HAIC相比TACE,在联合治疗中疗效较好。但仍有待大样本前瞻性随机对照研究进一步证实。随着更多抗血管生成药物及ICI的出现,深入挖掘和探索高效的联合治疗方案可能是近期提高晚期HCC病人生存率的关键[18]。HAIC联合抗血管生成及免疫治疗的三联治疗有可能成为中、晚期HCC的重要选择之一。
